Giải Hóa 10 Bài 17 ( Cánh diều): Nguyên tố và đơn chất halogen
Với giải bài tập Hóa 10 Bài 17: Nguyên tố và đơn chất halogen sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 17.
Giải bài tập Hóa lớp 10 Bài 17: Nguyên tố và đơn chất halogen
Video giải bài tập Hóa lớp 10 Bài 17: Nguyên tố và đơn chất halogen
Mở đầu trang 99 Hóa học 10: Vì sao nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn?
Trả lời:
Khi cho chlorine vào nước sẽ xảy ra phản ứng:
Cl2(aq) + H2O(l) ⇄ HCl(aq) + HClO(aq)
Phản ứng này là thuận nghịch nên tạo ra dung dịch gồm: nước, hydrochloric acid (HCl), hypochlorous acid (HClO còn được viết là HOCl) và chlorine. Dung dịch này còn được gọi là dung dịch nước chlorine, có tính oxi hóa mạnh có thể phá hủy các hợp chất màu và tiêu diệt vi khuẩn. Vì vậy, nước chlorine được sử dụng phổ biến để khử trùng, sát khuẩn trong các nguồn nước cấp, môi trường
I. Giới thiệu về nguyên tố nhóm VIIA
II. Đơn chất halogen
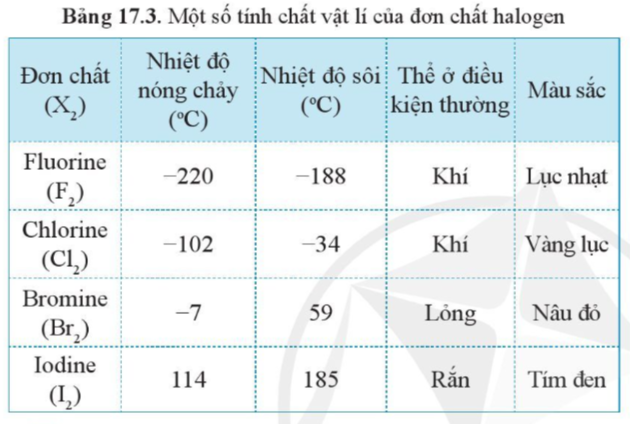
1. Xu hướng biến đổi một số tính chất vật lí
Luyện tập 1 trang 101 Hóa học 10: Dựa vào xu hướng biến đổi tính chất của các đơn chất halogen trong bảng 17.3, hãy dự đoán về thể (trạng thái) của đơn chất astatine ở điều kiện thường. Giải thích.
Trả lời:
Dựa vào bảng 17.3 ta có thể thấy thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine). Mà astatine có khối lượng phân tử lớn hơn iodine.
Vậy ta có thể dự đoán đơn chất astatine tồn tại ở thể rắn ở điều kiện thường.
Luyện tập 2 trang 101 Hóa học 10: Trong điều kiện thường, halogen nào ở thể rắn? Vì sao?
Trả lời:
Dựa theo xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
Khi phân tử X2 có kích thước càng lớn và càng nhiều electron thì tương tác van der Waals giữa các phân tử càng mạnh. Do đó, trong các halogen, tương tác tăng từ fluorine đến iodine.
Ở điều kiện thường bắt đầu từ iodine (I) tồn tại ở thể rắn, các nguyên tố có khối lượng phân tử lớn hơn iodine (I) là astatine (At), tennessine (Ts) cũng ở thể rắn
2. Xu hướng tạo liên kết trong các phản ứng hóa học
Luyện tập 3 trang 102 Hóa học 10: Calcium và fluorine kết hợp thành phân tử calcium fluoride, CaF2. Trong đó, nguyên tử nào đã nhường và nhường bao nhiêu electron? Nguyên tử nào đã nhận và nhận bao nhiêu electron?
Trả lời:
- Cấu hình electron Ca (Z = 20): [Ar]4s2
Nguyên tử Ca có 2 electron ở lớp ngoài cùng, có xu hướng nhường đi 2 electron để đạt được cấu hình electron bền vững giống khí hiếm:
Ca → Ca2+ + 2e
- Cấu hình electron F (Z = 9): [He]2s22p5
Nguyên tử F có 7 electron ở lớp ngoài cùng, có xu hướng nhận vào 1 electron để đạt được cấu hình electron bền vững giống khí hiếm:
F + 1e → F‑
Luyện tập 4 trang 102 Hóa học 10: Để hình thành phân tử phosphorus trichloride (PCl3) thì mỗi nguyên tử chloride và phosphorus đã góp chung bao nhiêu electron hóa trị? Viết công thức Lewis của phân tử.
Trả lời:
Cấu hình electron P (Z = 15): [Ne]2s22p3 → P có 5 electron lớp ngoài cùng, thiếu 3 electron để đạt được cấu hình electron bền vững.
Cấu hình electron Cl (Z = 17): [Ne]2s22p5 → Cl có 7 electron lớp ngoài cùng, thiếu 1 electron để đạt được cấu hình electron bền vững.
Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử Cl đều cần thêm 1 electron. Vì vậy, nguyên tử P sẽ góp chung 3 electron với 3 nguyên tử Cl để tạo nên 3 cặp electron chung cho cả hai nguyên tử.
Công thức Lewis của phân tử:
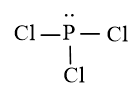
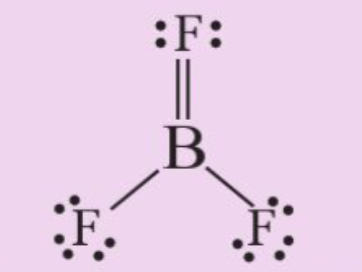
Luyện tập 5 trang 103 Hóa học 10: Theo hiệu độ âm điện, người ta dự đoán boron trifluoride là hợp chất ion. Tuy nhiên, trong thực tế nó là hợp chất cộng hóa trị, với công thức Lewis như sau:
a) Viết phương trình hóa học tạo chất trên từ các đơn chất.
b) Phân tử BF3 có bao nhiêu liên kết σ và bao nhiêu liên kết π?
Trả lời:
a) Phương trình hóa học:
2B (s) + 3F2 (g) → 2BF3 (g)
b) Dựa vào công thức xác định được: Phân tử BF3 gồm 3 liên kết σ và 1 liên kết π.
3. Xu hướng thể hiện tính oxi hóa
a) Phản ứng với hydrogen
Hoặc quan sát video thí nghiệm theo đường link sau:
https://www.youtube.com/wach?v=esGk1lh1Nds, truy cập ngày 30/3/2022.
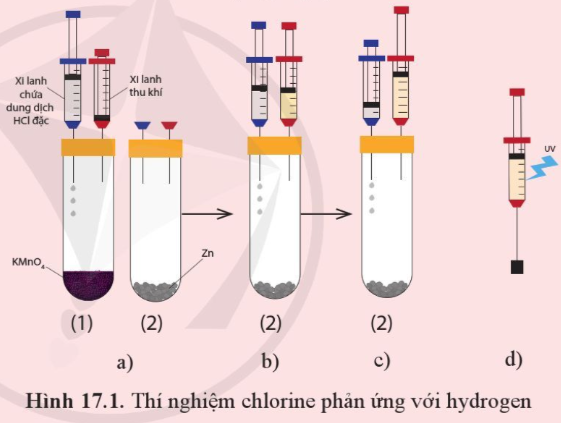
- Các dụng cụ thí nghiệm được mô tả như Hình 17.1a với các ống nghiệm cùng đặt vào một giá thí nghiệm.
- Bơm vài giọt dung dịch hydrochloric acid (HCl) đặc từ xi-lanh chứa acid vào ống nghiệm chứa tinh thể potassium permanganate (thuốc tím, KMnO4) - ống nghiệm (1) để tạo khí chlorine. Khi pit-tông nâng lên khoảng 12 chiều cao của xi-lanh thu khí thì ngừng bơm acid.
- Rút xi-lanh thu khí ra khỏi ống nghiệm (1), chuyển sang ghim vào ống nghiệm chứa kẽm - ống nghiệm (2). Chuyển xi-lanh chứa dung dịch hydrochloric acid sang ống nghiệm (2). (Hình 17.1b)
- Bơm vài giọt dung dịch hydrochloric acid từ xi-lanh chứa acid vào ống nghiệm (2) để tạo khí hydrogen. Đến khi pit-tông được nâng lên khoảng 23 xi-lanh thu khí thì ngừng bơm acid. (Hình 17.1c)
- Rút xi-lanh thu khí ra khỏi ống nghiệm (2). Ghim xi-lanh chứa hỗn hợp khí vào một nút cao su như hình 17.1d rồi kẹp vào giá thí nghiệm.
- Dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh).
+ Quan sát và giải thích hiện tượng xảy ra khi dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc khi dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen có thể xảy ra hiện tượng như đã thấy trong thí nghiệm trên không? Giải thích.
Trả lời:
+ Khi dùng đèn tử ngoại chiếu vào xi-lanh chứa hỗn hợp khí (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh)
Hiện tượng: Có tiếng nổ trong xi-lanh, màu vàng lục của khí Cl2 biến mất.
Giải thích: Khi có đèn tử ngoại chiếu vào xi-lanh (hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi-lanh) khí H2 đã xảy ra phản ứng với khí Cl2 (có màu vàng lục) tạo sản phẩm không màu là khí HCl.
Phương trình hóa học của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
+ Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không có tiếng nổ như phản ứng của khí chlorine với hydrogen.
Phản ứng giữa hơi iodine và hydrogen là phản ứng thuận nghịch, cần đun nóng (ngoài ra cần có thêm xúc tác Pt) để phản ứng diễn ra.
Phương trình hóa học: H2 (g) + I2 (g) ⇄ 2HI (g)
b) Phản ứng thế halogen
Thực hành trang 105 Hóa học 10:
- Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium bromide hoặc potassium bromide loãng.
- Nhỏ tiếp vào ống nghiệm vài giọt nước chlorine và lắc nhẹ.
- Có thể tiếp tục nhỏ vào ống nghiệm khoảng 2 mL cyclohexane.
- Nhỏ vào ống nghiệm khoảng 2 mL dung dịch sodium iodide hoặc potassium iodide loãng.
- Nhỏ tiếp vào ống nghiệm vài giọt nước bromine loãng và lắc nhẹ.
- Thêm tiếp vào ống nghiệm vài giọt hồ tinh bột.
Giải thích các hiện tượng xảy ra và minh họa bằng phương trình hóa học.
Trả lời:
Thí nghiệm 1: Khi cho nước chlorine (Cl2) màu vàng rất nhạt vào dung dịch sodium bromide (NaBr) không màu hoặc dung dịch potassium bromide (KBr) không màu thì tạo ra dung dịch màu vàng nâu của bromine (Br2)
Phương trình hóa học:
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
Hoặc Cl2(aq) + 2KBr(aq) → 2KCl(aq) + Br2(aq)
(Chú ý: Cyclohexane đóng vai trò là dung môi tách Br2; giúp đễ dàng quan sát phản ứng)
Thí nghiệm 2:
Hiện tượng: Khi cho nước bromine (Br2) màu vàng nâu vào dung dịch sodium iodide (NaI) không màu hoặc potassium iodide (KI) không màu có thêm hồ tinh bột thì thấy dung dịch màu vàng nâu chuyển sang màu xanh tím.
Giải thích: Br2 (màu vàng nâu) đã phản ứng với dung dịch NaI hoặc KI (không màu) để hình thành đơn chất I2. Sau đó tinh bột hấp thụ I2 tạo hợp chất có màu xanh tím đặc trưng.
Phương trình hóa học:
Br2(aq) + 2NaI(aq) → 2NaBr(aq) + I2(s)
Hoặc Br2(aq) + 2KI(aq) → 2KBr(aq) + I2(s)
c) Phản ứng với nước, với dung dịch sodium hydroxide
Câu hỏi trang 105 Hóa học 10: Nhỏ nhanh vài giọt bromine màu nâu đỏ vào ống nghiệm chứa nước, đậy kín, lắc đều. Trong dung dịch bromine có những chất nào? Vì sao?
Trả lời:
Phương trình hóa học của phản ứng:
Br2(aq) + H2O(l) ⇄ HBr(aq) + HBrO(aq)
Phản ứng là thuận nghịch nên trong dung dịch sẽ gồm: Br2, H2O, HBr, HBrO.
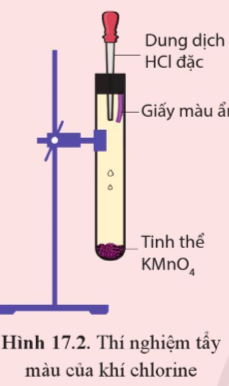
Thực hành trang 106 Hóa học 10: Thí nghiệm tính tẩy màu của khí chlorine.
Chuẩn bị thí nghiệm như hình 17.2
Trả lời:
Hiện tượng: Xuất hiện khí màu vàng lục. Khí này bay lên làm mất màu giấy màu ẩm.
Giải thích:
- Dung dịch hydrochloric acid (HCl) chảy xuống ống nghiệm, tác dụng với tinh thể KMnO4 tạo khí chlorine (Cl2) có màu vàng lục.
16HCl (aq) + 2KMnO4 (s) → 5Cl2(g) + 8H2O (l) + 2KCl (aq) + 2MnCl2 (aq)
- Khí chlorine (Cl2) bay lên tác dụng với nước trong giấy màu ẩm tạo dung dịch nước chlorine gồm: H2O, Cl2, HCl, HClO
Cl2(aq) + H2O(l) ⇄ HCl(aq) + HClO(aq)
- Dung dịch nước chlorine này có tính tẩy màu nên đã làm giấy màu ẩm mất màu.
Trả lời:
Nguyên tử nguyên tố halogen đều có 7 electron lớp ngoài cùng, do đó nguyên tử halogen rất dễ dàng nhận thêm 1 electron để đạt cấu hình bền vững của khí hiếm. Vì thế chúng dễ dàng tham gia các phản ứng hóa học.
⇒ Các halogen không tồn tại tự do trong thiên nhiên.
Bài tập (trang 107)
Trả lời:
Phương trình hóa học để chứng minh chlorine có tính oxi hóa mạnh hơn bromine.
Cl2(aq) + 2KBr(aq) → 2KCl(aq) + Br2(aq)
Nguyên tố chlorine đã thay thế bromine trong muối potassium bromide.
NaCl(aq) + H2O(l) → A(aq) + X(g) + Y(g) (*)
Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến.
Từ phản ứng kết hợp giữa X và Y sẽ tạo được hydrogen chloride.
a) Hãy cho biết công thức hóa học của A, X, Y.
b) Hoàn thành phương trình hóa học (*).
Trả lời:
a) A là NaOH
X là H2
Y là Cl2
Giải thích lựa chọn:
- Từ phản ứng giữa Y (Cl2) với dung dịch A (NaOH) sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
Cl2(aq) + 2NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l)
- Từ phản ứng kết hợp giữa X (H2) và Y (Cl2) sẽ tạo được hydrogen chloride (HCl).
H2(g) + Cl2(g) → 2HCl(g)
b) Hoàn thành phương trình hóa học:
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + H2(g) + Cl2(g) (*)
Dựa vào xu hướng biến đổi một số tính chất của nhóm halogen, hãy dự đoán:
a) Tính oxi hóa của nguyên tử astatine mạnh hơn hay yếu hơn so với nguyên tử iodine?
b) Đơn chất astatine có màu đậm hơn hay nhạt hơn so với đơn chất iodine?
Trả lời:
a) Trong nhóm halogen (VII) theo chiều tăng dần điện tích hạt nhân nguyên tử, tính oxi hóa giảm dần (từ fluorine đến iodine). Ta có thể dự đoán tính oxi hóa của nguyên tử astatine yếu hơn so với nguyên tử iodine.
b) Màu sắc của các đơn chất halogen từ fluorine (màu lục nhạt) đến iodine (màu tím đen) biến đổi theo xu hướng đậm dần.
Ta có thể dự đoán đơn chất astatine có màu đậm hơn so với đơn chất iodine.
Bài 4 trang 107 Hóa học 10: Tra cứu các giá trị năng lượng liên kết ở phụ lục 2.
a) Hãy tính biến thiên enthalpy chuẩn ∆rHo298 của hai phản ứng dưới đây:
b) Dựa vào biến thiên enthalpy chuẩn, cho biết phản ứng nào thuận lợi hơn về mặt năng lượng.
Trả lời:
a) F2(g) + H2(g) → 2HF(g)
∆rHo298 = EH-H + EF-F – 2 × FH-F
∆rHo298 = 436 + 159 – 2 × 565 = -535 kJ
O2(g) + 2H2(g) → 2H2O(g)
∆rHo298 = 2 × Eb(H2) + Eb(O2) – 2 × Eb(H2O)
∆rHo298 = 2 × EH-H + Eb(O2) – 2 × 2 × EO-H
∆rHo298 = 2 × 436 + 498 – 2 × 2 × 464 = -486 kJ
b) ∆rHo298 của phản ứng F2(g) và H2(g) âm hơn
⇒ Phản ứng oxi hóa - khử giữa F2(g) và H2(g) thuận lợi hơn.
Hãy trả lời các câu hỏi sau đây:
a) Dấu hiệu nào cho thấy chlorine có trong nước sinh hoạt?
b) Vì sao người ta cần cho chlorine đến dư vào nước sinh hoạt?
c) Có thể loại bỏ khí chlorine dư trong nước sinh hoạt bằng những cách nào?
Trả lời:
a) Chlorine có màu vàng lục, có mùi xốc. Mở vòi nước sinh hoạt thấy có mùi xốc của khí chlorine chứng tỏ trong nước sinh hoạt có chứa chlorine.
b) Người ta cần cho chlorine đến dư vào nước sinh hoạt vì:
Lượng chlorine dư còn có tác dụng ngăn ngừa nước bị tái nhiễm vi khuẩn trong quá trình vận chuyển và lưu trữ.
c) Phương pháp để loại bỏ khí chlorine dư trong nước sinh hoạt là:
- Sử dụng than hoạt tính. Carbon trong than hoạt tính sẽ tương tác trực tiếp với chlorine, giúp loại bỏ chlorine và các hợp chất chlorine bằng cơ chế hấp thụ bề mặt.
- Sử dụng máy lọc nước RO (reverse osmosis: thẩm thấu ngược).
Lý thuyết Nguyên tố và đơn chất halogen
I. Giới thiệu về nguyên tố nhóm VIIA
- Các nguyên tố nhóm VIIA gồm fluorine, chlorine, bromine, iodine và hai nguyên tố phóng xạ astatine, tennessine.
- Một số đặc điểm của nguyên tố halogen được thể hiện trong bảng sau:
Bảng 17.1. Một số đặc điểm của các nguyên tố halogen
|
Nguyên tố |
Số hiệu nguyên tử |
Cấu hình electron nguyên tử |
Độ âm điện |
Bán kính nguyên tử (pm) |
|
Fluorine (F) |
9 |
[He]2s22p5 |
3,98 |
42 |
|
Chlorine (Cl) |
17 |
[Ne]3s23p5 |
3,16 |
79 |
|
Bromine (Br) |
35 |
[Ar]3d104s24p5 |
2,96 |
94 |
|
Iodine (I)_ |
53 |
[Kr]4d105s25p5 |
2,66 |
115 |
|
Astatine (At) |
85 |
[Xe]4f145d106s26p5 |
2,20 |
127 |
|
Tennessine (Ts) |
117 |
[Rn]5f146d107s27p5 |
- |
- |
- Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron ở lớp ngoài cùng, dạng ns2np5. Vì vậy chúng là các phi kim.
- Một số dạng tồn tại của các nguyên tố halogen phổ biến trong tự nhiên được thể hiện trong bảng sau:
Bảng 17.2. Một số dạng tồn tại trong tự nhiên của các nguyên tố halogen
|
Nguyên tố |
Một số dạng tồn tại trong tự nhiên |
|
Fluorine |
- CaF2 là thành phần chính của quặng fluorite. - Na3AlF6 là thành phần chính của quặng cryolite. - Ca5F(PO4)3 là thành phần chính của quặng fluorapatite. |
|
Chlorine |
- NaCl trong mỏ muối. - Các hợp chất chloride (chứa Cl-) tan trong nước biển, nước sông, trong máu động vật. - KCl.MgCl2.6H2O là thành phần chính của khoáng vật carnallite. - NaCl.KCl là thành phần chính của khoáng vật sylvinite. - HCl trong dịch dạ dày. |
|
Bromine |
Các hợp chất bromide (chứa Br-) tan trong nước biển, nước sông. |
|
Iodine |
Các hợp chất iodide, iodate (chứa I-, IO−3) có trong nước biển, nước sông, rong biển. |
II. Đơn chất halogen
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2.
1. Xu hướng biến đổi một số tính chất vật lí
- Một số tính chất vật lí của đơn chất halogen được thể hiện trong bảng sau:
Bảng 17.3. Một số tính chất vật lí của đơn chất halogen
|
Đơn chất (X2) |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
Thể ở điều kiện thường |
Màu sắc |
|
Fluorine (F2) |
-220 |
-188 |
Khí |
Lục nhạt |
|
Chlorine (Cl2) |
-102 |
-34 |
Khí |
Vàng lục |
|
Bromine (Br2) |
-7 |
59 |
Lỏng |
Nâu đỏ |
|
Iodine (I2) |
114 |
185 |
Rắn |
Tím đen |
- Nhận xét:
+ Nhiệt độ sôi, nhiệt độ nóng chảy của các đơn chất halogen tăng dần từ F2 đến I2.
Giải thích: Khi phân tử X2 có kích thước càng lớn và càng nhiều electron thì mức độ chuyển động hỗn loạn của các electron càng cao. Vì vậy, thường xuyên có sự phân bố không đều các electron tại một thời điểm nào đó, dễ làm xuất hiện các lưỡng cực tạm thời ở mỗi phân tử.
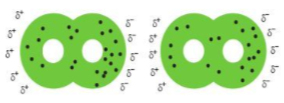
Hình 17.1. Minh họa tương tác van der Waals giữa hai phân tử iodine
→ Điều này sẽ làm tăng tương tác van der Waals giữa các phân tử halogen X2 với nhau. Dó đó, trong các đơn chất halogen, tương tác van der Waals tăng từ fluorine đến iodine. Điều này dẫn đến, nhiệt độ sôi, nhiệt độ nóng chảy của các đơn chất halogen tăng dần từ F2 đến I2.
+ Thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine), phù hợp với xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
+ Màu sắc của các đơn chất halogen từ fluorine đến iodine cũng biến đổi theo xu hướng đậm dần.
2. Xu hướng tạo liên kết trong các phản ứng hóa học
Nguyên tử của các nguyên tố halogen đều có 7 electron hóa trị. Vì vậy, theo quy tắc octet, halogen thường có hai xu hướng tạo liên kết khi phản ứng với các chất khác.
- Xu hướng thứ nhất: nhận thêm 1 electron tử nguyên tử khác.
+ Xu hường này xảy ra khi khi đơn chất halogen phản ứng với nhiều kim loại khác nhau. Khi đó, mỗi nguyên tử X nhận thêm 1 electron từ nguyên tử kim loại để trở thành anion có điện tích 1-, đồng thời nguyên tử kim loại sẽ trở thành cation có điện tích n+. Cả cation và anion đều thỏa mãn quy tắc octet. Giữa chúng sẽ có tương tác tĩnh điện để tạo hợp chất có liên kết ion.
Ví dụ: Khi chlorine phản ứng với calcium, có sự nhường và nhận electron như sau:
Cl2 + 2e → 2Cl-
Ca → Ca2+ + 2e
Phương trình hóa học của phản ứng:
Ca(s) + Cl2(g) → CaCl2(s)
Lưu ý: Halogen kết hợp với nhiều kim loại tạo ra muối halide có công thức MXn như NaCl, KBr, KI, CaCl2, CuCl2, … Các muối halide của kim loại là hợp chất ion, nên hầu hết tan tốt trong nước (trừ AgCl, AgBr, AgI).
- Xu hướng thứ hai: góp chung electron hóa trị với nguyên tử nguyên tố khác
+ Khi đơn chất halogen phản ứng với một số phi kim thì mỗi nguyên tử X có thể góp chung electron hóa trị với nguyên tử phi kim đều cả hai nguyên tử đều đạt cấu hình electron thỏa mãn quy tắc octet. Giữa chúng hình thành chất có liên kết cộng hóa trị.
Ví dụ: Trong phản ứng giữa chlorine và hydrogen, nguyên tử của mỗi chất sẽ góp chung 1 electron độc thân để hình thành liên kết cộng hóa trị, Khi đó quanh nguyên tử H sẽ có 2 electron như khí hiếm helium, xung quanh chlorine sẽ có 8 electron như khí hiếm neon, với mô tả theo công thức electron như sau:
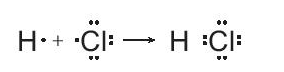
Phương trình hóa học của phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
- Kết luận: để thỏa mãn quy tắc octet, nguyên tử halogen sẽ nhận thêm 1 electron của nguyên tử khác hoặc góp chung 1 electron với nguyên tử khác. Vì vậy:
+ Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn.
+ Hóa trị phổ biến của các halogen là 1.
3. Xu hướng thể hiện tính oxi hóa
- Ngoại trừ fluorine, các halogen còn lại thể hiện cả tính oxi hóa và tính khử trong các phản ứng hóa học. Tuy nhiên, xu hướng thể hiện tính oxi hóa phổ biến hơn rất nhiều và trở nên đặc trưng hơn so với xu hướng thể hiện tính khử.
- Các đơn chất halogen đều có tính oxi mạnh và tính oxi hóa giảm dần từ fluorine đến iodine
a) Phản ứng với hydrogen
- Các đơn chất halogen đều phản ứng với hydrogen tạo hydrogen halide nhưng trong các điều kiện phản ứng và điều kiện khác nhau.
Bảng 17.4. Điều kiện và mức độ phản ứng của đơn chất halogen với hydrogen, năng lượng liên kết H - X
|
Phản ứng tạo HX |
Điều kiện và mức độ phản ứng |
Năng lượng liên kết H – X (kJ mol-1) |
|
H2(g) + F2(g) → 2HF(g) |
Diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp |
565 |
|
H2(g) + Cl2(g) → 2HCl(g) |
Nổ khi đun nóng. Hoặc nổ ngay ở nhiệt độ thường khi được chiếu tia tử ngoại |
431 |
|
H2(g)+ Br2(g) → 2HBr(g) |
Cần đun nóng để phản ứng diễn ra. Phản ứng diễn ra chậm |
364 |
|
H2(g)+ I2(g) ⇄ 2HI(g) |
Cần đun nóng để phản ứng diễn ra. Phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại |
297 |
- Nhận xét:
+ Mức độ phản ứng với hydrogen giảm dần từ fluorine đến iodine, phù hợp với xu hướng giảm tính oxi hóa của dãy halogen tử fluorine đến iodine.
+ Các phản ứng đều tạo ra HX. Năng lượng liên kết H – X giảm dần làm cho độ bền nhiệt của các phân tử giảm dần từ HF đến HI. Trong đó, phân tử HI có độ bền nhiệt thấp, dễ bị phân hủy một phần để tái tạo lại iodine và hydrogen theo phản ứng:
2HI(g) ⇄ H2(g)+ I2(g)
b) Phản ứng thế halogen
- Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Lưu ý: Trong dung dịch thì fluorine không có phản ứng trên. Đó là do fluorine ưu tiên phản ứng với nước.
Ví dụ: Nguyên tố chlorine đã thay thế nguyên tố bromine trong muối sodium bromide.
Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq)
c) Phản ứng với nước, với dung dịch sodium hydroxide
- Trừ fluorine, các halogen còn lại khi phản ứng với nước hoặc dung dịch sodium hydroxide (NaOH) đều thể hiện tính oxi hóa và tính khử.
- Khi cho các halogen vào nước thì fluorine phản ứng mạnh, chlorine và bromine đều phản ứng thuận nghịch với nước, còn iodine tan rất ít và hầu như không phản ứng.
20F2(aq) + 2H2O(l) → O2(g) + 4H−1F(aq)
0Cl2(aq) + H2O(l)⇄ H−1Cl(aq) + H+1ClO(aq)
0Br2(aq) + H2O(l) ⇄ H−1Br(aq) + H+1BrO(aq)
- Phản ứng giữa chlorine và nước là phản ứng thuận nghịch nên tạo ra dung dịch gồm nước, hydrochloric acid (HCl), hydrochlorous acid (HClO, còn được viết là HOCl). Dung dịch này còn được gọi là dung dịch nước chlorine, có tính sát khuẩn. Vì vậy, nước chlorine được sử dụng để xử lí vi khuẩn trong các nguồn nước cấp hoặc xử lí môi trường.
- Trong công nghiệp, sử dụng phản ứng giữa chlorine với sodium hydroxide lạnh (khoảng 15oC) để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, tẩy màu. Phương trình hóa học tạo nước Javel như sau:
0Cl2(aq) + 2NaOH(aq) → Na−1Cl(aq) + Na+1ClO(aq)

Hình 17.1. Nước Javel dùng để sát khuẩn, tẩy rửa
- Ở 70oC, phản ứng giữa chlorine với sodium hydroxide xảy ra như sau:
30Cl2(aq) + 6NaOH(aq) 70oC→5Na−1Cl(aq) + Na+5ClO3(aq) + 3H2O(l)
→ Phản ứng này thuộc loại phản ứng tự oxi hóa, tự khử. Đó là do chlorine vừa giảm số oxi hóa, vừa tăng số oxi hóa.
Xem thêm lời giải bài tập Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 18: Hydrogen halide và hydrohalic acid
Bài 2: Thành phần của nguyên tử
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Xem thêm tài liệu Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều