Các dạng bài tập Hóa học lớp 12 Giữa học kì 2
Tổng hợp các dạng bài tập Hóa học lớp 12 Giữa học kì 2 gồm các dạng Hóa học từ cơ bản đến nâng cao với phương pháp giải chi tiết giúp học sinh nắm vững kiến thức từ đó biết cách giải bài tập Hóa học 12.
Các dạng bài tập Hóa học lớp 12 Giữa học kì 2
Các dạng bài tập Đại cương kim loại
Trắc nghiệm lý thuyết Chương 5 Đại cương kim loại có lời giải
Bài tập về dãy điện hóa của kim loại và cách giải
Các dạng toán khử oxit kim loại bằng C, H2, CO, kim loại mạnh và cách giải
Các dạng bài toán điện phân và cách giải
Công thức tính lượng chất thu được ở điện cực hay nhất
Các dạng bài tập Kim loại kiềm, kiềm thổ, nhôm
Trắc nghiệm lý thuyết Chương 6 Kim loại kiềm, kiềm thổ, nhôm
Bài tập xác định kim loại và cách giải
Các dạng toán cho hỗn hợp kim loại kiềm, kim loại kiềm thổ, nhôm tác dụng với nước và cách giải
Các dạng toán CO2, SO2 tác dụng với dung dịch kiềm và cách giải
Các dạng bài toán về muối cacbonat và cách giải
Bài tập về phản ứng nhiệt nhôm và cách giải
Các dạng toán về sự lưỡng tính của Al(OH)3 và cách giải
Các dạng toán về nước cứng và cách giải
Công thức tính bài toán nhiệt nhôm hay nhất
Công thức tính nhanh số mol H+ khi cho từ từ axit vào muối AlO2 (muối aluminat) hay nhất
Bài tập về dãy điện hóa của kim loại và cách giải – Hoá học lớp 12
A. Lý thuyết ngắn gọn
1. Cặp oxi hóa - khử của kim loại :
![]()
Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại tạo nên cặp oxi hóa – khử của kim loại (Mn+ / M). Thí dụ ta có các cặp oxi hóa – khử : Ag+ / Ag ; Cu2+ / Cu ; Fe2+ / Fe ...
2. Dãy điện hóa của kim loại:

3. So sánh tính chất của các cặp oxi hóa – khử :
** Thí dụ 1 :
Cho đinh sắt vào dung dịch CuSO4 : Fe + Cu2+ → Fe2+ + Cu
Ngược lại, cho Cu vào dung dịch FeSO4 : không phản ứng .
→ kết luận : Fe có tính khử mạnh hơn Cu ; Cu2+ có tính oxi hóa mạnh hơn Fe2+ .
** Thí dụ 2 :
Cho Cu vào dung dịch AgNO3 : Cu + 2Ag+ → Cu2+ + 2Ag
Ngược lại : cho Ag vào dung dịch Cu(NO3)2 : không phản ứng.
→ kết luận : tính khử Cu > Ag ; tính oxi hóa Ag+ > Cu2+
Từ 2 thí dụ trên :
Tính khử Fe > Cu > Ag;
Tính oxi hóa Fe2+ < Cu2+ < Ag+
4. Ý nghĩa dãy điện hóa của kim loại:
- Tính oxi hóa của ion Mn+ càng mạnh thì tính khử của kim loại M càng yếu và ngược lại (tính oxi hóa của ion Mn+ càng yếu thì tính khử của kim loại M càng mạnh).
- Dự đoán chiều của phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn sinh ra chất oxi hóa yếu hơn và chất khử yếu hơn (quy tắc α ).
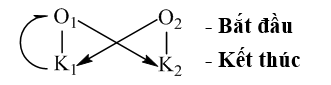
Thí dụ: phản ứng giữa 2 cặp Ag+ /Ag và Cu2+ /Cu là:
Cu + 2Ag+ → Cu2+ + 2Ag
Khử mạnh oxh mạnh oxh yếu khử yếu
B. Các dạng bài
Dạng 1: Kim loại tác dụng với nước
1.Phương pháp giải
– Lưu ý:
a. Kim loại mạnh : nhóm IA và IIA (trừ Be không khử được nước, Mg khử chậm). Các kim loại còn lại khử mạnh nước ở nhiệt độ thường, giải phóng khí H2 .
2M + 2nH2O → 2M(OH)n + nH2
Ví dụ:
2Na + 2H2O → 2NaOH + H2
Ca + H2O → Ca(OH)2 + H2
b. Kim loại trung bình : Fe, Zn ... khử được hơi nước ở nhiệt độ cao.
Ví dụ:
3Fe + 4H2O Fe3O4 + 4H2
c. Kim loại yếu : Cu, Ag, Au ... không khử được nước dù ở nhiệt độ cao.
– Để giải các bài tập có thể viết phương trình và tính theo phương trình. Hoặc áp dụng định luật bảo toàn nguyên tố,bảo toàn electron, bảo toàn khối lượng.
2. Ví dụ minh họa
Ví dụ 1: Cho 3,9 gam kali vào 101,8 gam nước thu được dung dịch KOH có nồng độ % là bao nhiêu?
A. 5,31%.
B. 5,20%.
C. 5,30%.
D. 5,50%
Lời giải chi tiết
Theo giả thiết:
Phương trình hóa học:
2K + 2H2O 2KOH + H2
Theo phương trình:
Áp dụng định luật bảo toàn khối lượng:
![]()
Nồng độ phần trăm của dung dịch KOH là:
Chọn C.
Ví dụ 2: Cho m gam Na tan hết vào 500 ml dung dịch Ba(OH)2 0,04M được 500 ml dung dịch có pH = 13. Giá trị của m là
A. 0,23 gam.
B. 0,46 gam.
C. 1,15 gam.
D. 0,276 gam.
Lời giải chi tiết
Gọi số mol của Na là x mol
→ nNaOH = x mol
Dung dịch thu được có pH = 13
→ pOH = 14 – 13 = 1 → [OH –] = 10-1 = 0,1M
→ x + 0,04 = 0,1.0,5
→ x = 0,01
→ mNa = 0,23 gam
Chọn A.
Dạng 2: Kim loại tác dụng với axit HCl, H2SO4 loãng
1. Phương pháp giải
Viết phương trình hóa học và tính theo phương trình hóa học.
Kim loại + HCl/H2SO4 loãng → muối + H2
Chú ý: Chỉ các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với HCl, H2SO4 loãng.
Ngoài ra có thể áp dụng các định luật bảo toàn:
+ Bảo toàn nguyên tố H:
→ hỗn hợp hai axit:
+ Bảo toàn khối lượng:
mkim loại + m+ maxit = mmuối
và mmuối = mkim loại + mgốc axit
+ Bảo toàn electron: ne nhường = ne nhận
2. Ví dụ minh họa
Ví dụ 1: Cho m gam Fe tác dụng với dung dịch HCl dư thu được 1,12 lít khí H2 (đktc). Giá trị của m là
A. 5,60.
B. 1,12.
C. 2,80.
D. 1,40.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
Chọn C.
Ví dụ 2: Hòa tan hoàn toàn Fe vào dung dịch H2SO4 loãng vừa đủ thu được 4,48 lít H2 (đktc). Cô cạn dung dịch trong điều kiện không có oxi thu được m gam muối khan. Giá trị của m là
A. 30,4.
B. 15,2.
C. 22,8.
D. 20,3.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
Chọn A.
Dạng 3: Kim loại tác dụng với muối
1. Phương pháp giải
Viết phương trình hóa học theo thứ tự phản ứng (nếu nhiều kim loại, nhiều muối phản ứng) và tính theo phương trình hóa học.
+ Kim loại mạnh (Kim loại kiềm, Ca, Ba): Ban đầu kim loại tác dụng với nước
Kim loại + H2O → kiềm + H2
Sau đó kiềm tác dụng với dung dịch muối
Kiềm + muối → sản phẩm (điều kiện: có kết tủa, bay hơi hoặc chất điện ly yếu)
+ Các kim loại trung bình và yếu: Kim loại đứng trước đẩy kim loại đứng sau khỏi dung dịch muối.
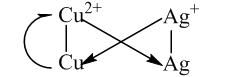
Chú ý: Các trường hợp cần nhớ:
Muối Fe2+ tác dụng được với muối Ag+
Fe2+ + Ag+ → Fe3+ + Ag
Fe tác dụng với muối Fe3+ thì tạo ra muối Fe2+
Fe + 2Fe3+ → 3Fe2+
Ngoài ra có thể áp dụng phương pháp tăng giảm khối lượng, bảo toàn electron.
2. Ví dụ minh họa
Ví dụ 3: Cho m gam hỗn hợp Na, K vào dung dịch chứa muối CuSO4 thu được dung dịch vẫn còn màu xanh, 3,36 lít khí H2 (đktc) và chất rắn B không tan. Lọc lấy chất rắn, đem nung trong không khí đến khối lượng không đổi thì được m gam rắn C. Giá trị của m là
A. 9,8.
B. 14,7.
C. 4,9.
D. 12,0.
Lời giải chi tiết
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2 (1)
2K + 2H2O → 2KOH + H2 (2)
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 (3)
CuSO4 + 2KOH → Cu(OH)2 + K2SO4 (4)
Cu(OH)2 CuO + H2O (5)
Theo (1) và (2) ta có:
Theo (3) và (4) ta có:
Theo (5) ta có:
→ mC = mCuO = 0,15.80 = 12 gam
Chọn D.
Ví dụ 2: m gam Fe phản ứng vừa đủ với 200 ml dung dịch CuSO4 1M. Giá trị của m là
A. 5,6.
B. 11,2.
C. 16,8.
D. 22,4.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
→ m = mFe = 0,2.56 = 11,2 gam
Chọn B.
C. Bài tập tự luyện
Câu 1: Cho 4,017 gam một kim loại kiềm X hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là
A. Na.
B. Li.
C. Rb.
D. K.
Câu 2: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Câu 3: Cho 3,6 gam hỗn hợp X gồm K và một kim loại kiềm M tác dụng vừa hết với nước, thu được 2,24 lít khí H2 ở 0,5 atm và 00C. Biết số mol kim loại M trong hỗn hợp lớn hơn 10% tổng số mol hai kim loại. M là kim loại
A. K.
B. Na.
C. Li.
D. Rb.
Câu 4: Hòa tan hoàn toàn 8,5 gam hỗn hợp X gồm Na và K vào nước, thu được dung dịch Y và V lít khí H2 (đktc). Trung hòa Y bằng H2SO4, sau đó cô cạn dung dịch, thu được 22,9 gam muối. Giá trị của V là
A. 6,72
B. 4,48
C. 3,36
D. 2,24
Câu 5: Hòa tan hoàn toàn hỗn hợp X gồm ba kim loại kiềm vào nước, thu được 4,48 lít khí H2 (đktc). Nếu cũng cho lượng X như trên tác dụng với O2 dư thì thu được ba oxit và thấy khối lượng chất rắn tăng m gam. Giá trị của m là
A. 3,2
B. 1,6
C. 4,8
D. 6,4
Câu 6: Cho 1,5 gam hỗn hợp Na và kim loại kiềm A tác dụng với H2O thu được 1,12 lít H2 (đktc). A là
A. Li
B. Na
C. K
D. Rb
Câu 7: Cho 4,9 gam kim loại kiềm M vào một cốc nước. Sau một thời gian lượng khí thoát ra đã vượt quá 7,5 lít (đktc). Kim loại kiềm M là
A. Li
B. Na
C. K
D. Rb
Câu 8: Cho 1,08 gam kim loại M (hóa trị II không đổi) tác dụng với dung dịch H2SO4 loãng vừa đủ, sau phản ứng thu được 5,4 gam muối sunfat trung hòa. Kim loại M là
A. Fe.
B. Mg.
C. Zn.
D. Ca.
Câu 9: Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí H2 (đktc). Phần trăm khối lượng của Al trong X là
A. 54,0%.
B. 49,6%.
C. 27,0%.
D. 48,6%.
Câu 10: Hòa tan hoàn toàn 2,17 gam hỗn hợp ba kim loại A, B, C trong dung dịch HCl dư thu được 2,24 lít khí H2 (đktc) và m gam muối. Giá trị của m là
A. 9,27.
B. 5,72.
C. 6,85.
D. 6,48.
Câu 11: Hòa tan hoàn toàn 15,4 gam hỗn hợp X gồm Zn và Mg bằng dung dịch HCl dư, thu được 6,72 lít khí H2 (đktc). Thể tích O2 (đktc) cần để phản ứng hoàn toàn với hỗn hợp X trên là
A. 4,48 lít.
B. 3,92 lít.
C. 2,08 lít.
D. 3,36 lít.
Câu 12: Hòa tan hoàn toàn 6,5 gam Zn bằng dung dịch H2SO4 loãng, thu được V lít khí H2 (đktc). Giá trị của V là
A. 4,48.
B. 2,24.
C. 3,36.
D. 1,12.
Câu 13: Cho hỗn hợp gồm 2,7 gam Al và 11,2 gam Fe tác dụng hoàn toàn với dung dịch HCl dư, sau phản ứng thu được V lít H2 (Ở đktc). Giá trị của V là
A. 7,84.
B. 8,96.
C. 6,72.
D. 10,08.
Câu 14: Cho 10,0 gam bột Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 3,36 lít khí H2 (đktc). Khối lượng Cu trong 10,0 gam hỗn hợp là
A. 2,8 gam.
B. 5,6 gam.
C. 8,4 gam.
D. 1,6 gam.
Câu 15: Ngâm một đinh sắt trong 100 ml dung dịch CuSO4 aM. Sau khi phản ứng kết thúc, lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 1,6 gam. Giá trị của a là
A. 2,0.
B. 0,2.
C. 1,0.
D. 0,1.
Câu 16: Cho 2,8 gam bột sắt vào 200 ml dung dịch gồm AgNO3 0,1M và Cu(NO3)2 0,5M. Khi các phản ứng xảy ra hoàn toàn thu được m gam chất rắn X. Giá trị của m là
A. 4,48.
B. 3,28.
C. 4,72.
D. 4,08.
Câu 17: Một hỗn hợp X gồm 6,5 gam Zn và 4,8 gam Mg cho vào 200 ml dung dịch Y gồm Cu(NO3)2 0,5M và AgNO3 0,3M thu được m gam chất rắn Z. Giá trị của m là
A. 23,61.
B. 12,16.
C. 20,16.
D. 21,06.
Câu 18: Ngâm một thanh Zn vào một cốc thủy tinh chứa 50 ml dung dịch Cu(NO3)2 0,5M đến khi dung dịch trong cốc mất hẳn màu xanh, thì khối lượng thanh Zn sau phản ứng sẽ
A. tăng 0,025 gam so với ban đầu.
B. giảm 0,025 gam so với ban đầu.
C. giảm 0,1625 gam so với ban đầu.
D. tăng 0,16 gam so với ban đầu.
Câu 19: Nhúng một thanh nhôm nặng 45 gam vào 400 ml dung dịch CuSO4 0,5M. Sau một thời gian lấy thanh nhôm ra cân nặng 46,38 gam. Khối lượng Cu thoát ra là
A. 0,64 gam.
B. 1,28 gam.
C. 1,92 gam.
D. 2,56 gam.
Câu 20: Ngâm một đinh sắt trong 200 ml dung dịch CuSO4 xM. Sau khi phản ứng hoàn toàn, lấy đinh sắt ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 3,2 gam. Giả sử tất cả lượng Cu sinh ra đều bám hết vào đinh sắt. Giá trị của x là
A. 1,0.
B. 1,5.
C. 2,0.
D. 0,5.
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
D |
B |
B |
C |
A |
A |
A |
B |
A |
A |
|
Câu 11 |
Câu 12 |
Câu 13 |
Câu 14 |
Câu 15 |
Câu 16 |
Câu 17 |
Câu 18 |
Câu 19 |
Câu 20 |
|
D |
B |
A |
D |
A |
C |
D |
B |
C |
C |
Bài tập xác định kim loại và cách giải – Hoá học lớp 12
A. Lý thuyết trọng tâm
– Kim loại kiềm khử nước dễ dàng ở nhiệt độ thường, giải phóng khí hiđro.
Ví dụ: 2K + 2H2O → 2KOH + H2
Tổng quát :
2A + 2H2O → 2AOH + H2
– Từ Li đến Cs phản ứng xảy ra với nước ngày càng mãnh liệt. Natri bị nóng chảy và chạy trên mặt nước. Kali tự bùng cháy, rubiđi và xesi phản ứng mãnh liệt khi tiếp xúc với nước. Vì các kim loại kiềm dễ tác dụng với nước, với oxi trong không khí nên bảo quản, người ta ngâm chìm các kim loại kiềm trong dầu hỏa.
– Nhóm kim loại kiềm thổ: Be không khử được nước, Mg khử chậm nước khi có nhiệt độ cao, các kim loại còn lại khử mạnh nước ở nhiệt độ thường giải phóng khí H2.
Tổng quát :
M + 2H2O → M(OH)2 + H2
B. Các dạng bài
Dạng 1: Xác định một kim loại dựa vào phản ứng
1. Phương pháp giải
Bước 1: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
– Công thức bảo toàn electron:
nhường = nhận
– Công thức bảo toàn nguyên tố: Giả sử ta có hợp chất AxBy
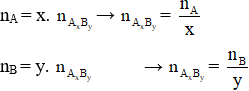
Chú ý:
Bước 2: Tính nguyên tử khối theo công thức (g/mol), từ đó suy ra tên kim loại
2. Ví dụ minh họa
Ví dụ 1: Hòa tan hết 4,68 gam kim loại kiềm M vào nước dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là
A. Rb.
B. Li.
C. K.
D. Na.
Lời giải chi tiết
Phương trình hóa học:
Theo phương trình:
(g/mol)
Vậy M là kim loại kali (K)
Chọn C.
Ví dụ 2: Cho 4,017 gam một kim loại kiềm X hòa tan vào nước dư được dung dịch Y. Trung hòa dung dịch Y cần vừa đủ 0,103 mol HCl. Kim loại X là
A. Na.
B. Li.
C. Rb.
D. K.
Lời giải chi tiết
Phương trình hóa học:
2X + 2H2O 2XOH + H2(1)
XOH + HCl XCl + H2O (2)
Theo phương trình (2): nXOH = nHCl = 0,103 mol
Theo phương trình (1): nX = nXOH = 0,103 mol
(g/mol)
Vậy X là kim loại kali (K)
Chọn D.
Dạng 2: Xác định hai kim loại liên tiếp trong một nhóm bằng phương pháp trung bình
1. Phương pháp giải
Bước 1: Đặt công thức chung của hai kim loại là R.
Bước 2: Viết phương trình phản ứng xảy ra rồi tính theo phương trình hóa học.
– Ngoài ra có thể dùng phương pháp bảo toàn nguyên tố hoặc bảo toàn electron để tính nhanh số mol.
Bước 3: Tính phân tử khối trung bình theo công thức , từ đó kết hợp với điều kiện của bài toán suy ra tên kim loại.
– Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước được trung hòa bởi H+ thì ta có:
– Nếu dung dịch bazơ tạo thành sau khi phản ứng với nước kết tủa với các cation kim loại thì viết phương trình ion và tính.
2. Ví dụ minh họa
Ví dụ 1: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong cùng nhóm IA. Lấy 6,2 gam X hòa tan hoàn toàn vào nước thu được 2,24 lít hiđro (đktc). A, B là
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Lời giải chi tiết
Đặt công thức chung của A và B là M
Phương trình phản ứng:
2M + 2H2O 2MOH + H2(1)
Theo phương trình:
Vậy hai kim loại là Na và K
Chọn B.
Ví dụ 2: A là hỗn hợp hai kim loại kiềm X và Y thuộc hai chu kì kế tiếp. Nếu cho A tác dụng vừa đủ với dung dịch HCl thì thu được a gam hai muối, còn nếu cho A tác dụng vừa đủ với dung dịch H2SO4 thì thu được 1,1807a gam hai muối. X và Y là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Lời giải chi tiết
Đặt công thức chung của hai kim loại kiềm là R, khối lượng mol trung bình của chúng là
Chọn số mol của R tham gia phản ứng là 1 mol
Phương trình phản ứng:
2R + 2HCl 2RCl + H2 (1)
2R + H2SO4 R2SO4 + H2 (2)
Theo phương trình (1):
(3)
Theo phương trình (2):
(4)
Từ (3) và (4) ta có
Nhận xét:
X và Y là Na và K
Chọn B.
C. Bài tập tự luyện
Câu 1: Cho 0,39 gam một kim loại kiềm X vào nước, thu được 0,112 lít khí H2 (ở đktc). Kim loại kiềm X là
A. Na.
B. K.
C. Li.
D. Cs.
Câu 2: Hòa tan hết 1,4 gam kim loại kiềm X vào 200 gam nước, thu được dung dịch có khối lượng là 201,2 gam. Kim loại kiềm X là
A. Rb.
B. Na.
C. K.
D. Li.
Câu 3: Hòa tan hết 1,15 gam kim loại X vào dung dịch HCl, thu được 0,56 lít khí (ở đktc). Kim loại X là
A. Na.
B. Ba.
C. K.
D. Ca.
Câu 4: Cho 0,3 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau vào nước, thu được 0,112 lít khí H2 (ở đktc). Hai kim loại kiềm là
A. Li, Na.
B. Na, K.
C. Li, K.
D. K, Cs.
Câu 5: Hòa tan hết 0,3 gam hỗn hợp gồm hai kim loại kiềm ở hai chu kì kế tiếp nhau vào dung dịch HCl dư, thu được 0,224 lít khí (ở đktc). Hai kim loại kiềm là
A. Li, Na.
B. Na, K.
C. K, Cs.
D. Li, K.
Câu 6: Đốt cháy hoàn toàn 4,6 gam kim loại kiềm X trong khí clo dư, thu được 11,7 gam muối. Kim loại kiềm X là
A. Na.
B. Li.
C. K.
D. Cs.
Câu 7: Cho 5,3 gam muối M2CO3 tác dụng với dung dịch HCl dư, thu được 1,12 lít khí ở đktc. Muối M2CO3 là
A. Na2CO3.
B. Li2CO3.
C. K2CO3.
D. Cs2CO3.
Câu 8: Hòa tan hoàn toàn 6,645 gam hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được 18,655 gam kết tủa. Hai kim loại kiềm trên là
A. Rb và Cs.
B. Na và K.
C. Li và Na.
D. K và Rb.
Câu 9: Hòa tan hết 0,897 gam kim loại X vào 4,459 ml nước tạo ra dung dịch kiềm có nồng độ 29,34%. Biết khối lượng riêng của nước là 1 g/ml. Kim loại X là
A. Na.
B. Ba.
C. K.
D. Ca.
Câu 10: Cho 3,6 gam hỗn hợp X gồm K và một kim loại kiềm M tác dụng vừa hết với nước, thu được 2,24 lít H2 ở 0,5 atm và 00C. Biết số mol kim loại M trong hỗn hợp lớn hơn 10% tổng số mol hai kim loại. M là kim loại
A. K.
B. Na.
C. Li.
D. Rb.
Câu 11: Cho 1,5 gam hỗn hợp Na và kim loại kiềm A tác dụng với nước thu được 1,12 lít H2 (đktc). A là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 12: Cho 4,9 gam kim loại kiềm M vào một cốc nước. Sau một thời gian lượng khí thoát ra đã vượt quá 7,5 lít (đktc). Kim loại kiềm M là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 13: Hỗn hợp X gồm hai kim loại A, B nằm kế tiếp nhau trong nhóm IA. Lấy 7,2 gam X hòa tan hoàn toàn vào nước thu được 4,48 lít hiđro (đktc). A, B là hai kim loại nào?
A. Li, Na.
B. Na, K.
C. K, Rb.
D. Rb, Cs.
Câu 14: Hai kim loại kiềm A và B nằm trong hai chu kì liên tiếp nhau trong bảng tuần hoàn các nguyên tố hóa học. Hòa tan hai kim loại này vào nước thu được 0,336 lít khí (đktc) và dung dịch C. Cho HCl dư vào dung dịch C thu được 2,075 gam muối, hai kim loại đó là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Li và K.
Câu 15: Cho hỗn hợp X gồm Na và một kim loại kiềm có khối lượng 6,2 gam tác dụng với 104 gam nước thu được 100 ml dung dịch có khối lượng riêng bằng 1,1 g/ml. Biết hiệu số hai khối lượng nguyên tử < 20. Kim loại kiềm là
A. Li.
B. K.
C. Rb.
D. Cs.
Câu 16: Có x mol hỗn hợp hai kim loại kiềm thuộc hai chu kì liên tiếp (hỗn hợp X). X tác dụng vừa đủ với dung dịch HCl thu được a gam hỗn hợp muối clorua khan, còn nếu cho X tác dụng vừa đủ với dung dịch H2SO4 thì thu được b gam hỗn hợp muối sunfat khan. Giá trị của x là
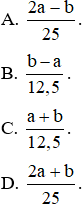
Câu 17: Cho từ từ dung dịch HCl có pH = 0 vào dung dịch chứa 5,25 gam hỗn hợp muối cacbonat của 2 kim loại kiềm kế tiếp đến khi có 0,015 mol khí thoát ra thì dừng lại. Cho dung dịch thu được tác dụng với dung dịch Ca(OH)2 dư sinh ra 3 gam kết tủa. Công thức của 2 muối và thể tích dung dịch HCl đã dùng là
A. Li2CO3 và Na2CO3; 0,03 lít.
B. Na2CO3 và K2CO3; 0,03 lít.
C. Li2CO3 và Na2CO3; 0,06 lít.
D. Na2CO3 và K2CO3; 0,06 lít.
Câu 18: Hoà tan hoàn toàn 27,4 gam hỗn hợp gồm M2CO3 và MHCO3 (M là kim loại kiềm) bằng dung dịch HCl dư thấy thoát ra 6,72 lít CO2 (đktc). Kim loại M là
A. Li.
B. Na.
C. K.
D. Rb.
Câu 19: Cho 17 gam hỗn hợp X gồm hai kim loại kiềm đứng kế tiếp nhau trong nhóm IA tác dụng với nước thu được 6,72 lít H2 (đktc) và dung dịch Y. Hỗn hợp X gồm
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Câu 20: Cho 6,2 gam hỗn hợp 2 kim loại kiềm tác dụng hết với nước thấy có 2,24 lít H2 (đktc) bay ra. Cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 9,4 gam.
B. 9,5 gam.
C. 9,6 gam.
D. 9,7 gam.
ĐÁP ÁN
|
Câu 1 |
Câu 2 |
Câu 3 |
Câu 4 |
Câu 5 |
Câu 6 |
Câu 7 |
Câu 8 |
Câu 9 |
Câu 10 |
|
B |
D |
A |
B |
A |
A |
A |
C |
A |
B |
|
Câu 11 |
Câu 12 |
Câu 13 |
Câu 14 |
Câu 15 |
Câu 16 |
Câu 17 |
Câu 18 |
Câu 19 |
Câu 20 |
|
A |
A |
A |
B |
B |
B |
D |
B |
B |
C |
Xem thêm các chương trình khác:
- Giải sgk Hóa học 12
- Lý thuyết Hóa học 12
- Giải sbt Hóa học 12
- Các dạng bài tập Hoá học lớp 12
- Giáo án Hóa học lớp 12 mới nhất
- Giải sgk Toán 12
- Các dạng bài tập Toán lớp 12
- Lý thuyết Toán 12
- Chuyên đề Toán lớp 12 mới nhất
- Bài tập Toán lớp 12 mới nhất
- Giáo án Toán lớp 12 mới nhất
- Tóm tắt tác phẩm Ngữ văn 12
- Soạn văn 12 (hay nhất) | Để học tốt Ngữ văn 12
- Soạn văn 12 (ngắn nhất)
- Tác giả tác phẩm Ngữ văn lớp 12
- Văn mẫu lớp 12
- Giải sgk Sinh học 12
- Lý thuyết Sinh học 12 | Kiến thức trọng tâm Sinh 12
- Giải sgk Địa Lí 12
- Lý thuyết Địa Lí 12
- Giải Tập bản đồ Địa Lí 12
- Giải sgk Vật Lí 12
- Giải sbt Vật Lí 12
- Lý thuyết Vật Lí 12
- Các dạng bài tập Vật lí lớp 12
- Giáo án Vật lí lớp 12 mới nhất
- Giải sgk Lịch sử 12
- Giải Tập bản đồ Lịch sử 12
- Lý thuyết Lịch sử 12
- Giải sgk Giáo dục công dân 12
- Lý thuyết Giáo dục công dân 12
- Giải sgk Giáo dục quốc phòng - an ninh 12
- Lý thuyết Giáo dục quốc phòng 12 | Kiến thức trọng tâm GDQP 12
- Góp ý sgk lớp 12 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi chính thức các môn THPT Quốc Gia các năm
- (3000+) Đề thi thử THPT Quốc Gia (các năm) từ các trường, sở trên cả nước
- Đề minh họa THPT quốc gia các năm
- Đề thi Đánh giá năng lực năm 2023 | Thông tin | Cấu trúc ĐGNL ĐHQG Hà Nội, HCM, ĐHBK, Bộ Công an
- Lý thuyết Tin học 12
- Lý thuyết Công nghệ 12
