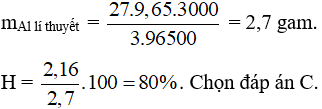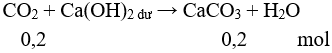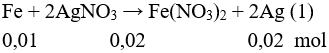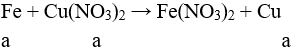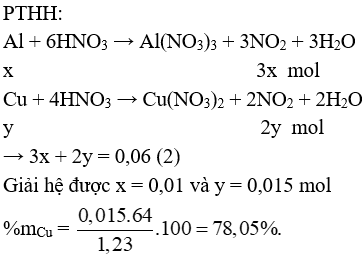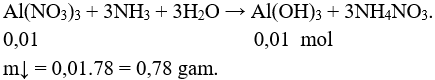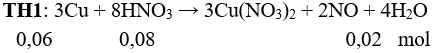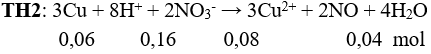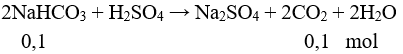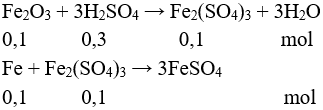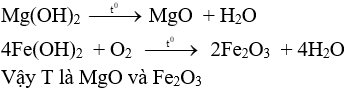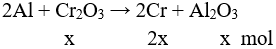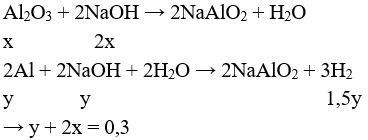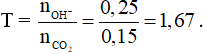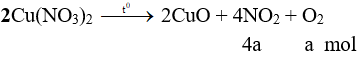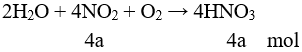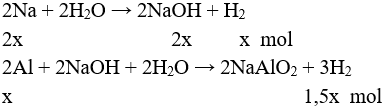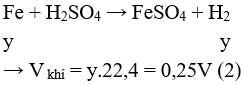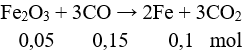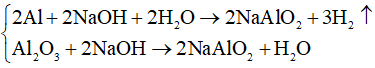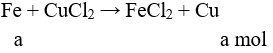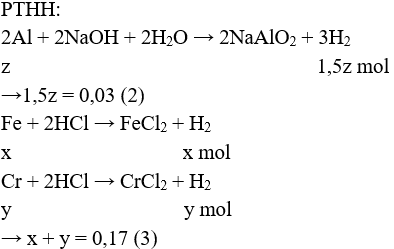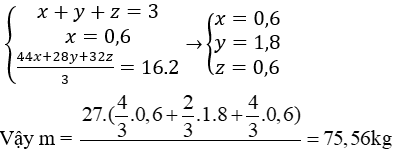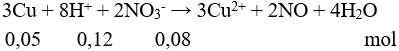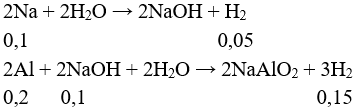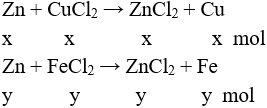TOP 10 Đề thi Học kì 2 Hóa học 12 năm 2024 có đáp án
Bộ Đề thi Học kì 2 Hóa học lớp 12 có đáp án hay nhất giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hoá học 12 Học kì 2. Mời các bạn cùng đón xem:
Chỉ 100k mua trọn bộ Đề thi Hóa học 12 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận đề thi.
Xem thử tài liệu tại đây: Link tài liệu
TOP 30 Đề thi Học kì 2 Hóa học lớp 12 năm 2024 có đáp án
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Nước cứng là nước có chứa nhiều ion:
A. Cl-.
B. HCO3-.
C. Ca2+, Mg2+.
D. SO42-.
Câu 2: Cho luồng khí CO (dư) đi qua hỗn hợp rắn X gồm MgO, CaO, Fe3O4, CuO đun nóng, kết thúc phản ứng thu được hỗn hợp rắn Y. Số kim loại trong Y là
A. 3.
B. 4.
C. 1.
D. 2.
Câu 3: Dung dịch chất nào sau đây có màu da cam?
A. K2Cr2O7.
B. K2CrO4.
C. Cr2O3.
D. Cr(OH)3.
Câu 4: Phương trình hóa học nào sau đây sai?
A. Cr2O3 + 2NaOH (đặc) ⟶ 2NaCrO2 + H2O.
B. Cr(OH)3 + 3HCl ⟶ CrCl3 + 3H2O.
C. 2Cr + 3H2SO4 (loãng) ⟶ CrSO4 + 3H2O.
D. 2Cr + 3Cl2 →t° 2CrCl3.
Câu 5: Để phân biệt các dung dịch riêng biệt: NaCl, FeCl2, FeCl3, có thể dùng dung dịch
A. NaOH.
B. HNO3.
C. Na2SO4.
D. HCl.
Câu 6: Hấp thụ hết V lít CO2 (đktc) vào nước vôi trong dư, kết thúc phản ứng thu được 8 gam kết tủa. Giá trị của V là
A. 0,896.
B. 3,584.
C. 1,792.
D. 1,344.
Câu 7: Chất nào sau đây làm mềm được nước cứng toàn phần?
A. Na2CO3.
B. CO2.
C. HCl.
D. NaCl.
Câu 8: Khử hoàn toàn a gam một oxit sắt bằng cacbon monooxit ở nhiệt độ cao, người ta thu được 0,84 gam sắt và 0,88 gam khí CO2. Công thức oxit sắt là
A. Fe2O3
B. FeO2
C. FeO
D. Fe3O4
Câu 9: Cho hỗn hợp gồm 6,4 gam Cu và 5,6 gam Fe tác dụng với dung dịch H2SO4 loãng dư, kết thúc phản ứng thu được V lít khí (đktc). Giá trị của V là
A. 2,24.
B. 3,36.
C. 4.48.
D. 5,6.
Câu 10: Để nhận biết ion Ca2+ trong dung dịch ta dùng thuốc thử nào sau đây?
A. Dung dịch HCl.
B. Dung dịch HNO3.
C. Dung dịch KCl.
D. Dung dịch K2CO3.
Câu 11: Nung hỗn hợp X gồm 2,7 gam Al và m gam FeO, sau một thời gian thu được hỗn hợp Y. Để hòa tan hoàn toàn Y cần vừa đủ 300 ml dung dịch H2SO4 1M. Phần trăm khối lượng của Al trong X là
A. 47,25%.
B. 42,75%.
C. 20%.
D. 80%.
Câu 12: Kim loại Al không tan được trong dung dịch nào sau đây?
A. HCl.
B. BaCl2.
C. Ba(OH)2.
D. NaOH.
Câu 13: Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Mg(NO3)2, AgNO3, H2SO4 đặc, nguội. Số trường hợp xảy ra phản ứng hóa học là
A. 1.
B. 2.
C. 4.
D. 3.
Câu 14: Thí nghiệm nào sau đây có xảy ra ăn mòn điện hóa học?
A. Cho thanh Fe nguyên chất vào dung dịch ZnSO4.
B. Cho thanh Zn nguyên chất vào dung dịch Cu(NO3)2.
C. Cho thanh Cu nguyên chất vào dung dịch FeCl3.
D. Cho thanh nhôm nguyên chất vào dung dịch NaNO3.
Câu 15: Hai dung dịch đều phản ứng được với kim loại Fe là
A. CuSO4 và HCl.
B. ZnCl2 và FeCl3.
C. CuSO4 và ZnCl2.
D. HCl và AlCl3.
Câu 16: Cho phản ứng hoá học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự khử Fe2+ và sự khử Cu2+ .
B. sự khử Fe2+ và sự oxi hoá Cu.
C. sự oxi hoá Fe và sự khử Cu2+.
D. sự oxi hoá Fe và sự oxi hoá Cu.
Câu 17: Cation M+ có cấu hình electron lớp ngoài cùng 2s22p6 là
A. K+.
B. Li+.
C. Na+.
D. Rb+.
Câu 18: Cho sơ đồ chuyển hoá: Fe FeCl3Fe(OH)3. Hai chất X, Y lần lượt là
A. HCl, Al(OH)3.
B. NaCl, Cu(OH)2.
C. HCl, KOH.
D. Cl2, KOH.
Câu 19: Hấp thụ hoàn toàn 4,48 lít khí SO2 (đktc) vào dung dịch chứa 16 gam NaOH thu được dung dịch X. Khối lượng muối tan thu được trong dung dịch X là
A. 25,2 gam.
B. 23,0 gam.
C. 18,9 gam.
D. 20,8 gam.
Câu 20: Để tách Ag ra khỏi hỗn hợp A gồm Ag, Cu, Fe mà không làm thay đổi khối lượng Ag ta dùng dung dịch nào sau đây?
A. NaOH dư.
B. AgNO3 dư.
C. FeCl3 dư.
D. HCl dư.
Câu 21: Các quá trình sau:
- Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
- Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
- Cho dung dịch HCl dư vào dung dịch NaAlO2.
- Dẫn khí CO2 dư vào dung dịch NaAlO2.
Số quá trình thu được kết tủa là
A. 3.
B. 2.
C. 1.
D. 4.
Câu 22: Cho các hợp kim sau: Cu-Fe (I), Zn-Fe (II), Fe-C (III), Sn-Fe (IV). Khi tiếp xúc với dung dịch chất điện li thì các hợp kim mà trong đó Fe đều bị ăn mòn trước là
A. I, III và IV.
B. I, II và III.
C. I, II và IV.
D. II, III và IV.
Câu 23: Cho V lít hỗn hợp khí (đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe3O4 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,560 lít.
B. 0,224 lít.
C. 0,448 lít.
D. 0,112 lít.
Câu 24: Cho hỗn hợp X gồm CaCO3, MgCO3, BaCO3 có khối lượng 36,8 gam vào cốc chứa dung dịch HCl dư người ta thu được 8,96 lít khí (đktc). Tổng khối lượng các muối thu được sau phản ứng là
A. 31,7 gam.
B. 41,2 gam.
C. 27 gam.
D. 42,8 gam.
Câu 25: So sánh nào dưới đây không đúng ?
A. H2SO4 và H2CrO4 đều là axit có tính oxi hóa mạnh.
B. Fe(OH)2 và Cr(OH)2 đều là bazơ và là chất khử.
C. Al(OH)3 và Cr(OH)3 đều là chất lưỡng tính và vừa có tính oxi hóa vừa có tính khử.
D. BaSO4 và BaCrO4 đều là những chất không tan trong nước.
Câu 26: Cho một lá sắt vào dung dịch chứa 1 trong những muối sau: ZnCl2 (1), CuSO4 (2), Pb(NO3)2 (3), NaNO3 (4), MgCl2 (5), AgNO3 (6). Số trường hợp xảy ra phản ứng là
A. 5.
B. 3.
C. 2.
D. 4.
Câu 27: Nhận xét nào sau đây về NaHCO3 là không đúng?
A. NaHCO3 là muối axit.
B. Ion HCO3- trong muối có tính lưỡng tính.
C. Dung dịch NaHCO3 có pH > 7.
D. NaHCO3 không bị phân huỷ bởi nhiệt.
Câu 28: Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của ![]() là khí NO duy nhất). Giá trị của m là ?
là khí NO duy nhất). Giá trị của m là ?
A. 6,72.
B. 5,60.
C. 5,96.
D. 6,44.
Câu 29: Cho từ từ NaOH vào dung dịch chứa 9,02 gam hỗn hợp muối Al(NO3)3 và Cr(NO3)3 cho đến khi kết tủa thu được là lớn nhất, tách kết tủa rồi nung đến khối lượng không đổi thu được 2,54 gam chất rắn. Khối lượng của muối Cr(NO3)3 là
A. 4,26 gam.
B. 4,76 gam.
C. 4,51 gam.
D. 6,39 gam.
Câu 30: Đốt cháy hoàn toàn 4,04 gam một hỗn hợp kim loại gồm Al, Fe, Cu trong không khí thu được 5,96 gam hỗn hợp các oxit. Hòa tan vừa hết hỗn hợp oxit bằng dung dịch HCl 2M thì thể tích dung dịch HCl cần dùng là
A. 0,12 lít.
B. 1,0 lít.
C. 0,7 lít.
D. 0,5 lít.
Đáp án và hướng dẫn giải đề 001
|
1 - C |
2 - D |
3 - A |
4 - C |
5 - A |
6 - C |
7 - A |
8 - D |
9 - A |
10 - D |
|
11 - C |
12 - B |
13 - B |
14 - B |
15 - A |
16 - C |
17 - C |
18 - D |
19 - A |
20 - C |
|
21 - A |
22 - A |
23 - C |
24 - B |
25 - C |
26 - B |
27 - D |
28 - A |
29 - B |
30 - A |
Câu 1. Đáp án C
Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+.
Câu 2. Đáp án D
Khí CO khử được các oxit của kim loại sau Al trong dãy hoạt động hóa học.
⇒ Các kim loại trong Y là Fe, Cu.
Câu 3. Đáp án A
Dung dịch K2Cr2O7 có màu da cam.
Câu 4. Đáp án C
Cr + H2SO4 (loãng) ⟶ CrSO4 + H2↑
Câu 5. Đáp án A
Để phân biệt các dung dịch riêng biệt: NaCl, FeCl2, FeCl3, có thể dùng dung dịch NaOH:
+ Xuất hiện kết tủa nâu đỏ ⇒ FeCl3.
+ Xuất hiện kết tủa màu trắng xanh ⇒ FeCl2.
+ Không hiện tượng ⇒ NaOH.
Câu 6. Đáp án C
CO2 + Ca(OH)2 ⟶ CaCO3↓ + H2O
⇒
⇒ lít
Câu 7. Đáp án A
Na2CO3 được dùng làm mềm nước cứng toàn phần vì nó loại bỏ được ion Ca2+, Ba2+ thông qua việc tạo kết tủa CaCO3 và BaCO3.
Câu 8. Đáp án D
Ta có: ;
⇒ nO (oxit) = = 0,02 mol
Gọi công thức của oxit sắt là FexOy.
⇒
⇒ Công thức của oxit sắt là Fe3O4.
Câu 9. Đáp án A
Fe + H2SO4 ⟶ FeSO4 + H2↑
Cu + H2SO4 không phản ứng.
⇒
⇒ = 0,1.22,4 = 2,24 lít.
Câu 10. Đáp án D
Để nhận biết ion Ca2+ trong dung dịch ta dùng thuốc thử là dung dịch K2CO3 vì có kết tủa trắng
Câu 11. Đáp án C
Ta có: ;
Gọi số mol của FeO trong hỗn hợp X là x (mol).
2Al + 3H2SO4 ⟶ Al2(SO4)3 + 3H2↑
FeO + H2SO4 ⟶ FeSO4 + H2O
⇒
⇒ x = 0,15 mol
⇒ mFeO = 0,15.72 = 10,8 gam
⇒
Câu 12. Đáp án B
Kim loại Al không tan trong dung dịch BaCl2.
Câu 13. Đáp án B
Fe phản ứng được với các dung dịch FeCl3, AgNO3.
Fe + 2FeCl3 ⟶ 3FeCl2
Fe + 2AgNO3 ⟶ 2Ag + Fe(NO3)2
Câu 14. Đáp án B
Zn + Cu2+ ⟶ Zn2+ + Cu
Cu sinh ra bám vào thanh Zn ⇒ được cặp 2 kim loại khác nhau, tiếp xúc trực tiếp với nhau, cùng nhúng vào một dung dịch chất điện li ⇒ có ăn mòn điện hóa học xảy ra.
Câu 15. Đáp án A
Fe + CuSO4 → FeSO4 + Cu
Fe + 2HCl → FeCl2 + H2
Câu 16. Đáp án C
Quá trình oxi hóa:
Quá trình khử:
Câu 17. Đáp án C
Na → Na+ + 1e
1s22s22p63s1 1s22s22p6
Câu 18. Đáp án D
2Fe + 3Cl2 2FeCl3
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl.
Câu 19. Đáp án A
Ta có: nên sau phản ứng chỉ thu được muối trung hòa, các chất tham gia phản ứng hết.
SO2 + 2NaOH → Na2SO3 + H2O
0,2 0,4 0,2 mol
mmuối = 0,2.126 = 25,2 gam.
Câu 20. Đáp án C
Cho hỗn hợp kim loại qua FeCl3
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Fe + 2FeCl3 → 3FeCl2
Ag không phản ứng, tách được ra khỏi hỗn hợp.
Câu 21. Đáp án A
- Cho dung dịch AlCl3 tác dụng với dung dịch NH3 dư.
AlCl3 + 3H2O + 3NH3 → Al(OH)3 ↓ + 3NH4Cl
- Cho dung dịch Ba(OH)2 dư vào dung dịch Al2(SO4)3.
Ba2+ + SO42- → BaSO4↓
Al3+ + 3OH- → Al(OH)3 ↓
Al(OH)3↓ + OH- dư → AlO2- + 2H2O
- Cho dung dịch HCl dư vào dung dịch NaAlO2.
HCl + NaAlO2 + H2O → Al(OH)3↓ + NaCl
Al(OH)3↓ + 3HCl dư → AlCl3 + 3H2O
- Dẫn khí CO2 dư vào dung dịch NaAlO2.
CO2 + NaAlO2 + 2H2O → Al(OH)3↓ + NaHCO3
Vậy chỉ có trường hợp: Cho dung dịch HCl dư vào dung dịch NaAlO2 không thu được kết tủa sau phản ứng.
Câu 22. Đáp án A
Trong các hợp kim: Cu-Fe (I), Fe-C (III), Sn-Fe (IV) thì sắt đóng vai trò là anot, bị ăn mòn trước.
Câu 23. Đáp án C
Khối lượng chất rắn giảm sau phản ứng chính là mO (oxit) bị tách ra khỏi oxit.
Ta có: mol
V = 0,02.22,4 = 0,448 lít.
Câu 24. Đáp án B
Cứ 1 mol X tham gia phản ứng với HCl thu được muối có khối lượng tăng so với X 11 gam. Vậy tổng khối lượng muối thu được sau phản ứng là:
m = 36,8 + 11.0,4 = 41,2 gam.
Câu 25. Đáp án C
Al(OH)3 không có tính khử.
Câu 26. Đáp án B
Các trường hợp xảy ra phản ứng hóa học là:
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag.
Câu 27. Đáp án D
2NaHCO3 Na2CO3 + CO2 + H2O
Câu 28. Đáp án A
nHCl cần = 2nO trong oxit = 0,24 mol
⇒ nHCl đã dùng (dư 25%) = 0,3 mol.
⇒ nHCl dư = 0,3 – 0,24 = 0,06 mol
Dung dịch sau phản ứng có:
Fe3+ (a mol); Fe2+ (b mol); H+ (0,06 mol); Cl- (2.0,03 + 0,3 = 0,36 mol).
Bảo toàn điện tích có: 3a + 2b + 0,06 = 0,36 ⇒ 3a + 2b = 0,3 (1)
Cho dung dịch AgNO3 dư vào X
Có mAgCl = 0,36.143,5 = 51,66 < 53,28
nên kết tủa còn có Ag (
⇒ b = 0,045 + 0,015 = 0,06 (mol)
Thay vào (1) được a = 0,06 (mol)
Bảo toàn Fe có nFe = a + b = 0,12 (mol)
⇒ m = 0,12.56 = 6,72 gam.
Câu 29. Đáp án B
Gọi số mol Al(NO3)3 và Cr(NO3)3 lần lượt là x và y (mol)
⇒ 213x + 238y = 9,02 (1)
Chất rắn sau khi nung là Al2O3 (0,5x mol); Cr2O3 ( 0,5y mol)
⇒ 51x + 76y = 2,54 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,02.
Khối lượng Cr(NO3)3 là 0,02.238 = 4,76 gam.
Câu 30. Đáp án A
Ta có: nHCl = 2.nO (oxit) =
VHCl = lít
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 2
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Sắt tác dụng với H2O ở nhiệt độ cao hơn 570°C thì tạo ra H2 và sản phẩm rắn là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe(OH)2.
Câu 2: Hợp chất nào sau đây của sắt vừa có tính khử, vừa có tính oxi hóa?
A. FeO.
B. Fe2O3.
C. Fe(OH)3.
D. Fe2(SO4)3.
Câu 3: Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe(II)?
A. Cl2 .
B. dung dịch HNO3 loãng.
C. dung dịch AgNO3 dư.
D. dung dịch HCl đặc.
Câu 4: Kim loại Fe không phản ứng với dung dịch nào sau đây?
A. NaNO3.
В. НСl.
C. AgNO3.
D. CuSO4.
Câu 5: Al(OH)3 tan được trong dung dịch
A. KOH.
B. K2SO4.
C. NaNO3.
D. NaCl.
Câu 6: Trong hợp chất, kim loại kiềm có số oxi hoá là
A. +2.
B. +1.
C. -2.
D. -1.
Câu 7: Chia bột kim loại X thành 2 phần:
+ Phần một: Cho tác dụng với Cl2 tạo ra muối Y.
+ Phần hai: Cho tác dụng với dung dịch HCl tạo ra muối Z.
Cho kim loại X tác dụng với muối Y lại thu được muối Z. Kim loại X có thề là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Câu 8: Ngâm một lá kim loại có khối lượng 50g trong dung dịch HCl. Sau một thời gian thu được 336ml H2 (đkc) thì khối lượng lá kim loại giảm 1,68%. Kim loại đó là
A. Zn.
B. Fe.
C. Al.
D. Ni.
Câu 9: Cấu hình electron nguyên tử Fe là
A. [Ar] 3d5.
B. [Ar] 4s2 3d6.
C. [Ar] 3d6.
D. [Ar] 3d6 4s2.
Câu 10: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí bay ra.
B. kết tủa trắng, sau đó kết tủa tan dần.
C. kết tủa trắng xuất hiện.
D. bọt khí và kết tủa trắng.
Câu 11: Cho lượng dư các dung dịch: KOH, BaCl2, NH3, HCl, NaCl, Ba(OH)2 lần lượt tác dụng với dung dịch Al2(SO4)3. Số trường hợp thu được kết tủa sau khi phản ứng kết thúc là
A. 1.
B. 3.
C. 4.
D. 2.
Câu 12: Trong quá trình điện phân dung dịch CuSO4, ở catot đã xảy ra sự
A. oxi hóa ion Cu2+.
B. khử nước.
C. oxi hóa nước.
D. khử ion Cu2+.
Câu 13: Chọn phát biểu đúng?
A. Sắt bền trong không khí vì có lớp màng Fe2O3 bền vững bảo vệ.
B. Sắt là kim loại có tính khử mạnh.
C. Trong tự nhiên, sắt tồn tại chủ yếu dạng hợp chất.
D. Sắt là kim loại có tính dẫn điện tốt hơn đồng.
Câu 14: Để nhận biết các chất bột riêng biệt sau: Mg, Al, Al2O3 có thể dùng
A. H2O.
B. dung dịch HNO3.
C. dung dịch NaOH.
D. dung dịch HCl.
Câu 15: Dẫn CO dư qua hỗn hợp gồm Al2O3, Fe2O3, CuO, MgO đun nóng. Sau khi phản ứng hoàn toàn thu được hỗn hợp rắn gồm
A. Al, Fe, Cu, Mg.
B. Al, Fe, Cu, MgO.
C. Al2O3, Fe, Cu, Mg.
D. Al2O3, Fe, Cu, MgO.
Câu 16: Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
A. Ag.
B. Ca.
C. Na.
D. Fe.
Câu 17: Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Mg(HCO3)2, CaCl2.
B. Ca(HCO3)2, Mg(HCO3)2.
C. Ca(HCO3)2, MgCl2.
D. MgCl2, CaSO4.
Câu 18: Cho hỗn hợp X gồm Mg và Fe vào dung dịch axit H2SO4 đặc, nóng đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
A. MgSO4.
B. MgSO4 và FeSO4.
C. MgSO4 và Fe2(SO4)3.
D. MgSO4, Fe2(SO4)3 và FeSO4.
Câu 19: Trong tự nhiên, chất X tồn tại dưới dạng ngậm nước X.2H2O gọi là thạch cao sống. Công thức của X là
A. MgCO3.
B. CaSO4.
C. CaCO3.
D. MgSO4.
Câu 20: Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 4,00%.
B. 4,99%.
C. 6,00%.
D. 5,00%.
Câu 21: Cho 4,05 gam bột nhôm vào 100 ml dung dịch Fe(NO3)3 3M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 16,8.
B. 4,2.
C. 8,4.
D. 11,2.
Câu 22: Sục khí CO2 đến dư vào 100 ml dung dịch KOH 1M, thu được m gam muối. Giá trị của m là
A. 8,4.
B. 6,9.
C. 10.
D. 5,3.
Câu 23: Để điều chế được 1,35 tấn Al thì cần dùng m tấn quặng boxit chứa 75% Al2O3. Biết hiệu suất quá trình sản xuất là 92%. Giá trị của m là
A. 4,098.
B. 3,966.
C. 3,696.
D. 4,080.
Câu 24: Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 1,12 lít khí (đktc) và dung dịch X. Cho NaOH dư vào dung dịch X thu được kết tủa, nung kết tủa trong không khí đến khối lượng không đổi được m gam chất rắn thì giá trị của m là
A. 12,0.
B. 7,2.
C. 11,2.
D. 16,0.
Câu 25: Hòa tan m gam Al trong dung dịch NaOH dư, sau phản ứng thu được 3,36 lít khí H2 (đktc). Giá trị của m là
A. 2,7.
B. 1,35.
C. 5,4.
D. 4,05.
Câu 26: Hòa tan hoàn toàn 1,84 gam hỗn hợp Fe và Mg trong lượng dư dung dịch HNO3, thu được 0,04 mol khí NO (sản phẩm khử duy nhất của ). Số mol Fe và Mg trong hỗn hợp ban đầu lần lượt là
A. 0,01 và 0,01.
B. 0,03 và 0,03.
C. 0,02 và 0,03.
D. 0,03 và 0,02.
Câu 27: Cho Cu (Z = 29), số electron lớp ngoài cùng của nguyên tử nguyên tố đồng là
A. 1.
B. 2.
C. 8.
D. 10.
Câu 28: Nhận xét nào sau đây sai?
A. Cr2O3 là chất rắn màu lục thẫm.
B. Cr(OH)3 là hiđroxit lưỡng tính.
C. Cr2O3 tan trong dung dịch kiềm loãng.
D. Cr2O3 là oxit lưỡng tính.
Câu 29: Đốt cháy hoàn toàn bột crom trong oxi (dư) thu được 4,56 gam một oxit (duy nhất). Khối lượng crom bị đốt cháy là
A. 0,78 gam.
B. 3,12 gam.
C. 1,74 gam.
D. 1,19 gam.
Câu 30: Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (ở đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là
A. 3,36.
B. 2,24.
C. 4,48.
D. 5,60.
Đáp án và hướng dẫn giải đề 002
|
1 - A |
2 - A |
3 - D |
4 - A |
5 - A |
6 - B |
7 - D |
8 - B |
9 - D |
10 - B |
|
11 - B |
12 - D |
13 - C |
14 - C |
15 - D |
16 - D |
17 - B |
18 - B |
19 - B |
20 - D |
|
21 - B |
22 - C |
23 - C |
24 - C |
25 - A |
26 - C |
27 - A |
28 - C |
29 - B |
30 - D |
Câu 1. Đáp án A
3Fe + 4H2O Fe3O4 + 4H2;
Fe + H2O FeO + H2.
Câu 2. Đáp án A
Trong hợp chất FeO số oxi hóa của Fe là +2; đây là số oxi hóa trung gian của sắt nên FeO vừa có tính khử, vừa có tính oxi hóa.
Câu 3. Đáp án D
- Loại A vì: 2Fe + 3Cl2 2FeCl3.
- Loại B vì: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O.
- Loại C vì: Fe + 2AgNO3 → Fe(NO3)2 + 2Ag;
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag.
- Chọn D vì: Fe + 2HCl → FeCl2 + H2.
Câu 4. Đáp án A
Fe + NaNO3 → không phản ứng.
Fe + 2HCl → FeCl2 + H2.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag.
Fe + CuSO4 → FeSO4 + Cu.
Câu 5. Đáp án A
Al(OH)3 + KOH → KAlO2 + 2H2O
Câu 6. Đáp án B
Trong các hợp chất kim loại kiềm có số oxi hóa là +1.
Câu 7. Đáp án D
Kim loại X là Fe.
Phần 1: 2Fe (X) + 3Cl2 2FeCl3 (Y)
Phần 2: Fe (X) + 2HCl → FeCl2 (Z) + H2
Fe (X) + 2FeCl3 (Y) → 3FeCl2 (Z).
Câu 8. Đáp án B
Khối lượng kim loại phản ứng là:
mKL = = 0,84 gam
2M + 2nHCl → 2MCln + nH2
Có
Vậy n = 2; MM = 56 (Fe) thỏa mãn.
Câu 9. Đáp án D
Cấu hình electron nguyên tử Fe (Z = 26): 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Hay [Ar] 3d6 4s2.
Câu 10. Đáp án B
Phản ứng xảy ra như sau:
CO2 + Ca(OH)2 → CaCO3 (↓ trắng) + H2O
CO2 dư + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng: Xuất hiện kết tủa trắng, sau đó kết tủa tan dần.
Câu 11. Đáp án B
Có 3 trường hợp thu được kết tủa sau khi phản ứng kết thúc là:
+ Cho BaCl2 dư vào Al2(SO4)3:
Ba2+ + SO42- → BaSO4 ↓
+ Cho NH3 dư vào Al2(SO4)3:
Al3+ + 3NH3 + 3H2O → Al(OH)3 ↓ + NH4+.
+ Cho Ba(OH)2 dư vào Al2(SO4)3:
Ba2+ + SO42- → BaSO4 ↓
Câu 12. Đáp án D
Tại catot (cực âm): Cu2+ + 2e → Cu.
Vậy tại catot xảy ra sự khử ion Cu2+.
Câu 13. Đáp án C
- Phát biểu A sai vì sắt bị oxi hóa bởi các tác nhân (hơi nước, khí oxi …) có trong không khí.
- Phát biểu B sai vì sắt có tính khử trung bình.
- Phát biểu D sai vì đồng dẫn điện tốt hơn sắt.
Câu 14. Đáp án C
Sử dụng dung dịch NaOH:
+ Hiện tượng: Chất rắn tan dần, không có khí thoát ra ⇒ chất rắn ban đầu là Al2O3:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
+ Hiện tượng: Chất rắn tan dần, có khí thoát ra ⇒ chất rắn ban đầu là Al:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
+ Không có hiện tượng gì ⇒ chất rắn ban đầu là Mg.
Câu 15. Đáp án D
CO khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại để tạo thành kim loại ⇒ MgO; Al2O3 không bị khử.
Hỗn hợp sau phản ứng gồm: Al2O3; MgO; Fe; Cu.
Câu 16. Đáp án D
Sử dụng kim loại sắt:
Fe + CuSO4 → FeSO4 + Cu.
Câu 17. Đáp án B
Do loại nước cứng này khi đun sôi thì mất tính cứng nên là nước cứng tạm thời.
Vậy trong loại nước cứng này có hòa tan: Ca(HCO3)2, Mg(HCO3)2.
Ca(HCO3)2 CaCO3 ↓ + CO2 ↑ + H2O
Mg(HCO3)2 MgCO3 ↓ + CO2 ↑ + H2O.
Câu 18. Đáp án B
Do sau phản ứng vẫn còn một phần Fe không tan nên có các phản ứng sau:
Mg + 2H2SO4 đặc MgSO4 + SO2 ↑ + 2H2O
2Fe + 6H2SO4 đặc Fe2(SO4)3 + 3SO2 ↑ + 3H2O
Fe dư + Fe2(SO4)3 → 3FeSO4
Vậy chất tan trong dung dịch Y gồm: MgSO4; FeSO4.
Câu 19. Đáp án B
Thạch cao sống: CaSO4. 2H2O
Vậy X là CaSO4.
Câu 20. Đáp án D
Dung dịch sau phản ứng là dung dịch KOH có:
mct = 0,1.56 = 5,6 gam.
mdd = mK + mnước - mkhí
= 3,9 + 108,2 – 0,05.2 = 112 gam.
Câu 21. Đáp án B
Vì
Dung dịch sau phản ứng chứa: Al3+ (0,15 mol); NO3- (0,9 mol); Fe2+ (x mol).
Bảo toàn điện tích có: 0,15.3 + 2x = 0,9 ⇒ x = 0,225 mol.
Bảo toàn Fe có: nFe3+ bđ = nFe2+ sau pư + nFe
⇒ nFe = 0,3 – 0,225 = 0,075 mol
Vậy m = 0,075.56 = 4,2 gam.
Câu 22. Đáp án C
nKOH = 0,1.1 = 0,1 mol
Do CO2 dư, nên sau phản ứng chỉ thu được muối KHCO3.
Bảo toàn K có số mol KHCO3 = số mol KOH = 0,1 mol
Vậy m = 0,1.100 = 10 gam.
Câu 23. Đáp án C
Ta có sơ đồ:
Khối lượng Al2O3 cần dùng là:
tấn
Do quặng boxit chứa 75% Al2O3 nên khối lượng quặng là:
m quặng = 3,696 tấn.
Câu 24. Đáp án C
Gọi số mol Fe và Fe2O3 trong hỗn hợp ban đầu là x và y. Ta có hệ phương trình:
Chất rắn sau khi nung chỉ có Fe2O3. Bảo toàn nguyên tố Fe có:
Vậy m = 0,07.160 = 11,2 gam.
Câu 25. Đáp án A
Vậy mAl = 0,1.27 = 2,7 gam.
Câu 26. Đáp án C
Gọi số mol của Fe và Mg trong hỗn hợp lần lượt là x và y mol.
Theo bài ra:
mhh = 1,84 gam ⇒ 56x + 24y = 1,84 (1)
Bảo toàn electron có:
3.nFe + 2.nMg = 3.nNO ⇒ 3x + 2y = 0,12 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,03 mol.
Câu 27. Đáp án A
Cấu hình electron của Cu là: 1s22s22p63s23p63d104s1.
⇒ Số electron lớp ngoài cùng của đồng là 1.
Câu 28. Đáp án C
Nhận định C sai vì Cr2O3 chỉ tan trong dung dịch kiềm đặc.
Câu 29. Đáp án B
Oxit là Cr2O3: 0,03 mol
Bảo toàn Cr có nCr = 2.0,03 = 0,06 mol
⇒ mCr = 0,06.52 = 3,12 gam.
Câu 30. Đáp án D
Gọi số mol của Fe là x mol ⇒ số mol của Cu là x mol.
Theo bài ra ta có: 56x + 64x = 12 ⇒ x = 0,1.
Gọi số mol của NO và NO2 trong X lần lượt là a và b mol.
Tỉ khối của X với H2 bằng 19 nên:
(1)
Bảo toàn electron có:
(2)
Từ (1) và (2) có a = b = 0,125 mol
⇒ V = (0,125 + 0,125).22,4 = 5,6 lít.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1: Cho m gam Mg vào dung dịch chứa 0,12 mol FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 3,36 gam chất rắn. Giá trị của m là
A. 2,88.
B. 2,16.
C. 4,32.
D. 5,04.
Câu 2: Để điều chế kim loại kiềm người ta dùng phương pháp
A. thuỷ luyện.
B. nhiệt luyện.
C. điện phân dung dịch.
D. điện phân nóng chảy.
Câu 3: Oxit nào sau đây là oxit lưỡng tính?
A. Cr2O3.
B. CrO.
C. Fe2O3.
D. MgO.
Câu 4: Cho x mol Fe tác dụng với dung dịch chứa y mol AgNO3. Để dung dịch sau phản ứng tồn tại các ion Fe3+, Fe2+ thì giá trị của a = y : x là
A. 3 < a < 3,5.
B. 1 < a < 2.
C. 0,5 < a < 1.
D. 2 < a < 3.
Câu 5: Trong các hiện tượng thực hành dưới đây, hiện tượng nào miêu tả không chính xác?
A. Cho mẩu Na vào dung dịch đựng FeCl3 thấy có khí thoát ra đồng thời có kết tủa màu nâu đỏ.
B. Thêm dung dịch NH3 dư vào dung dịch AlCl3 thấy có kết tủa, sục khí CO2 dư vào ống nghiệm chứa kết tủa trên thấy kết tủa tan.
C. Nhúng lá sắt đã đánh sạch gỉ vào dung dịch CuSO4, lá sắt chuyển sang màu đỏ.
D. Thả mẩu kẽm vào hai ống nghiệm đều chứa dung dịch H2SO4. Thêm vào ống nghiệm thứ nhất vài giọt FeSO4 thấy khí thoát ra ở ống nghiệm này nhanh hơn.
Câu 6: Một loại nước cứng có chứa các ion: Ca2+, Mg2+, Cl- và SO42-. Hóa chất nào trong số các chất sau đây có thểm làm mềm loại nước cứng trên?
A. K2CO3.
B. NaOH.
C. NaCl.
D. KNO3.
Câu 7: Các oxit sau: FeO, MgO, Fe3O4, ZnO những oxit nào phản ứng với HNO3 có tạo ra khí?
A. FeO, Fe3O4.
B. MgO, FeO.
C. Fe3O4, ZnO.
D. MgO, ZnO.
Câu 8: Kim loại nào sau đây khử được ion Fe2+trong dung dịch?
A. Fe.
B. Mg.
C. Na.
D. Cu.
Câu 9: Nhận xét nào sau đây không đúng?
A. Các kim loại kiềm đều mềm và nhẹ.
B. Các kim loại kiềm đều có nhiệt độ nóng chảy rất cao.
C. Các kim loại kiềm đều có tính khử mạnh.
D. Các nguyên tử kim loại kiềm đều có cấu hình electron lớp ngoài cùng là ns1.
Câu 10. Cho hỗn hợp gồm Na và Al tan vào nước thấy hỗn hợp tan hết. Nhận xét đúng là
A. Al tan hoàn toàn trong nước dư.
B. Số mol khí thoát ra bé hơn số mol Al và Na.
C. H2O dư và số mol Al lớn hơn số mol Na.
D. H2O dư và số mol Al bé hơn hoặc bằng số mol Na.
Câu 11. Ion M2+ có cấu hình electron ở lớp ngoài cùng là 3s23p6. Vị trí M trong bảng hệ thống tuần hoàn là
A. Ô 20, chu kì 4, nhóm IIA.
B. Ô 20, chu kì 4, nhóm IIB.
C. Ô 18, chu kì 3, nhóm VIIIA.
D. Ô 18, chu kì 3, nhóm VIIIB.
Câu 12. Tên của các quặng chứa FeCO3, Fe2O3, Fe3O4, FeS2 lần lượt là
A. hematit; pirit; manhetit; xiđerit.
B. xiđerit; manhetit; pirit; hematit.
C. xiđerit; hematit; manhetit; pirit.
D. pirit; hematit; manhetit; xiderit.
Câu 13. Cấu hình electron nào dưới đây được viết đúng?
A. 26Fe: [Ar] 4s13d7.
B. 26Fe2+: [Ar] 4s23d4.
C. 26Fe2+: [Ar] 3d44s2 .
D. 26Fe3+: [Ar] 3d5.
Câu 14. Để khử hoàn toàn 8,0 gam bột Fe2O3 bằng bột Al (ở nhiệt độ cao, trong điều kiện không có không khí) thì khối lượng bột Al cần dùng là
A. 8,10 gam.
B. 1,35 gam.
C. 5,40 gam.
D. 2,70 gam.
Câu 15. Hoà tan hoàn toàn 24,4 gam hỗn hợp gồm FeCl2 và NaCl (có tỉ lệ số mol tương ứng là 1 : 2) vào một lượng nước (dư), thu được dung dịch X. Cho dung dịch AgNO3 (dư) vào dung dịch X, sau khi phản ứng xảy ra hoàn toàn sinh ra m gam chất rắn. Giá trị của m là
A. 57,4.
B. 28,7.
C. 10,8.
D. 68,2.
Câu 16: Cho 4,9 gam hỗn hợp Fe và Cu (trong đó Cu chiếm 60% khối lượng) vào một lượng dung dịch HNO3 khuấy đều đến phản ứng hoàn toàn thấy còn lại 2,3 gam chất rắn không tan. Khối lượng muối tạo thành là
A. 8,18 g.
B. 6,5 g.
C. 10,07 g.
D. 8,35 g.
Câu 17: Cho 6,9 gam Na vào dung dịch HCl thu được dung dịch X có chứa 14,59 gam chất tan. Cho dung dịch X vào dung dịch AgNO3 dư đến phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
A. 38,65 gam
B. 28,8 gam
C. 40,76 gam
D. 39,20 gam
Câu 18: Sắt tây là hợp kim của sắt và kim loại M. Kim loại M là
A. Zn.
B. Pb.
C. Cr.
D. Sn.
Câu 19: Thực hiện các thí nghiệm sau:
(1) Nhúng thanh Fe nguyên chất vào dung dịch hỗn hợp NaNO3 và HCl.
(2) Nhúng thanh Fe nguyên chất vào dung dịch FeCl3.
(3) Nhúng thanh Fe nguyên chất vào dung dịch CuCl2.
(4) Nối thanh nhôm với thanh đồng, để ngoài không khí ẩm.
Số trường hợp xảy ra ăn mòn điện hóa học là
A. 3.
B. 1.
C. 2.
D. 4.
Câu 20: Chọn phát biểu sai?
A. Cr2O3 là chất rắn màu lục đậm.
B. Cr(OH)3 là chất rắn màu xanh lục.
C. CrO3 là chất rắn màu đỏ thẫm.
D. CrO là chất rắn màu trắng xanh.
Câu 21: Cho các nhận xét sau:
(1) Thép là hợp kim của sắt và cacbon trong đó hàm lượng cacbon chiếm từ 0,01% đến dưới 2%.
(2) Gang là hợp chất của sắt và cacbon trong đó hàm lượng cacbon chiếm từ 2% đến 5%.
(3) Nguyên tắc sản xuất gang là khử oxit sắt thành sắt bằng CO.
(4) Nguyên tắc sản xuất thép là khử cacbon có trong gang.
Số nhận xét đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Câu 22: Cho dung dịch FeCl3 vào dung dịch chất X, thu được kết tủa Fe(OH)3. Chất X là
A. KOH.
B. NaCl.
C. AgNO3.
D. CH3OH.
Câu 23: Quặng sắt manhetit có thành phần là
A. FeS2
B. Fe3O4
C. FeCO3
D. Fe2O3
Câu 24: Cho 4 nhận xét sau:
(1) Hỗn hợp Na2O + Al2O3 (tỉ lệ mol 1:1) tan hết trong nước dư.
(2) Hỗn hợp Fe2O3 + Cu (tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư.
(3) Hỗn hợp KNO3 + Cu (tỉ lệ mol 1:1) tan hết trong dung dịch H2SO4 loãng, dư.
(4) Hỗn hợp FeS + CuS (tỉ lệ mol 1:1) tan hết trong dung dịch HCl dư.
Số nhận xét đúng là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 25: Hòa tan 9,61 gam hỗn hợp X gồm 3 kim loại Ba, Al và Fe vào nước (lấy dư) thu được 2,688 lít H2 (đkc) và chất rắn Y. Cho Y tác dụng hết với CuSO4 thu được 7,04 gam Cu. Phần trăm khối lượng của Al trong X là
A. 22,47%.
B. 33,71%.
C. 28,09%.
D. 16,85%.
Câu 26: Cho 17,6 gam hỗn hợp X gồm Fe và Cu phản ứng với dung dịch HCl loãng (dư), đến khi phản ứng xảy ra hoàn toàn thu được 4,48 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là?
A. 25,4 gam.
B. 31,8 gam.
C. 24,7 gam
D. 18,3 gam
Câu 27: Cho hỗn hợp Fe, Mg vào dung dịch AgNO3 và Cu(NO3)2 thì thu được dung dịch A và 1 kim loại. Kim loại thu được sau phản ứng là
A. Cu.
B. Ag.
C. Fe.
D. Mg.
Câu 28: Cho các nhận định sau:
(a) Đồng có thể tan trong dung dịch HCl có mặt oxi.
(b) Các kim loại kiềm có thể đẩy Cu2+ ra khỏi dung dịch CuSO4.
(c) Hỗn hợp rắn X gồm KNO3 và Cu (tỉ lệ mol 1:1) hòa tan hết trong dung dịch HCl.
(d) Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
(e) Muối Na2CO3 dễ bị nhiệt phân huỷ.
Số nhận định đúng là
A. 3.
B. 2.
C. 4.
D. 1.
Câu 29: Nung 20,8 gam hỗn hợp X gồm bột sắt và lưu huỳnh trong bình chân không thu được hỗn hợp Y. Cho toàn bộ Y tác dụng với dung dịch HCl dư, thu được m gam chất rắn không tan và 4,48 lít (ở đktc) hỗn hợp khí Z có tỉ khối so với H2 bằng 9. Giá trị của m là
A. 6,4.
B. 16,8.
C. 4,8.
D. 3,2.
Câu 30: Hòa tan m gam hỗn hợp FeCl2, FeCl3 và CuCl2 vào nước được dung dịch X. Sục H2S dư vào thấy xuất hiện chất rắn Y nặng 1,28 gam và dung dịch Z. Cho Z tác dụng với dung dịch AgNO3 dư thấy có 22,25 kết tủa. Hòa tan Y trong HNO3 dư thấy thoát ra 1,4 gam khí duy nhất. biết các phản ứng xảy ra hoàn toàn, sản phẩm khử N+5 là NO. Giá trị m gần nhất với
A. 8,4 gam.
B. 9,4 gam.
C. 7,8 gam.
D. 7,4 gam.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Kim loại nào sau đây phản ứng mãnh liệt nhất với nước ở nhiệt độ thường?
A. Fe.
B. Al.
C. Na.
D. Mg.
Câu 2. Cấu hình electron của Fe có dạng:
A. [Ar] 3d5.
B. [Ar] 4s2 3d6.
C. [Ar] 3d6.
D. [Ar] 3d6 4s2.
Câu 3. Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí bay ra.
B. kết tủa trắng, sau đó kết tủa tan dần.
C. kết tủa trắng xuất hiện.
D. bọt khí và kết tủa trắng.
Câu 4. Cho lượng dư các dung dịch: KOH, BaCl2, NH3, HCl, NaCl, Ba(OH)2 lần lượt tác dụng với dung dịch Al2(SO4)3. Số trường hợp thu được kết tủa sau phản ứng là
A. 1.
B. 3.
C. 4.
D. 2.
Câu 5. Trong quá trình điện phân dung dịch CuSO4, ở catot đã xảy ra sự
A. oxi hóa ion Cu2+.
B. khử nước.
C. oxi hóa nước.
D. khử ion Cu2+.
Câu 6. Chọn phát biểu đúng?
A. Sắt bền trong không khí vì có lớp màng Fe2O3 bền vững bảo vệ.
B. Sắt là kim loại có tính khử mạnh.
C. Trong tự nhiên, sắt tồn tại chủ yếu dạng hợp chất.
D. Sắt là kim loại có tính dẫn điện tốt hơn đồng.
Câu 7. Để nhận biết các chất riêng biệt sau: Na, Al, Al2O3 có thể dùng
A. H2O.
B. dung dịch HNO3.
C. dung dịch NaOH.
D. dung dịch HCl.
Câu 8. Dẫn CO dư qua hỗn hợp gồm Al2O3, Fe2O3, CuO, MgO đun nóng. Sau khi phản ứng hoàn toàn thu được hỗn hợp rắn gồm
A. Al, Fe, Cu, Mg.
B. Al, Fe, Cu, MgO.
C. Al2O3, Fe, Cu, Mg.
D. Al2O3, Fe, Cu, MgO.
Câu 9. Để thu được kim loại Cu từ dung dịch CuSO4 theo phương pháp thủy luyện, có thể dùng kim loại nào sau đây?
A. Ag.
B. Ca.
C. Na.
D. Fe.
Câu 10. Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
A. Mg(HCO3)2, CaCl2.
B. Ca(HCO3)2, Mg(HCO3)2.
C. Ca(HCO3)2, MgCl2.
D. MgCl2, CaSO4.
Câu 11. Trong số các ion sau: Al3+, Mg2+, Fe2+, Fe3+. Ion có tính oxi hóa mạnh nhất là
A. Fe3+.
B. Al3+.
C. Fe2+.
D. Mg2+.
Câu 12. Dãy gồm các ion đều oxi hóa được kim loại Fe là
A. Zn2+, Cu2+, Ag+.
B. Cu2+, Al3+, Fe3+.
C. Mg2+, Cu2+, Ag+.
D. Fe3+, Cu2+, Ag+.
Câu 13. Ứng dụng nào sau đây của nhôm là sai?
A. Làm bình đựng nước vôi.
B. Làm dây cáp dẫn điện và dụng cụ nhà bếp.
C. Chế tạo hợp kim nhẹ, bền.
D. Dùng làm khung cửa và trang trí nội thất.
Câu 14. Cho hỗn hợp X gồm Mg và Fe vào dung dịch axit H2SO4 đặc, nóng đến khi các phản ứng xảy ra hoàn toàn, thu được dung dịch Y và một phần Fe không tan. Chất tan có trong dung dịch Y là
A. MgSO4.
B. MgSO4 và FeSO4.
C. MgSO4 và Fe2(SO4)3.
D. MgSO4, Fe2(SO4)3 và FeSO4.
Câu 15. Dãy chất gồm các chất đều tác dụng được với dung dịch H2SO4 (loãng) và NaOH?
A. Al2O3, Al(OH)3, CaCO3.
B. Al, Al2O3, Na2CO3.
C. Al2O3, Al, NaHCO3.
D. NaHCO3, Al2O3, Fe2O3.
Câu 16. Phân hủy Fe(OH)2 và Fe(OH)3 ở nhiệt độ cao ngoài không khí đến khối lượng không đổi, thu được chất rắn là
A. Fe2O3.
B. Fe3O4.
C. FeO.
D. Fe2O3 và FeO.
Câu 17. Kim loại tan trong dung dịch NaOH là
A. Cu.
B. Mg.
C. Fe.
D. Al.
Câu 18. Trong tự nhiên, chất X tồn tại dưới dạng ngậm nước X.2H2O gọi là thạch cao sống. Công thức của X là
A. MgCO3.
B. CaSO4.
C. CaCO3.
D. MgSO4.
Câu 19. Cho dãy các kim loại: Fe, K, Cs, Ca, Al, Na. Số kim loại kiềm trong dãy là
A. 3.
B. 4.
C. 1.
D. 2.
Câu 20. Phát biểu nào sau đây không đúng?
A. Nhôm bị phá hủy trong môi trường kiềm
B. Nhôm phản ứng được với H2SO4 đặc, nguội.
C. Nhôm là kim loại nhẹ, dẫn điện, dẫn nhiệt tốt.
D. Nhôm có tính khử mạnh chỉ sau kim loại kiềm và kiềm thổ trong cùng chu kì.
Câu 21. Cho các dung dịch: HNO3 loãng, NaOH, CuSO4, FeCl3, HCl. Kim loại Fe phản ứng với mấy chất?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 22. Nồng độ phần trăm của dung dịch thu được khi cho 3,9 gam kali tác dụng với 108,2 gam H2O là
A. 4,00%.
B. 4,99%.
C. 6,00%.
D. 5,00%.
Câu 23. Cho 4,05 gam bột nhôm vào 100 ml dung dịch Fe(NO3)3 3M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là
A. 16,8.
B. 4,2.
C. 8,4.
D. 11,2.
Câu 24. Sục khí CO2 đến dư vào 100 ml dung dịch KOH 1M, thu được m gam muối. Giá trị của m là
A. 8,4.
B. 6,9.
C. 10.
D. 5,3.
Câu 25. Điện phân 500 ml dung dịch AgNO3 xM với điện cực trơ, cường độ dòng điện là 9,65A đến khi catot bắt đầu có bọt khí thấy thoát ra thì thấy hết 50 phút. Giá trị của x là
A. 0,45.
B. 0,30.
C. 0,15.
D. 0,60.
Câu 26. Hòa tan hết 7,74 gam hỗn hợp bột Mg, Al cần vừa đủ 500 ml dung dịch X gồm HCl 1M và H2SO4 0,28M thu được dung dịch Y. Khối lượng muối khan thu được dung dịch Y. Khối lượng muối khan thu được khi cô cạn dung dịch Y là
A. 38,93 gam.
B. 25,95 gam.
C. 77,86 gam.
D. 103,85 gam.
Câu 27. Để điều chế được 1,35 tấn Al thì cần dùng m tấn quặng boxit chứa 75% Al2O3. Biết hiệu suất quá trình sản xuất là 92%. Giá trị của m là
A. 4,098.
B. 3,966.
C. 3,696.
D. 4,080.
Câu 28. Hòa tan hoàn toàn 7,5 gam hỗn hợp gồm Mg và Al bằng lượng vừa đủ V lít dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 0,672 lít N2 (đktc) duy nhất và dung dịch chứa 54,9 gam muối. Giá trị của V là
A. 0,65.
B. 0,72.
C. 0,70.
D. 0,86.
Câu 29. Hòa tan 10 gam hỗn hợp bột Fe và Fe2O3 bằng một lượng dung dịch HCl vừa đủ thu được 1,12 lít khí (đktc) và dung dịch X. Cho NaOH dư vào dung dịch X thu được kết tủa, nung kết tủa trong không khí đến khối lượng không đổi được m gam chất rắn thì giá trị của m là
A. 12,0.
B. 7,2.
C. 11,2.
D. 16,0.
Câu 30. Hòa tan m gam Al trong dung dịch NaOH dư, sau phản ứng thu được 3,36 lít khí H2 (đktc). Giá trị của m là
A. 2,7.
B. 1,35.
C. 5,4.
D. 4,05.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 5
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: F = 19; Cl = 35,5; Br = 80; I = 127; Ag = 108; Li = 7; Na = 23; K = 39; Be = 9; Mg = 12; Ca = 40; Ba = 137; Al = 27; Fe = 56; Cr = 52; Cu = 64; Zn = 65; Mg = 24; O = 16; S = 32.
Câu 1. Kim loại Fe không phản ứng với dung dịch nào sau đây?
A. NaNO3.
В. НСl.
C. AgNO3.
D. CuSO4.
Câu 2. Al(OH)3 tan được trong dung dịch
A. KOH.
B. K2SO4.
C. NaNO3.
D. NaCl.
Câu 3. Trong hợp chất, kim loại kiềm có số oxi hoá là
A. +2.
B. +1.
C. -2.
D. -1.
Câu 4. Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 5. Cho dung dịch FeCl2 tác dụng với dung dịch NaOH tạo thành kết tủa có màu
A. trắng.
B. nâu đỏ.
C. xanh thẫm.
D. trắng xanh.
Câu 6. Trong công nghiệp, quặng boxit dùng để sản xuất kim loại nhôm. Thành phần chính của quặng boxit là
A. Al(OH)3.H2O.
B. Al2(SO4)3.H2O.
C. Al(OH)3.2H2O.
D. Al2O3.2H2O.
Câu 7. Kim loại nào sau đây tác dụng được với dung dịch HCl?
A. Ag.
B. Au.
C. Fe.
D. Cu.
Câu 8. Dung dịch NaOH tạo kết tủa với dung dịch
A. H2SO4.
B. BaCl2.
C. KCl.
D. MgCl2.
Câu 9. FeO đóng vai trò chất khử trong phản ứng với dung dịch loãng chất nào sau đây?
A. NaOH.
B. HNO3.
C. H2SO4.
D. HCl.
Câu 10. Hoá chất nào sau đây có thể dùng để làm mất tính cứng tạm thời của nước?
A. NaCl.
B. Ca(OH)2.
C. KNO3.
D. MgCl2.
Câu 11. Trong các cation sau: Al3+, Mg2+, Fe2+, Fe3+. Cation có tính oxi hóa mạnh nhất là
A. Mg2+.
B. Al3+.
C. Fe3+.
D. Fe2+.
Câu 12. Al2O3 phản ứng được với cả hai dung dịch
A. KCl, KNO3.
B. Na2SO4, NaOH.
C. NaCl, H2SO4.
D. NaOH, H2SO4.
Câu 13. Kim loại X có màu trắng bạc, nóng chảy ở 660°C, có thể dát mỏng dùng làm giấy gói kẹo, thực phẩm,... Kim loại X là
A. Na.
B. Al.
C. Fe.
D. Mg.
Câu 14. Cho phương trình hoá học: xMg + yH2SO4 (đặc) → xMgSO4 + zS + yH2O (x, y, z là các hệ số cân bằng tối giản). Giá trị (x + y) bằng
A. 5.
B. 7.
C. 8.
D. 6.
Câu 15. Phèn chua có công thức: M2SO4.Al2(SO4)3.24H2O trong đó M+ là
A. NH4+.
B. Na+.
C. Li+.
D. K+.
Câu 16. Nhiệt phân đá vôi thu được vôi sống. Vôi sống được cho vào nước thu được vôi tôi. Vôi tôi được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất amoniac, clorua vôi, vật liệu xây dựng,.... Công thức của vôi tôi là
A. CaCO3.
B. CaSO4.
C. Ca(OH)2.
D. CaO.
Câu 17. Tiến hành khử oxit X thành kim loại bằng khí H2 dư theo sơ đồ thí nghiệm như hình vẽ sau:
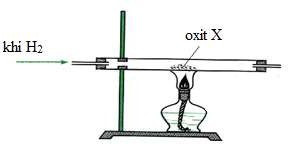
X có thể là oxit nào sau đây?
A. K2O.
B. Fe2O3.
C. Al2O3.
D. MgO.
Câu 18. Kim loại kiềm nào dưới đây được sử dụng làm tế bào quang điện?
A. Li.
B. Cs.
C. K.
D. Na.
Câu 19. Điện phân NaCl nóng chảy (anot bằng than chì, catot bằng thép), ở catot thu được
A. Na.
B. Cl2.
C. H2.
D. NaOH.
Câu 20. Chất nào sau đây khi tác dụng với dung dịch HCl, thu được hai muối?
A. Fe3O4.
B. Be(OH)2.
C. FeO.
D. Fe2O3.
Câu 21. Cho dãy các kim loại: Fe, K, Cs, Ca, Al, Na. Số kim loại kiềm trong dãy là
A. 2.
B. 4.
C. 2.
D. 1.
Câu 22. Trong sản xuất nhôm, X được trộn với Al2O3 nhằm hạ nhiệt độ nóng chảy của hỗn hợp xuống 900°C, tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3 nóng chảy. X là
A. natri hiđroxit.
B. đolomit.
C. criolit.
D. boxit.
Câu 23. Trong tự nhiên, canxi sunfat tồn tại dưới dạng CaSO4.2H2O được gọi là
A. đá vôi.
B. thạch cao sống.
C. thạch cao khan.
D. thạch cao nung.
Câu 24. Cho các kim loại: Na, K, Mg, Ba. Ở nhiệt độ thường, kim loại khử được nước chậm nhất là
A. K.
B. Na.
C. Mg.
D. Ba.
Câu 25. Dung dịch FeCl3 tác dụng được với
A. Ag.
B. Pt.
C. Au.
D. Cu.
Câu 26. NaHCO3 tác dụng với chất nào sau đây sinh ra kết tủa?
A. HCl.
B. Ba(OH)2.
С. KОН.
D. H2SO4.
Câu 27. Cation M+ có cấu hình electron ở lớp ngoài cùng là 2s22p6. M là
A. Na.
B. Mg.
C. F.
D. Ne.
Câu 28. Để thu được kim loại Cu từ dung dịch CuSO4, theo phương pháp thuỷ luyện, có thể dùng kim loại nào sau đây?
A. Fe.
B. Ag.
C. Na.
D. Ca.
Câu 29. Cho từ từ tới dư dung dịch chất X vào dung dịch AlCl3 thu được kết tủa keo trắng. Biết phản ứng xảy ra hoàn toàn. Chất X là
A. NaOH.
B. KOH.
C. NH3.
D. HCl.
Câu 30. Cho sơ đồ phản ứng sau:
Biết X1, X2, X3, X4, X5 là các hợp chất khác nhau của nguyên tố nhôm. Các chất X1 và X5 lần lượt là
A. Al2O3 và AlCl3.
B. Al2O3 và Al2(SO4)3.
C. AlCl3 và Al2O3.
D. Al2(SO4)3 và Al2O3.
Câu 31. Cho các phát biểu:
(a) Fe tác dụng với dung dịch AgNO3 dư thu được muối sắt (III).
(b) Nhôm, sắt bị thụ động hoá trong dung dịch HNO3 đặc, nguội.
(c) Be không tác dụng với nước ở nhiệt độ thường.
(d) Nhôm có khối lượng riêng lớn hơn sắt.
Số phát biểu đúng là
A. 1.
B. 2.
C. 4.
D. 3.
Câu 32. Chọn phát biểu đúng
A. Nhiệt phân natri clorua thu được kim loại natri và khí clo.
B. Trong các kim loại, kim loại kiềm có độ cứng lớn nhất.
C. Kim loại kiềm không tác dụng với dung dịch HNO3 đặc.
D. Cs phản ứng với nước mãnh liệt hơn Li trong cùng điều kiện.
Câu 33. Cho các dung dịch sau: Ba(HCO3)2, NaOH, AlCl3, KHSO4 được đánh ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của các chất X, Y, Z, T với các thuốc thử được ghi ở bảng sau:
|
Hoá chất |
X |
Y |
Z |
T |
|
Dung dịch HCl |
Khí bay ra |
Không hiện tượng |
Không hiện tượng |
Không hiện tượng |
|
Dung dịch Ba(OH)2 |
Kết tủa trắng không tan trong Ba(OH)2 dư |
Kết tủa trắng không tan trong Ba(OH)2 dư |
Không hiện tượng |
Kết tủa trắng tan trong Ba(OH)2 dư |
Chất Y là
A. AlCl3.
B. NaOH.
C. Ba(HCO3)2.
D. KHSO4.
Câu 34. Thực hiện các thí nghiệm sau:
(a) Đốt dây sắt trong khí clo dư.
(b) Cho FeO vào dung dịch HNO3 (loãng, dư).
(c) Cho Fe vào dung dịch Fe(NO3)3.
(d) Cho Fe vào dung dịch H2SO4 (loãng, dư).
Số thí nghiệm tạo thành muối sắt (II) là
A. 1.
B. 3.
C. 2.
D. 4.
Câu 35. Đốt cháy hoàn toàn 1,08 gam Al bằng lượng dư khí O2, thu được m gam chất rắn. Giá trị của m là
A. 2,04.
B. 8,16.
C. 4,08.
D. 1,72.
Câu 36. Để hòa tan hoàn toàn 5,4 gam Al cần dùng vừa đủ V (ml) dung dịch NaOH 0,5M. Giá trị của V là
A. 400.
B. 300.
C. 100.
D. 200.
Câu 37. Hòa tan hoàn toàn m gam bột nhôm vào dung dịch HNO3 dư, thu được 1,0752 lít hỗn hợp khí X (gồm NO và N2O, có tỷ lệ mol lần lượt là 3:1, đktc) và dung dịch chỉ chứa một muối. Giá trị của m là
A. 1,836.
B. 1,404.
C. 1,620.
D. 2,916.
Câu 38. Cho 3,76 gam hỗn hợp gồm MgO, CuO và Fe2O3, tác dụng vừa đủ với 0,06 lít dung dịch HCl 2,0M, rồi cô cạn dung dịch sau phản ứng thì số gam muối khan thu được là
A. 6,10.
B. 4,93.
C. 7,06.
D. 8,02.
Câu 39. Cho 17,82 gam hỗn hợp gồm Na, Na2O, Ba, BaO (trong đó oxi chiếm 12,57% về khối lượng) vào nước dư, thu được x mol khí H2 và dung dịch Y. Cho dung dịch CuSO4 dư vào Y, thu được 35,54 gam kết tủa. Giá trị của x là
A. 0,12.
B. 0,10.
C. 0,08.
D. 0,06.
Câu 40. Hỗn hợp X gồm Fe2O3, FeO và Cu (trong đó oxi chiếm 16,0% về khối lượng). Cho m gam X tác dụng với 500 ml dung dịch HCl 2,0M (dư), thu được dung dịch Y và còn lại 0,27m gam chất rắn không tan. Cho dung dịch AgNO3 dư vào Y, thu được khí NO (sản phẩm khử duy nhất của N+5) và 165,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 28.
B. 48.
C. 32.
D. 40.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 6
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Al = 27, Ca = 40, Cl = 35,5, Mg = 24.
I. Phần trắc nghiệm
Câu 1: Kim loại sắt không phản ứng được với dung dịch nào sau đây?
A. H2SO4 loãng.
B. HNO3 loãng.
C. HNO3 đặc nguội.
D. H2SO4 đặc nóng.
Câu 2: Trong tự nhiên, canxi sunfat tồn tại dưới dạng ngậm nước (CaSO4.2H2O) được gọi là
A. boxit.
B. đá vôi.
C. thạch cao sống.
D. thạch cao nung.
Câu 3: Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,65A trong thời gian 3000 giây, thu được 2,16 gam Al. Hiệu suất của quá trình điện phân là
A. 60%.
B. 70%.
C. 80%.
D. 90%.
Câu 4: Tôn là sắt được tráng kim loại nào sau đây?
A. Cr.
B. Zn.
C. Sn.
D. Ni.
Câu 5: Thực hiện các thí nghiệm sau ở nhiệt độ thường:
(a) Cho bột Al vào dung dịch NaOH.
(b) Cho bột Fe vào dung dịch AgNO3.
(c) Cho CaO vào nước.
(d) Cho dung dịch Na2CO3 vào dung dịch CaCl2.
Số thí nghiệm có xảy ra phản ứng là
A. 4.
B. 2.
C. 3.
D. 1.
Câu 6: Dẫn 4,48 lít khí CO2 ở đktc vào lượng dư dung dịch Ca(OH)2. Khối lượng kết tủa thu được là
A. 10g.
B. 20g.
C. 30g.
D. 40g.
Câu 7: Cho Cu vào dung dịch Fe2(SO4)3. Sau khi cân bằng phương trình thì tổng hệ số (số nguyên tối giản) của tất cả các chất là
A. 6.
B. 4.
C. 5.
D. 9.
Câu 8: Phát biểu nào sau đây là sai?
A. Dung dịch K2Cr2O7 có màu da cam.
B. Cr2O3 tan được trong dung dịch NaOH loãng.
C. CrO3 là oxit axit.
D. Trong hợp chất, crom có số oxi hóa đặc trưng là +2, +3, +6.
Câu 9: Nhóm những chất khí (hoặc hơi) nào dưới đây đều gây hiệu ứng nhà kính khi nồng độ của chúng trong khí quyển vượt quá tiêu chuẩn cho phép?
A. CO2 và O2.
B. CO2 và CH4.
C. CH4 và H2O.
D. N2 và CO.
Câu 10: Phương trình hóa học nào sau đây là sai?
A. Cu + 2FeCl3 (dung dịch) → CuCl2 + 2FeCl2.
B. 2Na + 2H2O → 2NaOH + H2.
C. H2 + CuO → Cu + H2O.
D. Fe + ZnSO4 (dung dịch) → FeSO4 + Zn.
Câu 11: Oxi hóa hoàn toàn 15,1g hỗn hợp bột các kim loại Cu, Zn, Al bằng oxi thu được 22,3g hỗn hợp oxit. Cho các oxit tan bằng lượng vừa đủ dung dịch HCl. Khối lượng muối khan thu được là
A. 47,05g.
B. 63,9g.
C. 31,075g.
D. Đáp án khác.
Câu 12: Cho m gam Mg vào dung dịch HNO3 dư. Sau phản ứng hoàn toàn, thu được dung dịch X và 1,12 lít khí NO (đkc, sản phẩm khử duy nhất của N+5). Giá trị của m là
A. 1,8.
B. 2,4.
C. 3,6.
D. 6,0.
Câu 13: Phương pháp điều chế Al là
A. Điện phân dung dịch AlCl3.
B. Dùng Na đẩy Al ra khỏi dung dịch AlCl3.
C. Điện phân nóng chảy Al2(SO4)3.
D. Điện phân nóng chảy Al2O3.
Câu 14: Kim loại dẫn điện tốt nhất là:
A. Cu.
B. Ag.
C. Al.
D. Fe.
Câu 15: Chất tác dụng với dung dịch Na2CO3 tạo khí thoát ra là
A. HCl.
B. Na2SO4.
C. FeSO4.
D. BaCl2.
II. Phần tự luận
Câu 1 (1,5 điểm): Bằng phương pháp hóa học hãy nhận biết các khí: CO, CO2, SO2 đựng trong các bình riêng biệt, mất nhãn.
Câu 2 (2 điểm): Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Tính khối lượng sắt đã phản ứng.
Câu 3 (2 điểm): Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 đến dư vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Tính phần trăm khối lượng của Cu trong hỗn hợp X và giá trị của m.
Đáp án và hướng dẫn giải
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | C | C | C | B | A | B | C | B | B | D | A | A | D | B | A |
Câu 1: Kim loại sắt không phản ứng được với dung dịch HNO3 đặc, nguội. Chọn đáp án C.
Câu 2: CaSO4.2H2O được gọi là thạch cao sống. Chọn đáp án C.
Câu 3:
Câu 4: Tôn là sắt được tráng kim loại Zn. Chọn đáp án B.
Câu 5:
(a) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
(b) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
(c) CaO + H2O → Ca(OH)2
(d) Na2CO3 + CaCl2 → CaCO3 + 2NaCl. Chọn đáp án A.
Câu 6:
m↓ = 0,2.100 = 20 gam. Chọn đáp án B.
Câu 7: Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
Tổng hệ số (số nguyên tối giản) của tất cả các chất là 5. Chọn đáp án C.
Câu 8: Phát biểu sai: Cr2O3 tan được trong dung dịch NaOH loãng. Chọn đáp án B.
Câu 9: CO2 và CH4 đều gây hiệu ứng nhà kính khi nồng độ của chúng trong khí quyển vượt quá tiêu chuẩn cho phép. Chọn đáp án B.
Câu 10: Phương trình sai: Fe + ZnSO4 (dung dịch) → FeSO4 + Zn. Chọn đáp án D.
Câu 11: mO (oxit) = 22,3 – 15,1 = 7,2 gam → nO (oxit) = 0,45 mol
nHCl = 2.nO (oxit) = ngốc axit = 0,9 mol.
mmuối = mKL + mgốc axit = 15,1 + 0,9.35,5 = 47,05 gam. Chọn đáp án A.
Câu 12: Bảo toàn e: 2.nMg = 3.nNO → nMg = 0,075 mol → m = 0,075.24 = 1,8 gam. Chọn đáp án A.
Câu 13: Phương pháp điều chế Al là: Điện phân nóng chảy Al2O3. Chọn đáp án D.
Câu 14: Kim loại dẫn điện tốt nhất là Ag. Chọn đáp án B.
Câu 15: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O. Chọn đáp án A.
2. Phần tự luận
Câu 1 (1,5 điểm): Dẫn từng khí lần lượt qua ống nghiệm đựng nước brom, khí nào làm mất màu nước brom là SO2
Hai khí còn lại dẫn qua ống nghiệm đựng nước vôi trong, khí nào làm xuất hiện vẩn đục trắng là CO2
SO2 + Br2 + H2O → 2HBr + H2SO4
CO2 + Ca(OH)2 dư → CaCO3 + H2O
Câu 2 (2 điểm): Tính được số mol Cu(NO3)2: 0,02 mol, số mol AgNO3: 0,02 mol
Phản ứng xảy ra theo thứ thự:
mthanh sắt = 100 + (0,02.108 – 0,01.56) =101,6 gam < 101,72 gam.
Xảy ra tiếp phản ứng:
mthanh sắt = 100 + 0,02.108 + a.64 – 56.(0,01 + a) = 101,72
→ a = 0,015 mol
mFe pư = (0,01 + 0,015).56 = 1,4 gam.
Câu 3 (2 điểm): Tính được số mol NO2: 0,06 mol
Gọi số mol Al và Cu lần lượt là x và y mol
→ 27x + 64y = 1,23 (1)
Dung dịch Y gồm: Al(NO3)3: 0,01 mol; Cu(NO3)2: 0,015 mol và có thể có HNO3 dư
PTHH tạo kết tủa:
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 7
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Fe = 56, Na = 23, K = 39, Zn = 65, Mg = 24, Ba = 137.
I. Phần trắc nghiệm
Câu 1: Cho 1,44 gam kim loại M (có hoá trị II) tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được dung dịch X và 1,344 lít khí (đkc). Kim loại M là
A. Ba.
B. Mg.
C. Zn.
D. Fe.
Câu 2: Chất nào sau đây gây ra tính cứng tạm thời của nước?
A. Ca(HCO3)2.
B. NaOH.
C. CaCl2.
D. HCl.
Câu 3: Nguyên tắc chung được dùng để điều chế kim loại là
A. cho hợp chất chứa ion kim loại tác dụng với chất khử.
B. oxi hoá ion kim loại trong hợp chất thành nguyên tử kim loại.
C. khử ion kim loại trong hợp chất thành nguyên tử kim loại.
D. cho hợp chất chứa ion kim loại tác dụng với chất oxi hoá.
Câu 4: Trường hợp nào sau đây dung dịch từ không màu chuyển sang màu xanh?
A. Nhúng lá nhôm vào dung dịch HCl.
B. Nhúng lá đồng vào dung dịch AgNO3.
C. Thêm vài giọt phenolphtalein vào dung dịch NaOH.
D. Thêm Fe vào dung dịch NH3 đặc.
Câu 5: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1,0M thoát ra a lít NO. Nếu cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1,0M và H2SO4 0,5 M thoát b lít NO. Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Quan hệ giữa a và b là
A. b = a.
B. b = 2a.
C. 2b = 5a.
D. 2b = 3a.
Câu 6: Cho Cr tác dụng với O2 (to). Sản phẩm thu được là
A. CrO.
B. Cr2O3.
C. Cr3O4.
D. CrO3.
Câu 7: Hòa tan hoàn toàn 10,6 gam muối vô cơ X vào dung dịch H2SO4 loãng dư thu được 2,24 lít một chất khí Y có tỷ khối so với H2 là 22. X là chất nào sau đây?
A. NaHCO3.
B. Na2CO3.
C. K2SO3.
D. KHSO3.
Câu 8: Để hòa tan hoàn toàn 0,1 mol Fe2O3 và 0,1 mol Fe cần tối thiểu bao nhiêu lít dung dịch H2SO4 1M (loãng)?
A. 0,6.
B. 0,5.
C. 0,3.
D. 0,4.
Câu 9: Cu (Z = 29), cấu hình electron nguyên tử của đồng là
A. 1s22s22p63s23p63d94s2.
B. 1s22s22p63s23p63d104s1.
C. 1s22s22p63s23p63d84s3.
D. 1s22s22p63s23p63d104s2.
Câu 10: Tỉ lệ số người chết về bệnh phổi do hút thuốc lá gấp hàng chục lần số người không hút thuốc là. Chất gây nghiện và gây ung thư có trong thuốc lá là
A. nicotin.
B. aspirin.
C. cafein.
D. moocphin.
Câu 11: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự oxi hóa Fe và sự oxi hóa Cu.
B. sự oxi hóa Fe và sự khử Cu2+.
C. sự khử Fe2+ và sự khử Cu2+.
D. sự khử Fe2+ và sự oxi hóa Cu.
Câu 12: Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Kim loại M là
A. Fe.
B. Al.
C. Ag.
D. Zn.
Câu 13: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch
A. NaCl.
B. KOH.
C. K2SO4.
D. NaNO3.
Câu 14: Cho 5,6 gam Fe tác dụng với HNO3 đặc, nóng, dư, thu được V lít khí NO2 (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 3,36.
B. 6,72.
C. 1,493.
D. 2,24.
Câu 15: Cho dãy các chất: NH4Cl, (NH4)2SO4, NaCl, MgCl2, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
A. 4.
B. 1.
C. 5.
D. 3.
II. Phần tự luận
Câu 1 (1,5 điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: NaCl, AlCl3, MgCl2 đựng trong các bình riêng biệt, mất nhãn.
Câu 2 (2 điểm): Cho hỗn hợp X gồm: Fe, ZnO và MgSO3 vào dung dịch H2SO4 (loãng, dư) thu được dung dịch Y và khí Z.
- Cho Z lội qua nước vôi trong dư thu được chất rắn G.
- Cho dd NaOH dư vào dung dịch Y thu được kết tủa Q và dung dịch R. Nung Q ngoài không khí đến khối lượng không đổi được chất rắn T. Biết các phản ứng xảy ra hoàn toàn. Xác định các chất có trong Y, Z, G, Q, R, T và viết các PTHH xảy ra.
Câu 3 (2 điểm): Nung nóng 46,6 gam hỗn hợp gồm Al và Cr2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn. Chia hỗn hợp thu được sau phản ứng thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 300 ml dung dịch NaOH 1M (loãng), sau phản ứng thấy thoát ra V lít khí ở đktc. Để hòa tan hết phần hai cần vừa đủ dung dịch chứa a mol HCl. Tính giá trị của a và V.
Đáp án và hướng dẫn giải
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | B | A | C | B | B | B | B | C | B | A | B | D | B | B |
Câu 1: Bảo toàn e: 2.nM = 2.nkhí → nM = 0,06 mol → MM = 1,44 : 0,06 = 24. Vậy M là Mg. Chọn đáp án B.
Câu 2: Ca(HCO3)2 gây ra tính cứng tạm thời của nước. Chọn đáp án A.
Câu 3: Nguyên tắc chung được dùng để điều chế kim loại là khử ion kim loại trong hợp chất thành nguyên tử kim loại. Chọn đáp án C.
Câu 4: Cu + 2AgNO3 (không màu) → Cu(NO3)2 (xanh) + 2Ag. Chọn đáp án B.
Câu 5:
a : b = 0,02 : 0,04 = 1 : 2. Chọn đáp án B.
Câu 6: 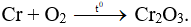
Câu 7: Mkhí = 2.22 = 44 → Loại đáp án C và D.
Giả sử A đúng:
→ mmuối X = 0,1.84 = 8,4 gam ≠ 10,6 gam. Vậy A sai. Chọn đáp án B.
Câu 8:
Vaxit = 0,3 lít. Chọn đáp án C.
Câu 9: Cu (Z = 29): 1s22s22p63s23p63d104s1. Chọn đáp án B.
Câu 10: Chất gây nghiện và gây ung thư có trong thuốc lá là nicotin. Chọn đáp án A.
Câu 11: Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra sự oxi hóa Fe và sự khử Cu2+. Chọn đáp án B.
Câu 12: Kim loại Zn phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung dịch HNO3 (đặc, nguội). Chọn đáp án D.
Câu 13: Để nhận biết ion Fe2+ trong dung dịch ta dùng dung dịch KOH. Hiện tượng: xuất hiện kết tủa màu trắng hơi xanh, hóa nâu đỏ trong không khí. Chọn đáp án B.
Câu 14: Bảo toàn e: 3.nFe = nkhí = 0,3 → Vkhí = 0,3.22,4 = 6,72 lít. Chọn đáp án B.
Câu 15: (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3 + 2H2O
MgCl2 + Ba(OH)2 → BaCl2 + Mg(OH)2 ↓
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2 ↓. Chọn đáp án D.
2. Phần tự luận
Câu 1 (1,5 điểm): Đánh số thứ thự từng lọ, trích mỗi lọ một ít dung dịch sang ống nghiệm đánh số tương ứng.
Chọn dung dịch NaOH làm thuốc thử.
Ống nghiệm nào xuất hiện kết tuả keo trắng, kết tủa tan khi thêm lượng dư NaOH là AlCl3.
Ống nghiệm nào xuất hiện kết tủa trắng, không tan khi dư NaOH là MgCl2.
Ống nghiệm nào không có hiện tượng xảy ra là NaCl.
PTHH:
3NaOH + AlCl3 → Al(OH)3 ↓+ 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
Câu 2 (2 điểm): Fe + H2SO4 → FeSO4 + H2
ZnO + H2SO4 → ZnSO4 + H2O
MgSO3 + H2SO4 → MgSO4 + SO2 + H2O
dd Y gồm: Fe SO4; ZnSO4; MgSO4 và H2SO4 dư
Khí Z gồm H2 và SO2
Z + dd nước vôi trong dư:
SO2 + Ca(OH)2 → CaSO3 + H2O
Vậy G là CaSO3
Y + dd NaOH dư
2NaOH + H2SO4 → Na2SO4 + 2H2O
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
MgSO4 + 2NaOH → Mg(OH)2 ↓ + Na2SO4
ZnSO4 + 2NaOH → Zn(OH)2 ↓ + Na2SO4
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Kết tủa Q gồm: Mg(OH)2 và Fe(OH)2
dd R gồm: Na2SO4, Na2ZnO2, NaOH dư
Nung Q ngoài không khí
Câu 3 (2 điểm):
Theo bài ra Al dư, Đặt nCr2O3 pư = x mol, nAl dư = y mol
→ 52.2x + 102.x + 27y = 46,6 : 2
→ 206x + 27y = 23,3
Phần 1 :
Giải hệ được : x = 0,1 mol; y = 0,1 mol
→ chất rắn mối phần chứa 0,2 mol Cr; 0,1 mol Al; 0,1 mol Al2O3.
Bảo toàn điện tích có:
nHCl = nCl- = 3.nAl3+ + 2.nCr+ = 3.2.0,1 + 3.0,1 + 2.0,2 = 1,3 mol
V = 0,15.22,4 = 3,36 lít.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 8
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, N = 14, Mg = 24, Ba = 137, Al = 27, Cr = 52.
I. Phần trắc nghiệm
Câu 1: Ion Cu2+ oxi hóa được kim loại nào sau đây?
A. Al.
B. Au.
C. Ag.
D. Cu.
Câu 2: Để phân biệt CO2 và SO2 chỉ cần dùng thuốc thử là
A. nước brom.
B. CaO.
C. dung dịch Ba(OH)2.
D. dung dịch NaOH.
Câu 3: Hợp chất nào sau đây không tác dụng với dung dịch NaOH?
A. Cr(OH)2.
B. CrO3.
C. Cr(OH)3.
D. CrCl3.
Câu 4: Hấp thụ hoàn toàn 3,36 lít khí CO2 (đktc) vào 125 ml dung dịch Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol của chất tan trong dung dịch X là
A. 0,6M.
B. 0,2M.
C. 0,1M.
D. 0,4M.
Câu 5: Nung 6,58 (g) Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 (g) chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 1.
B. 4.
C. 3.
D. 2.
Câu 6: Cho FeO tác dụng với dung dịch HCl. Vai trò của FeO là
A. chất oxi hoá.
B. oxit axit.
C. chất khử.
D. oxit bazơ.
Câu 7: Chất X có đặc điểm: Đốt trên ngọn lửa đèn khí, ngọn lửa chuyển sang màu vàng. X không tác dụng với dung dịch BaCl2. X là
A. NaHCO3.
B. K2CO3.
C. Na2CO3.
D. KHCO3.
Câu 8: Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Câu 9: Cho hỗn hợp CuO và Fe vào dung dịch HNO3 loãng nguội. Nhận thấy CuO và Fe đều phản ứng hết. Sau phản ứng thu được dung dịch X, chất khí Y và chất rắn không tan Z. Cho dung dịch NaOH dư vào dung dịch X được kết tủa T. Kết tủa T phải chứa
A. Fe(OH)2 và Cu(OH)2.
B. Fe(OH)2.
C. Fe(OH)3 và Cu(OH)2.
D. Cu(OH)2.
Câu 10: Tác nhân chủ yếu gây mưa axit là
A. SO2 và NO2.
B. CH4 và NH3.
C. CO và CH4.
D. CO và CO2.
Câu 11: Sục khí CO2 đến dư vào dung dịch NaAlO2. Hiện tượng xảy ra là
A. có kết tủa nâu đỏ.
B. có kết tủa keo trắng, sau đó kết tủa lại tan.
C. có kết tủa keo trắng.
D. dung dịch vẫn trong suốt.
Câu 12: Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
A. 0,3 lít.
B. 0,6 lít.
C. 0,8 lít.
D. 1,0 lít.
Câu 13: Dãy nào sau đây chỉ gồm các chất vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3?
A. Fe, Ni, Sn.
B. Al, Fe, CuO.
C. Zn, Cu, Mg.
D. Hg, Na, Ca.
Câu 14: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 4,0 gam.
B. 0,8 gam.
C. 8,3 gam.
D. 2,0 gam.
Câu 15: Cho dãy các chất: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, MgO, CrO3. Số chất trong dãy có tính chất lưỡng tính là
A. 4.
B. 5.
C. 3.
D. 2.
II. Phần tự luận
Câu 1 (1,5 điểm): Bằng phương pháp hóa học, hãy phân biệt các khí sau: CO2, SO2, H2S đựng trong các bình riêng biệt, mất nhãn.
Câu 2 (2 điểm): Hỗn hợp X gồm Na, Al và Fe (với tỉ lệ số mol giữa Na và Al tương ứng là 2 : 1). Cho X tác dụng với H2O (dư) thu được chất rắn Y và V lít khí. Cho toàn bộ Y tác dụng với dung dịch H2SO4 loãng (dư) thu được 0,25V lít khí. Biết các khí đo ở cùng điều kiện, các phản ứng đều xảy ra hoàn toàn. Xác định tỉ lệ số mol của Fe và Al trong X.
Câu 3 (2 điểm): Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (nóng, dư) thoát ra V lít khí H2 (ở đktc). Tính giá trị của V.
Đáp án và hướng dẫn giải
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | A | A | A | B | A | D | A | C | B | A | C | C | A | A | D |
Câu 1: 2Al + 3Cu2+ → 2Al3+ + 3Cu . Chọn đáp án A.
Câu 2: SO2 làm mất màu dung dịch brom còn CO2 thì không. Chọn đáp án A.
Câu 3: Cr(OH)2 không tác dụng với dung dịch NaOH. Chọn đáp án A.
Câu 4:
Sau phản ứng thu được 2 muối BaCO3 (x mol) và Ba(HCO3)2 ( y mol)
Bảo toàn C: x + 2y = 0,15.
Bảo toàn Ba: x + y = 0,125.
Giải hệ được: x = 0,1 và y = 0,025
CM chất tan = 0,025 : 0,125 = 0,2M. Chọn đáp án B.
Câu 5:
mkhí = 6,58 – 4,96 = 46.4a + 32a → a = 7,5.10-3 mol
CM (HNO3) = 4a : 0,3 = 0,1 → pHY = 1. Chọn đáp án A.
Câu 6: FeO + 2HCl → FeCl2 + H2O
Vai trò của FeO là oxit bazơ. Chọn đáp án D.
Câu 7: Đốt trên ngọn lửa đèn khí, ngọn lửa chuyển sang màu vàng → X chứa nguyên tố Na.
X không tác dụng với dung dịch BaCl2. X là NaHCO3. Chọn đáp án A.
Câu 8: Các dung dịch: HCl, NH3 phản ứng được với Cu(OH)2. Chọn đáp án C.
Câu 9: CuO + 2HNO3 → Cu(NO3)2 + H2O
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2
Fedư + Cu(NO3)2 → Fe(NO3)2 + Cu.
Dung dịch X: Fe(NO3)2, chất khí Y: NO, chất rắn Z: Cu
Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3.
T chứa Fe(OH)2. Chọn đáp án B.
Câu 10: Tác nhân chủ yếu gây mưa axit là SO2 và NO2. Chọn đáp án A.
Câu 11: CO2 + NaAlO2 + 2H2O → Al(OH)3 ↓ + NaHCO3.
Hiện tượng xảy ra là có kết tủa keo trắng. Chọn đáp án C.
Câu 12: Để HNO3 là ít nhất thì phản ứng chỉ oxi hóa Fe → Fe2+.
Bảo toàn e: 3.nNO = 2.nFe + 2.nCu = 0,6 mol → nNO = 0,2 mol.
nHNO3 = 2.nFe + 2.nCu + nNO = 0,8 mol → V = 0,8 lít. Chọn đáp án C.
Câu 13: Fe, Ni, Sn vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch AgNO3. Chọn đáp án A.
Câu 14: mChất rắn ↓ = mO (CuO) = 9,1 – 8,3 = 0,8 gam.
nO (CuO) = nCuO = 0,8 : 16 = 0,05 mol → mCuO = 0,05.80 = 4gam. Chọn đáp án A.
Câu 15: Cr(OH)3, Zn(OH)2 có tính chất lưỡng tính. Chọn đáp án D.
2. Phần tự luận
Câu 1 (1,5 điểm): Dẫn lần lượt từng khí qua ống nghiệm đựng nước vôi trong, nếu ống nghiệm xuất hiện vẩn đục trắng → khí là CO2 và SO2 (I), không hiện tượng là H2S.
Dẫn 2 khí ở nhóm I qua ống nghiệm đựng dung dịch brom, khí làm mất màu dung dịch brom là SO2, không hiện tượng là CO2.
PTHH:
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Câu 2 (2 điểm): Gọi số mol Al là x mol → số mol Na là 2x mol
Cho X tác dụng với H2O
→ Vkhí = 2,5x.22,4 = V (1)
Chất rắn Y là Fe
Lấy (2) : (1) được y : x = 5 : 8.
Câu 3 (2 điểm): Bảo toàn khối lượng: mCr2O3 + mAl = mcr sau → mAl = 8,1 gam
Tính được: số mol Cr2O3 = 0,1 mol, số mol Al = 0,3 mol
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 9
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Fe = 56, Cu = 64, Al = 27, Cr = 52.
I. Phần trắc nghiệm
Câu 1: Dung dịch Ba(HCO3)2 phản ứng với dung dịch nào sau đây không xuất hiện kết tủa?
A. Dung dịch Ba(OH)2.
B. Dung dịch NaOH.
C. Dung dịch HCl.
D. Dung dịch Na2CO3.
Câu 2: Tính chất vật lí của kim loại không do các electron tự do quyết định là
A. tính dẫn điện.
B. ánh kim.
C. khối lượng riêng.
D. tính dẫn nhiệt.
Câu 3: Trong công nghiệp, hai kim loại được điều chế bằng phương pháp điện phân nóng chảy hợp chất của chúng là
A. Al và Fe.
B. Na và Fe.
C. Cu và Ag.
D. Na và Al.
Câu 4: Cho dung dịch muối X đến dư vào dung dịch muối Y, thu được kết tủa Z. Hòa tan hoàn toàn Z vào dung dịch HNO3 (loãng, dư), thu được khí không màu hóa nâu trong không khí. X và Y lần lượt là
A. AgNO3 và FeCl2.
B. AgNO3 và FeCl3.
C. Na2CO3 và BaCl2.
D. AgNO3 và Fe(NO3)2.
Câu 5: Đồng thau là hợp kim
A. Cu – Zn.
B. Cu – Ni.
C. Cu – Sn.
D. Cu – Au.
Câu 6: Khử hoàn toàn m gam Fe2O3 cần vừa đủ 3,36 lít khí CO (ở đktc). Khối lượng sắt thu được sau phản ứng là
A. 8,4.
B. 5,6.
C. 2,8.
D. 16,8.
Câu 7: Cho các nhận xét sau:
(1) Al và Cr đều tác dụng được với dung dịch HCl và dung dịch NaOH.
(2) Dẫn khí CO2 đến dư vào dung dịch Ca(OH)2 thì cuối cùng thu được kết tủa.
(3) Kim loại dẫn điện tốt nhất là Au.
(4) Thêm NaOH vào dung dịch FeCl2 thì thu được kết tủa màu trắng xanh.
(5) Để phân biệt Al và Al2O3 ta có thể dùng dung dịch NaOH.
Số nhận xét không đúng là
A. 3.
B. 2.
C. 5.
D. 4.
Câu 8: Nhận định nào sau đây là sai?
A. Ở nhiệt độ thường, Ni bền với không khí và nước.
B. Kẽm là kim loại hoạt động, có tính khử mạnh hơn sắt.
C. Thiếc ở ô 50, nhóm IVA, chu kì 5 của bảng tuần hoàn.
D. Kẽm là kim loại lưỡng tính.
Câu 9: Một mẫu khí thải được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải gây ra?
A. H2S.
B. NO2.
C. SO2.
D. CO2.
Câu 10: Nhúng một tấm Fe có khối lượng 12g vào dung dịch CuCl2, sau một thời gian khối lượng của tấm kim loại tăng lên so với ban đầu là 0,5g. Hàm lượng Fe trong tấm sắt sau phản ứng là
A. 96,0%.
B. 68,0%.
C. 90,5%.
D. 56,5%.
Câu 11: Cho 31,2 gam hỗn hợp bột Al và Al2O3 tác dụng với dung dịch NaOH dư thoát ra 13,44 lít khí (đktc). Khối lượng mỗi chất trong hỗn hợp đầu là
A. 21,6 gam Al và 9,6 gam Al2O3.
B. 5,4 gam Al và 25,8 gam Al2O3.
C. 16,2 gam Al và 15,0 gam Al2O3.
D. 10,8 gam Al và 20,4 gam Al2O3.
Câu 12: Để phân biệt hai dung dịch KNO3 và Mg(NO3)2 đựng trong hai lọ riêng biệt, ta có thể dùng dung dịch
A. HCl.
B. NaOH.
C. NaCl.
D. MgCl2.
Câu 13: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng, sau đó kết tủa tan dần.
Câu 14: Sục 2,24 lít khí CO2 (đktc) vào 150 ml dung dịch NaOH 1M. Sau khi phản ứng xảy ra hoàn toàn trong dung dịch có chứa
A. Na2CO3 và NaHCO3.
B. Na2CO3.
C. NaHCO3.
D. Na2CO3 và NaOH.
Câu 15: Trong các năng lượng sau đây, nhóm các nguồn năng lượng nào được coi là năng lượng sạch?
A. Nhiệt điện, hạt nhân, mặt trời.
B. Thủy điện, gió, mặt trời.
C. Hóa thạch, mặt tròi, thủy điện.
D. Thủy điện, gió, nhiệt điện.
II. Phần tự luận
Câu 1 (1,5điểm): Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: KCl, Na2SO4, NaNO3 chứa trong các lọ riêng biệt, mất nhãn.
Câu 2 (2 điểm): Cho 10 gam hỗn hợp kim loại gồm Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thấy thu được 0,672 lít khí ở đktc. Lấy phần chất rắn còn lại tác dụng với lượng dư HCl (khi không có không khí) thu được 3,808 lít khí ở đktc. Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
Câu 3 (2 điểm): Điện phân nóng chảy Al2O3 với anot than chì (hiệu suất điện phân 100%) thu được m kg Al ở catot và 67,2 m3 (ở đktc) hỗn hợp khí X có tỉ khối so với hiđro bằng 16. Lấy 2,24 lít (ở đktc) hỗn hợp khí X sục vào dung dịch nước vôi trong (dư) thu được 2 gam kết tủa. Tính giá trị của m.
Đáp án và hướng dẫn giải
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | C | C | D | D | A | B | A | D | A | B | D | B | D | A | B |
Câu 1: Ba(HCO3)2 + 2HCl → BaCl2 + 2CO2 ↑ + 2H2O
Chọn đáp án C.
Câu 2: Khối lượng riêng của kim loại không do các electron tự do quyết định. Chọn đáp án C.
Câu 3: Trong công nghiệp, Na và Al được điều chế bằng phương pháp điện phân nóng chảy hợp chất của chúng. Chọn đáp án D.
Câu 4: AgNO3 + Fe(NO3)2 → Ag + Fe(NO3)3
Z là Ag.
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O. Chọn đáp án D.
Câu 5: Đồng thau là hợp kim Cu – Zn. Chọn đáp án A.
Câu 6:
mFe = 0,1.56 = 5,6 gam. Chọn đáp án B.
Câu 7:
(1) Sai vì Cr không tác dụng được với dung dịch NaOH.
(2) Sai vì CO2 dư thì Ca(OH)2 + 2CO2 → Ca(HCO3)2 ⇒ không thu được ↓.
(3) Sai vì kim loại dẫn điện tốt nhất là Ag.
(4) Đúng vì: FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓ (trắng xanh).
(5) Đúng vì:
⇒ sủi bọt khí không màu là Al, còn lại là Al2O3.
⇒ (1), (2) và (3) sai ⇒ chọn đáp án A.
Câu 8: Nhận định sai: “Kẽm là kim loại lưỡng tính”. Chọn đáp án D.
Câu 9: CuSO4 + H2S → CuS (↓ đen) + H2SO4. Chọn đáp án A.
Câu 10:
mKL tăng = 64a – 56a = 0,5 → a = 0,0625 mol
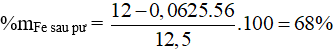
Câu 11: Bảo toàn e: 3.nAl = 2.nkhí → nAl = 0,4 mol → mAl = 0,4.27 = 10,8 gam. Chọn đáp án D.
Câu 12: Dùng dung dịch NaOH, xuất hiện kết tủa trắng → Mg(NO3)2, không hiện tượng là KNO3. Chọn đáp án B.
Câu 13: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
CaCO3 ↓ + H2O + CO2 dư → Ca(HCO3)2. Chọn đáp án D.
Câu 14: Đặt 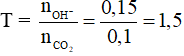
Câu 15: Nhóm các nguồn năng lượng nào được coi là năng lượng sạch: Thủy điện, gió, mặt trời. Chọn đáp án B.
2. Phần tự luận
Câu 1 (1,5điểm): Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Dùng BaCl2 làm thuốc thử, ống nghiệm nào xuất hiện kết tủa trắng là Na2SO4.
Không hiện tượng là: KCl và NaNO3 (I)
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Phân biệt nhóm I, dùng AgNO3, ống nghiệm nào xuất hiện kết tủa trắng là KCl, không hiện tượng là NaNO3
AgNO3 + KCl → AgCl ↓ + KNO3
Câu 2 (2 điểm): Gọi số mol Fe, Cr và Al lần lượt là x, y và z (mol)
→ 56x + 52y + 27z = 10 (1)
Giải hệ được: x = 0,155, y = 0,015, z = 0,02
Tính được %mFe = 86,8%; %mCr = 7,8%; %mAl = 5,4%.
Câu 3 (2 điểm):
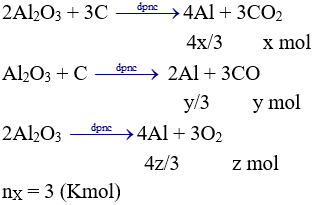
Trong 2,24 lít X: nCO2 = 0,02 mol; nCO = 0,08 mol;
Nếu X chỉ có CO và CO2 thì
Trong X nCO2 = 0,6 (Kmol). Ta có hpt:
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Đề thi Học kì 2 Hóa học lớp 12 có đáp án đề số 10
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hoá học 12
Thời gian làm bài: 45 phút
Cho nguyên tử khối của các nguyên tố: C = 12, H = 1, O = 16, Cu = 64, Zn = 65, Fe = 56, Al = 27.
I. Phần trắc nghiệm
Câu 1: Trong các phản ứng sau phản ứng nào sai?
A. 3Fe + 2O2 → Fe3O4
B. Fe + CuSO4 dd → FeSO4 + Cu
C. Fe + 2HCldd → FeCl2 + H2
D. Fe + Cl2 → FeCl2
Câu 2: Kim loại nào sau đây phản ứng mạnh với nước ở nhiệt độ thường ?
A. Ca
B. Fe
C. Cu
D. Ag.
Câu 3: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 6,72 lít.
B. 11,2 lít.
C. 8,96 lít.
D. 17,92 lít.
Câu 4: Có 3 kim loại X, Y, Z thỏa mãn các tính chất sau:
- X tác dụng với dung dịch HCl, không tác dụng với dung dịch NaOH và dung dịch HNO3 đặc, nguội.
- Y tác dụng được với dung dịch HCl và dung dịch HNO3 đặc nguội, không tác dụng với dung dịch NaOH.
- Z tác dụng được với dung dịch HCl và dung dịch NaOH, không tác dụng với dung dịch HNO3 đặc nguội. X, Y, Z lần lượt có thể là
A. Fe, Mg, Zn.
B. Zn, Mg, Al.
C. Fe, Al, Mg.
D. Fe, Mg, Al.
Câu 5: Nhận định nào sau đây là đúng?
A. Cr là kim loại lưỡng tính.
B. Cr hoạt động hóa học mạnh hơn Zn và Fe.
C. Cr tác dụng với HNO3 đặc, nguội giải phóng NO2.
D. Cr bị thụ động hóa trong H2SO4 đặc, nguội.
Câu 6: Cho phản ứng hóa học sau: 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 2H2O. Trong phản ứng này FeO đóng vai trò là
A. chất oxi hóa.
B. vừa là chất khử, vừa là chất oxi hóa.
C. chất khử.
D. không là chất khử hay oxi hóa.
Câu 7: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì
A. Phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. Phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. Phản ứng tạo ra kết tủa màu xanh.
D. Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Câu 8: Để đánh giá sự ô nhiễm kim loại nặng trong nước thải của một nhà máy, người ta lấy một ít nước, cô đặc rồi thêm dung dịch Na2S vào thấy xuất hiện kết tủa màu vàng. Hiện tượng trên chứng tỏ nước thải bị ô nhiễm bởi ion
A. Fe2+.
B. Cu2+.
C. Pb2+.
D. Cd2+.
Câu 9: Cho các hợp chất sau: Al2O3; Al(OH)3; MgO; FeO; Cr2O3; Cr(OH)3; CrO3; ZnO. Số hợp chất có tính lưỡng tính là
A. 5.
B. 6.
C. 7.
D. 8.
Câu 10: Cho 3,2 gam bột Cu tác dụng với 100 ml dung dịch hỗn hợp gồm HNO3 0,8M và H2SO4 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
A. 0,746.
B. 0,448.
C. 1,792.
D. 0,672.
Câu 11: Để phân biệt các dung dịch hóa chất riêng biệt KOH, (NH4)2SO4, NH4Cl, K2SO4 có thể dùng hóa chất nào sau đây?
A. dd BaCl2.
B. dd AgNO3.
C. dd Ba(OH)2.
D. dd HCl.
Câu 12: Tiến hành các thí nghiệm sau:
(a) Cho dung dịch AgNO3 vào dung dịch HBr.
(b) Cho Al2O3 vào dung dịch NaOH loãng, dư.
(c) Cho Cu vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho dung dịch Ba(OH)2 vào dung dịch NaHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kết tủa là:
A. 3.
B. 2.
C. 1.
D. 4.
Câu 13: Cho dãy các chất: Cu, Fe3O4, NaHCO3 và Al(OH)3. Số chất trong dãy tác dụng được với dung dịch H2SO4 loãng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: Kim loại có những tính chất vật lý chung nào sau đây?
A. Tính dẻo, tính dẫn nhiệt, nhiệt độ nóng chảy cao.
B. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn, có ánh kim.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim.
D. Tính dẻo, có ánh kim, tính cứng.
Câu 15: Cho hỗn hợp X gồm 0,1 mol Na và 0,2 mol Al vào nước dư, sau phản ứng hoàn toàn thấy thoát ra V lít khí H2 (đktc). Giá trị của V là
A. 2,24.
B. 4,48.
C. 6,72.
D. 7,84.
II. Phần tự luận
Câu 1 (1,5 điểm): Viết các phương trình phản ứng xảy ra trong các thí nghiệm được mô tả sau:
a/ Hòa tan FeCl2 vào nước rồi thêm H2SO4 loãng dư, sau đó thêm dung dịch KMnO4 dư thấy có khí màu vàng lục thoát ra và dung dịch thu được có chứa muối mangan (II).
b/ Hòa tan Fe3O4 trong dung dịch H2SO4 đặc nóng dư được dung dịch A và khí B mùi hắc. Sục khí B vào dung dịch brom hoặc dung dịch KMnO4 đều thấy các dung dịch này bị nhạt màu.
Câu 2 (2 điểm): Hoà tan hoàn toàn 0,3 mol hỗn hợp gồm Al và Al4C3 vào dung dịch KOH (dư), thu được a mol hỗn hợp khí và dung dịch X. Sục khí CO2 (dư) vào dung dịch X, lượng kết tủa thu được là 46,8 gam. Tính giá trị của a.
Câu 3 (2 điểm): Cho một lượng bột Zn vào dung dịch X gồm FeCl2 và CuCl2. Khối lượng chất rắn sau khi các phản ứng xảy ra hoàn toàn nhỏ hơn khối lượng bột Zn ban đầu là 0,5 gam. Cô cạn phần dung dịch sau phản ứng thu được 13,6 gam muối khan. Tính khối lượng từng muối trong X.
Đáp án và hướng dẫn giải
1. Phần trắc nghiệm (0,5 điểm/ 1 câu)
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Đ/a | D | A | C | D | D | C | D | D | A | D | C | B | C | C | B |
Câu 1: 2Fe + 3Cl2 → 2FeCl3. Chọn đáp án D.
Câu 2: Ca phản ứng mạnh với nước ở nhiệt độ thường. Chọn đáp án A.
Câu 3: Bảo toàn khối lượng: mkhí = 40,3 – 11,9 = 28,4 gam → nkhí =0,4 mol.
→ Vkhí = 0,4.22,4 = 8,96 lít. Chọn đáp án C.
Câu 4:
- X tác dụng với dung dịch HCl, không tác dụng với dung dịch NaOH và dung dịch HNO3 đặc, nguội. X là Fe.
- Y tác dụng được với dung dịch HCl và dung dịch HNO3 đặc nguội, không tác dụng với dung dịch NaOH. Y là Mg.
- Z tác dụng được với dung dịch HCl và dung dịch NaOH, không tác dụng với dung dịch HNO3 đặc nguội. Z là Al.
Chọn đáp án D.
Câu 5: Nhận định đúng: Cr bị thụ động hóa trong H2SO4 đặc, nguội. Chọn đáp án D.
Câu 6: 2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 2H2O. Số oxi hóa Fe tăng từ + 2 lên + 3.
FeO đóng vai trò là chất khử. Chọn đáp án C.
Câu 7: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sulfuric loãng đun nóng là vì Phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí. Chọn đáp án D.
Câu 8: Cd2+ + S2- → CdS ↓ vàng. Chọn đáp án D.
Câu 9: Hợp chất có tính lưỡng tính là Al2O3; Al(OH)3; Cr2O3; Cr(OH)3; ZnO. Chọn đáp án A.
Câu 10:
H+ hết → nNO = 0,12 : 4 = 0,03 mol → V = 0,672 lít. Chọn đáp án D.
Câu 11: Dùng Ba(OH)2, đun nóng
+/ Không hiện tượng → KOH
+/ Có khí không màu, mùi khai → NH4Cl
+ Có kết tủa trắng → K2SO4
+ Vừa có khí không màu, mùi khai, vừa có kết tủa trắng →(NH4)2SO4.
Câu 12:
(a) AgNO3 + HBr → AgBr ↓ + HNO3
(d) Ba(OH)2 + 2NaHCO3 → BaCO3↓ + Na2CO3 + 2H2O. Chọn đáp án B.
Câu 13: Các chất: Fe3O4, NaHCO3 và Al(OH)3 tác dụng được với dung dịch H2SO4 loãng. Chọn đáp án C.
Câu 14: Kim loại có những tính chất vật lý chung: Tính dẻo, tính dẫn điện, tính dẫn nhiệt và có ánh kim. Chọn đáp án C.
Câu 15:
→ Vkhí = (0,05 + 0,15).22,4 = 4,48 lít. Chọn đáp án B.
2. Phần tự luận
Câu 1 (1,5 điểm):
a. Phương trình phản ứng:
10FeCl2 + 6KMnO4 + 24H2SO4 → 5Fe2(SO4)3 + 10Cl2 + 3K2SO4 + 6MnSO4 + 24H2O
b. 2Fe3O4 + 10H2SO4 (đặc nóng) → 3Fe2(SO4)3 + SO2 + 10H2O
Khí A là SO2:
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4+ 2H2SO4
Câu 2 (2 điểm): Đặt số mol Al là x, số mol Al4C3 là y mol
→ x + y = 0,3 mol (1)
Kết tủa là Al(OH)3: 0,6 mol
Bảo toàn Al: x + 4y = 0,6 (2)
Giải hệ phương trình được: x = 0,2 và y = 0,1
Khí gồm H2 và CH4
Bảo toàn e: có 2.nH2 = 3.nAl → nH2 = 0,3 mol
Bảo toàn C: có nCH4 = 3.nAl4C3 = 0,3
a = 0,3 + 0,3 = 0,6 mol.
Câu 3 (2 điểm): Gọi số mol CuCl2 và FeCl2 lần lượt là x và y (mol)
PTHH:
mCr↓ = 0,5 → 65 (x + y) – (64x + 56y) = 0,5
→ x + 9y = 0,5 (1)
Muối sau phản ứng là ZnCl2: 0,1 mol
→ x + y = 0,1 (2)
Giải hệ được: x = 0,05 và y = 0,05
mCuCl2 = 0,05.135 = 6,75g;
mFeCl2 = 0,05.127 = 6,35g.
Chú ý: HS làm theo cách khác đúng vẫn cho điểm tối đa.
Để xem trọn bộ Đề thi Hóa học 12 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi lớp 12 chọn lọc, hay khác:
Đề thi Học kì 2 Toán lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Tiếng Anh lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Địa Lí lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Vật lí lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Lịch sử lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 GDCD lớp 12 năm 2022 - 2023 có đáp án
Xem thêm các chương trình khác:
- Góp ý sgk lớp 12 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi chính thức các môn THPT Quốc Gia các năm
- (3000+) Đề thi thử THPT Quốc Gia (các năm) từ các trường, sở trên cả nước
- Đề minh họa THPT quốc gia các năm
- Đề thi Đánh giá năng lực năm 2023 | Thông tin | Cấu trúc ĐGNL ĐHQG Hà Nội, HCM, ĐHBK, Bộ Công an