TOP 10 Đề thi Học kì 1 Hóa học 12 năm 2023 có đáp án
Bộ Đề thi Học kì 1 Hóa học lớp 12 năm 2023 có đáp án hay nhất giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hoá học 12 Học kì 1. Mời các bạn cùng đón xem:
Chỉ từ 270k mua trọn bộ Đề thi Hóa học 12 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
TOP 10 Đề thi Học kì 1 Hóa học lớp 12 năm 2023 - 2024 có đáp án
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Este X chứa vòng benzen có công thức phân từ là C8H8O2. Số công thức cấu
tạo của X là
A. 3
B. 4
C. 5
D. 6
Câu 2: Trong điều kiện thích hợp glucozơ lên men tạo thành khí CO2 và
A. HCOOH
B. CH3CHO
C. CH3COOH
D. C2H5OH
Câu 3: Đun nóng dung dịch chứa m gam glucozơ với lượng dư AgNO3/NH3 đến khi
phản ứng hoàn toàn dược 10,8 gam Ag. Giá trị của m là?
A. 16,2 gam
B. 9 gam
C. 18 gam
D. 10,8 gam
Câu 4: Thuốc thử để nhận biết tinh bột là
A. I2
B. Cu(OH)2
C. AgNO3/NH3
D. Br2
Câu 5: Cacbohiđrat nào sau đây thuộc loại polisaccarit?
A. Saccarozơ.
B. Xenlulozơ.
C. Fructozơ.
D. Glucozơ.
Câu 6: Thuỷ phân 324 gam tinh bột với hiệu suất của phản ứng là 75%, khối lượng
glucozơ thu được là
A. 250 gam.
B. 300 gam.
C. 360 gam.
D. 270 gam.
Câu 7: Cho các chất sau: CH3NH2, CH3NHCH3, (CH3)3N, CH3CH2NH2. Số chất
thuộc loại amin bậc I?
A. 1
B. 2
C. 3
D. 4
Câu 8: Tên gọi của hợp chất CH3-CH2-NH-CH3 là
A. Etylmetylamin.
B. Metyletanamin.
C. N-metyletylamin.
D. Metyletylamin.
Câu 9: Đốt cháy hoàn toàn một amin no, đơn chức, mạch hở thu được 4,48 lít CO2 và
4,95 gam nước. Công thức phân tử của amin X là:
A. C4H11N
B. CH5N.
C. C3H9N.
D. C2H7N.
Câu 10: Cho 7,35 gam axit glutamic phản ứng với 140 ml dung dịch HCl 1M, thu
được dung dịch X. Cho 250 ml dung dịch NaOH 1M vào X, thu được dung dịch Y. Cô
cạn dung dịch Y, thu được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn,
giá trị của m là
A. 16,64.
B. 19,04.
C. 17,74.
D. 18,14.
Câu 11: Chất X vừa tác dụng được với axit, vừa tác dụng được với bazơ. Chất X là
A. CH3COOH
B. CH3CHO
C. CH3NH2
D. H2NCH2COOH
Câu 12: Thủy phân hoàn toàn 1 mol Gly-Ala trong dung dịch HCl dư. Sau phản ứng
cô cạn dung dịch thu được m gam rắn khan. Giá trị của m là
A. 127,5 gam
B. 118,5 gam
C. 237,0 gam
D. 109,5 gam
Câu 13: Quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime)
đồng thời giải phóng những phân tử nhỏ khác (thí dụ H2O) được gọi là phản ứng
A. trùng hợp.
B. thủy phân.
C. xà phòng hoá.
D. trùng ngưng.
Câu 14: Một loại tơ nilon-6,6 có phân tử khối là 362956 đvC. Số mắt xích có trong
loại tơ trên là:
A. 166.
B. 1606.
C. 83.
D. 803.
Câu 15: Phát biểu nào sau đây đúng?
A. Tơ nilon-6,6 thuộc loại tơ bán tổng hợp.
B. Polietilen được điều chế bằng phản ứng trùng ngưng etilen.
C. Cao su là vật liệu polime có tính đàn hồi.
D. Tơ poliamit rất bền trong môi trường axit
Câu 16: Để loại bỏ sắt bám trên một tấm kim loại bằng bạc có thể dùng dung dịch
A. CuSO4 dư.
B. FeSO4 dư.
C. FeCl3 dư.
D. ZnSO4 dư.
Câu 17: Để chống ăn mòn cho các chân cột thu lôi bằng thép chôn dưới đất, người ta
dùng phương pháp bảo vệ điện hoá. Trong thực tế, có thể dùng kim loại nào sau đây
làm điện cực bảo vệ?
A. Na
B. Zn
C. Sn
D. Cu
Câu 18: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al2O3,
MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ,
thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan
Z gồm
A. MgO, Fe, Cu
B. Mg, Fe, Cu,
C. MgO, Fe3O4 Cu,
D. Mg, FeO, Cu.
Câu 19: Phương pháp điều chế kim loại kiềm là:
A. khử oxit bằng khí CO.
B. điện phân nóng chảy muối halogen hoặc hiđroxit của chúng.
C. điện phân dung dịch muối halogen.
D. cho Al tác dụng với dung dịch muối.
Câu 20: Điện phân nóng chảy 23,4g muối clorua của 1 kim loại kiềm R thu được 4,48
lít khí (đktc) ở anot. R là:
A. Li.
B. Na.
C. K.
D. Rb.
Câu 21: Vonfam (W) thường được dùng để chế tạo dây tóc bóng đèn. Nguyên nhân là
do:
A. W là kim loại rất dẻo.
B. W là kim loại nhẹ và bền.
C. W có khả năng dẫn điện tốt.
D. W có nhiệt độ nóng chảy rất cao.
Câu 22: Trong các muối sau, muối nào dễ bị nhiệt phân?
A. LiCl.
B. NaNO3.
C. KHCO3.
D. KBr.
Câu 23: Cho 0,78 gam kim loại kiềm M tác dụng với nước (dư), thu được 0,01 mol
khí H2. Kim loại M là
A. Na.
B. K.
C. Rb.
D. Li.
Câu 24: Hãy sắp xếp các cặp oxi hóa khử sau đây theo thứ tự tăng dần tính oxi hóa
của các ion kim loại. (1) Fe2+/Fe; (2) Pb2+/Pb; (3) 2H+/H2; (4) Ag+/Ag; (5) Na+/Na;
(6) Fe3+/Fe2+; (7) Cu2+/Cu
A. (5) < (1) < (2) < (3) < (7) < (6) < (4)
B. (4) < (6) < (7) < (3) < (2) < (1) < (5)
C. (5) < (1) < (6) < (2) < (3) < (4) < (7)
D. (5) < (1) < (2) < (6) < (3) < (7) < (4)
Câu 25: Hiện tượng nào dưới đây được mô tả không đúng?
A. Thêm NaOH vào dung dịch chứa FeCl3 màu vàng thấy xuất hiện kết tủa màu nâu đỏ.
B. Thêm một ít bột Fe vào lượng dư dung dịch AgNO3 thấy hình thành dung dịch màu xanh nhạt.
C. Thêm Fe(OH)3 màu nâu đỏ vào dung dịch H2SO4 thấy hình thành dung dịch màu vàng.
D. Thêm Cu vào dung dịch Fe(NO3)3 thấy dung dịch chuyển từ màu vàng sang màu xanh.
Câu 26: Cho 8,3 gam hỗn hợp X gồm Al, Fe (nAl = nFe) vào 100 ml dung dịch Y gồm
Cu(NO3)2 và AgNO3. Sau khi phản ứng kết thúc thu được chất rắn Y gồm 3 kim loại.
Hòa tan hoàn toàn chất rắn Y vào dung dịch HCl dư thấy có 1,12 lít khí thoát ra (đktc)
và còn lại 28 gam chất rắn không tan Z. Nồng độ mol của Cu(NO3)2 và của AgNO3
lần lượt là:
A. 2M và 1M.
B. 0,2M và 0,1M.
C. 1M và 2M.
D. 1,5M và 2M.
Bài 27: Cho một peptit X được tạo nên bởi n gốc alanin có khối lượng phân tử là 302
đvC. Peptit X thuộc loại
A. pentapepit.
B. đipetit.
C. tetrapeptit.
D. tripetit.
Câu 28: Tơ được sản xuất từ xenlulozơ?
A. to tằm
B. tơ capron
C. tơ nilon-6,6
D. tơ visco
Câu 29: Polime nào dưới đây có cùng cấu trúc mạch polime với nhựa bakelit?
A. amilozơ
B. glicogen
C. cao su lưu hoá
D. xenlulozơ
Câu 30: Thuỷ phân hoàn toàn 3,7 gam chất X có công thức phân tử C3H6O2 trong 100
gam dung dịch NaOH 4%, cô cạn dung dịch sau phản ứng thu được 5,4 gam chất rắn.
Công thức cấu tạo của X là
A. HCOOC2H5.
B. HCOOC3H7.
C. CH3COOCH3.
D. CH3COOC2H5.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I – TRẮC NGHIỆM (7 ĐIỂM)
|
1D |
2D |
3B |
4A |
5B |
6D |
7B |
8A |
9A |
10D |
|
11D |
12C |
13D |
14B |
15C |
16C |
17B |
18A |
19B |
20B |
|
21D |
22C |
23B |
24A |
25B |
26C |
27C |
28D |
29C |
30A |
Câu 1:
Đáp án D
Số công thức cấu tạo của X là:
C6H5COOCH3
(o, p, m)-HCOOC6H4CH3
HCOOCH2C6H5
CH3COOC6H5
Câu 2:
Đáp án D
C6H12O6 len men→ 2CO2 + 2C2H5OH
Câu 3:
Đáp án là B
nAg=0,1 mol→nglucozo=0,05 mol→mglucozo=0,05.180=9 gam
Câu 4:
Đáp án A
Thuốc thử để nhận biết tinh bột là I2.
Hiện tượng: xuất hiện màu xanh tím đặc trưng.
Giải thích: do phân tử tinh bột hấp phụ iot tạo ra màu xanh tím đặc trưng.
Câu 5:
Đáp án B
Fructozơ, glucozơ là monosaccarit
Saccarozơ thuộc đisaccarit
Xenlulozơ thuộc polisaccarit
Câu 6:
Đáp án D
(C6H10O5)n + nH2O H+, to→ nC6H12O6
Khối lượng glucozơ thu được là:
mglucozơ = 324162.180.75%=270 gam
Câu 7:
Đáp án B
Amin bậc I là amin chỉ có 1 nhóm hiđrocacbon thay thế cho 1 H trong phân
tử NH3
→ Chất thuộc loại amin bậc 1 là CH3NH2, CH3CH2NH2
Câu 8:
Đáp án A
Cách gọi tên amin bậc II: Tên gốc hiđrocacbon + amin
Có 2 gốc hiđrocacbon là metyl và etyl thì đọc etyl trước
→ Tên gọi: etylmetylamin
Câu 9:
Đáp án A
nCO2(đktc)
Đặt công thức amin no, đơn chức mạch hở là CnH2n+3N: a (mol)
CnH2n+3N + O2 nCO2 + H2O + N2
→ namin =
Vậy công thức amin là C4H11N
Câu 10:
Đáp án D
Chất rắn khan bao gồm muối của axit glutamic, NaCl, NaOH dư
Áp dụng định luật bảo toàn khối lượng ta có:
Câu 11:
Đáp án D
Glyxin: H2NCH2COOH là chất lưỡng tính, tác dụng được với cả axit và bazơ:
H2NCH2COOH + HCl → ClH3NCH2COOH
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
Câu 12:
Đáp án C
Chất rắn khan gồm ClH3N-CH2-COOH (1 mol) và CH3-CH(NH3Cl)-COOH (1 mol)
Câu 13:
Đáp án D
Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân
tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác (thí dụ
H2O,..).
Câu 14:
Đáp án B
Tơ nilon-6,6 là: [-OC-(CH2)4-CO-HN-(CH2)6-NH-]n (M = 226n).
→ số mắt xích trong loại tơ trên =
Câu 15:
Đáp án C
A sai vì tơ nilon-6,6 thuộc loại tơ tổng hợp
B sai vì polietilen được điều chế bằng phản ứng trùng hợp etilen.
D sai vì tơ poliamit kém bền trong môi trường axit
Câu 16:
Đáp án C
Sử dụng dung dịch FeCl3 dư có thể loại bỏ được Fe
Fe + 2FeCl3 → 3FeCl2
Câu 17:
Đáp án B
Dùng kim loại có tính khử mạnh hơn Fe để tạo thành một pin điện hóa. Khi
đó kim loại này bị ăn mòn điện hóa, Fe được bảo vệ.
Dùng Zn làm điện cực bảo vệ. Na có tính khử quá mạnh nên không thể
dùng làm điện cực bảo vệ.
Câu 18:
Đáp án A
Cho CO dư qua hỗn hợp X thu được chất rắn Y gồm: Al2O3; MgO; Fe; Cu
(vì CO chỉ khử được những oxit của kim loại đứng sau Al trong dãy hoạt
động hóa học).
Cho Y vào NaOH dư, Al2O3 tan hết, phần không tan Z gồm: MgO; Fe; Cu.
Câu 19:
Đáp án B
Kim loại kiềm được điều chế bằng cách điện phân nóng chảy muối halogen
hoặc hiđroxit của chúng.
Câu 20:
Đáp án B
Ta có = 4,48 : 22,4 = 0,2 mol
2RCl 2R + Cl2
= 0,4 mol
→ MRCl = 23,4 : 0,4 = 58,5 (g/mol)
→ MR = 58,5 – 35,5 = 23 (g/mol) (Na)
Câu 21:
Đáp án D
Vonfam (W) có nhiệt độ nóng chảy cao nhất trong các kim loại (3410oC)
nên thường được dùng để chế tạo dây tóc bóng đèn
Câu 22:
Đáp án C
2KHCO3 K2CO3 + CO2 + H2O
Câu 23:
Đáp án B
Kim loại kiềm có số electron nhường bằng 1
Bảo toàn electron:
1.nM = 2.
→ nM = 2.0,01 = 0,02 mol
MM = = 39 (g/mol) (K)
Câu 24:
Đáp án A
Theo dãy điện hóa của kim loại, thứ tự tăng dần tính oxi hóa của các ion
kim loại được sắp xếp như sau:
(5) Na+/Na < (1) Fe2+/Fe < (2) Pb2+/Pb < (3) 2H+/H2 < (7) Cu2+/Cu < (6) Fe3+/Fe2+ < (4) Ag+/Ag
Câu 25:
Đáp án B
A. Phát biểu đúng vì xảy ra phản ứng
3NaOH + FeCl3 → 3NaCl + Fe(OH)3 nâu đỏ
B. Phát biểu không đúng vì
Fe + 3AgNO3 dư Fe(NO3)3 (màu vàng) + 3Ag.
C. Phát biểu đúng vì xảy ra phản ứng tạo muối Fe2(SO4)3 màu vàng
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
D. Phát biểu đúng vì phản ứng tạo muối Cu(NO3)2 màu xanh
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Câu 26:
Đáp án C
nFe = nAl = = 0,1 mol
= = 0,05 mol
Sau phản ứng thu được Y gồm 3 kim loại là: Ag, Cu, Fe dư
Chất rắn không tan Z gồm Cu, Ag
Bảo toàn electron cho cả quá trình:
Trong đó Al và Fe hòa tan hết trong dung dịch.
Chất rắn không tan Z gồm Cu, Ag
ne nhường = ne nhận
→ 3.nAl + 2.nFe = nAg + 2.nCu + 2.
→ 3.0,1 + 2.0,1 = nAg + 2nCu + 2.0,05
→ nAg + 2nCu = 0,4 (1)
Lại có mAg + mCu = 28 gam
→ 108.nAg + 64.nCu = 28 (2)
Từ (1) và (2) → nAg = 0,2 mol; nCu = 0,1 mol
= 1M
Câu 27:
Đáp án C
nAla → Peptit (Alan) + (n - 1)H2O.
Bảo toàn khối lượng:
X là tetrapeptit
Câu 28:
Đáp án D
Các loại tơ có nguồn gốc từ xenlulozơ là tơ visco và tơ axetat.
Câu 29:
Đáp án C
Nhựa bakelit có cấu trúc mạng không gian → cao su lưu hóa có cùng cấu trúc mạch với nhựa bakelit
Câu 30:
Đáp án A
Độ bất bão hòa k = 1
X thủy phân trong dung dịch NaOH → X là este no, đơn chức, mạch hở
nX = 0,05 mol ; nNaOH = 0,1 mol
Gọi công thức của muối là RCOONa (0,05 mol)
→ nNaOH dư =0,05 mol
mchất rắn = mmuối + mNaOH dư
→ 5,4 = 0,05.(R+67)+0,05.40
→ R =1
→ Công thức của muối là HCOONa
→ Công thức của este là HCOOC2H5.
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Este X được tạo bởi ancol etylic và axit axetic. Công thức của X là
A. CH3COOCH3.
B. HCOOC2H5.
C. HCOOCH3.
D. CH3COOC2H5.
Câu 2: Số nguyên tử hiđro trong phân tử glucozơ là
A. 11.
B. 22.
C. 6.
D. 12.
Câu 3: Chất nào sau đây không có phản ứng thủy phân?
A. Glucozơ
B. Chất béo
C. Saccarozơ
D. Xenlulozơ
Câu 4: Glucozơ lên men thành ancol etylic theo phương trình phản ứng sau:
Để thu được 92 gam C2H5OH cần dùng m gam glucozơ. Biết hiệu suất của quá trình lên men là 60%. Giá trị của m là
A. 360
B. 300
C. 108
D. 270
Câu 5: Amin no, đơn chức, mạch hở có công thức tổng quát là
A. CnH2nN.
B. CnH2n+1N.
C. CnH2n+3N.
D. CnH2n+2N.
Câu 6: Chất có tính bazơ mạnh nhất là
A. C2H5NH2.
B. (C6H5)3N.
C. (CH3)2NH.
D. CH3NH2.
Câu 7: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu xanh?
A. Alanin.
B. Glyxin.
C. Lysin.
D. Valin.
Câu 8: Hợp chất nào dưới đây thuộc loại amino axit
A. CH3COOC2H5
B. HCOONH4
C. C2H5NH2
D. H2NCH2COOH
Câu 9: Chất X vừa tác dụng được với axit, vừa tác dụng được với bazơ. Chất X là
A. CH3COOH
B. CH3CHO
C. CH3NH2
D. H2NCH2COOH
Câu 10: Chất nào dưới đây tạo phức màu tím với Cu(OH)2?
A. Gly-Val
B. Glucozơ
C. Ala-Gly-Val
D. metylamin
Câu 11: Phân tử khối của peptit Ala-Gly là
A. 164
B. 160
C. 132
D. 146
Câu 12: Polime nào sau đây thuộc loại polime thiên nhiên?
A. Polietilen.
B. Poli(vinyl clorua)
C. Polibutađien.
D. Xenlulozơ.
Câu 13: Chất nào sau đây không có khả năng tham gia phản ứng trùng hợp?
A. propen
B. stiren
C. isopren
D. toluen
Câu 14: Polime X là chất rắn trong suốt có khả năng cho ánh sáng truyền
qua tốt nên được dùng chế tạo thuỷ tinh hữu cơ plexiglas. Tên gọi của X là
A. polietilen.
B. poliacrilonitrin.
C. poli(metyl metacrylat).
D. poli(vinyl clorua).
Câu 15: PVC là chất rắn vô định hình, cách dẫn điện tốt, bền với axit, được
dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa,... PVC được tổng
hợp trực tiếp từ monome nào sau đây?
A. Vinyl clorua.
B. Vinyl axetat.
C. Acrilonitrin.
D. Propilen.
Câu 16: Polime X có phân tử khối là 336000 và hệ số trùng hợp là 12000. Vậy X là
A. PE
B. PP
C. PVC
D. Teflon
Câu 17: Cho các nhận xét sau:
(1) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau.
(2) Hai đồng phân amino axit của C3H7NO2 tạo ra tối đa 3 đipeptit.
(3) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(4) Thủy phân hoàn toàn tinh bột và xenlulozơ mỗi chất chỉ cho 1 loại monosaccarit duy nhất.
(5) Nồng độ glucozơ trong máu người bình thường khoảng 5%.
(6) Tất cả các dung dịch protein đều có phản ứng màu biure.
(7) Dung dịch lòng trắng trứng có phản ứng màu biure.
Số nhận xét đúng là
A. 5.
B. 4.
C. 3.
D. 6.
Câu 18: Bán kính nguyên tử các nguyên tố: Na, Li, Be, B. Xếp theo chiều tăng dần là:
A. B < Be < Li < Na
B. Na < Li < Be < B
C. Li < Be < B < Na
D. Be < Li < Na < B
Câu 19: Cho Fe tác dụng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu
đỏ. Khí X là
A. N2
B. N2O
C. NO
D. NO2
Câu 20: Khử hoàn toàn 32 gam CuO thành kim loại cần vừa đủ V lít khí CO (đktc).
Giá trị của V là
A. 13,44
B. 8,96
C. 4,48
D. 6,72
Câu 21: Có các phản ứng như sau :
1. Fe + 2H+ → Fe2+ + H2
2. Fe + Cl2 → FeCl2
3. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
4. Ca + FeCl2 dung dịch → CaCl2 + Fe
5. Zn + 2FeCl3 ZnCl2 + 2FeCl2
6. 3Fe dư + 8HNO3 loãng → 3Fe(NO3)2 + 2NO + 4H2O
Trong các phản ứng trên, số phản ứng viết không đúng là
A. 1
B. 2.
C. 3.
D. 4.
Câu 22: Cho một mẫu hợp kim K-Na tác dụng với nước dư, thu được dung dịch X và
3,36 lít H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X
là
A. 150 ml
B. 75 ml
C. 60 ml
D. 30 ml
Câu 23: Có 3 mẫu hợp kim: Fe - Al; K - Na; Cu - Mg. Hoá chất có thể dùng để phân
biệt 3 mẫu hợp kim trên là
A. dung dịch NaOH.
B. dung dịch HCl.
C. dung dịch H2SO4.
D. dung dịch MgCl2
Câu 24: Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan?
A. 26,05 gam
B. 26,35 gam
C. 36,7 gam
D. 37,3 gam
Câu 25: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 1,344 lít khí CO2,
0,224 lít khí N2 (các thể tích khí đo ở đktc) và 1,62 gam H2O. Công thức của X là
A. C4H9N.
B. C3H7N.
C. C2H7N.
D. C3H9N.
Câu 26: Amino axit X chứa một nhóm -NH2. Cho 15 gam X tác dụng với axit HCl
(dư), thu được 22,3 gam muối khan. Công thức cấu tạo thu gọn của X là
A. H2NCH2COOH.
B. CH3CH2CH(NH2)COOH.
C. H2NCH2CH2COOH.
D. CH3CH(NH2)COOH.
Câu 27: Người ta sản xuất cao su buna từ gỗ theo sơ đồ sau:
Gỗglucozơancol etylicButađien-1,3Cao su Buna.
Tính lượng gỗ cần thiết để sản xuất được 1 tấn cao su, giả sử trong gỗ chứa 50% xenlulozơ?
A. 35,714 tấn.
B. 17,857 tấn.
C. 8,929 tấn.
D. 18,365 tấn.
Câu 28: Khi thủy phân hết 3,28 gam hỗn hợp X gồm hai este đơn chức, mạch hở thì
cần vừa đủ 0,05 mol NaOH, thu được một muối và hỗn hợp Y gồm hai ancol cùng dãy
đồng đẳng. Đốt cháy hết Y trong O2 dư, thu được CO2 và m gam H2O. Giá trị của m là
A. 2,16.
B. 3,06.
C. 1,26.
D. 1,71.
Câu 29: Để sản xuất 59,4 kg xenlulozơ trinitrat (hiệu suất phản ứng 90%) cần dùng ít
nhất V lít dung dịch HNO3 97,67% (D = 1,52 g/ml) phản ứng với lượng dư xenlulozơ.
Giá trị của V là
A. 27,23.
B. 27,72.
C. 28,29.
D. 24,95.
Câu 30: Hỗn hợp E gồm hai amin X (CnHmN), Y (CnHm+1N2, với n ≥ 2) và hai anken
đồng đẳng kế tiếp. Đốt cháy hoàn toàn 0,08 mol E, thu được 0,03 mol N2, 0,22 mol
CO2 và 0,30 mol H2O. Phần trăm khối lượng của X trong E là
A. 43,38%.
B. 57,84%.
C. 18,14%.
D. 14,46%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1D |
2D |
3A |
4B |
5C |
6C |
7C |
8D |
9D |
10C |
|
11D |
12D |
13D |
14C |
15A |
16A |
17B |
18A |
19D |
20B |
|
21B |
22A |
23A |
24C |
25D |
26A |
27A |
28A |
29C |
30B |
Câu 1:
Đáp án D
Ancol etylic: C2H5OH
Axit axetic: CH3COOH
Câu 2:
Đáp án D
Công thức phân tử của glucozơ là C6H12O6.
→ Số nguyên tử hiđro trong phân tử glucozơ là 12
Câu 3:
Đáp án A
Glucozơ là monosaccarit, không có phản ứng thủy phân.
Câu 4:
Đáp án B
Khối lượng glucozơ tính theo lí thuyết là mglucozơ = 1.180 = 180 gam
Do hiệu suất phản ứng 60% → khối lượng thực mà glucozơ cần dùng là:
Câu 5:
Đáp án C
Amin no, đơn chức, mạch hở có công thức tổng quát là CnH2n+3N.
Câu 6:
Đáp án C
Thứ tự tăng dần tính bazơ là: amin thơm < NH3 < amin no
Amin bậc 2 có tính bazơ mạnh hơn amin bậc 1
→ Chất có tính bazơ mạnh nhất là (CH3)2NH.
Câu 7:
Đáp án C
A, B, D không làm quỳ tím đổi màu vì đều có 1 nhóm NH2 và 1 nhóm COOH
C. lysin làm quỳ chuyển sang màu xanh vì có 2 nhóm NH2 và 1 nhóm COOH
Câu 8:
Đáp án D
Amino axit là hợp chất hữu cơ tạp chất hữu cơ tạp chức mà trong phân tử
chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH).
→ Hợp chất thuộc loại amino axit là H2NCH2COOH
A là este, B là muối, C là amin
Câu 9:
Đáp án D
Glyxin: H2NCH2COOH là chất lưỡng tính, tác dụng được với cả axit và bazơ:
H2NCH2COOH + HCl → ClH3NCH2COOH
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
Câu 10:
Đáp án C
A sai vì đipeptit không có phản ứng màu biure với Cu(OH)2
B sai vì glucozơ tạo phức màu xanh đặc trưng với Cu(OH)2 ở nhiệt độ thường.
C đúng vì từ tripeptit trở lên đều tạo phức màu tím với Cu(OH)2
D sai vì metylamin không phản ứng với Cu(OH)2
Câu 11:
Đáp án D
Phân tử khối của peptit Ala-Gly là:
(g/mol)
Câu 12:
Đáp án D
Polime thiên nhiên là xenlulozơ, tơ tằm, cao su thiên nhiên
Câu 13:
Đáp án D
Toluen có công thức là C6H5CH3 → không tham gia phản ứng trùng hợp vì vòng benzen chứa liên kết bội nhưng rất bền.
Câu 14:
Đáp án C
Thủy tinh hữu cơ hay còn gọi là poli(metyl metacrylat).
Phương trình điều chế:
Câu 15:
Đáp án A
PVC là viết tắt của Poli(vinyl clorua).
→ PVC được tổng hợp từ monome vinyl clorua (CH2=CHCl).
Câu 16:
Đáp án A
Phân tử khối của một mắt xích trong X là đvC
→ Mắt xích là -CH2-CH2-
→ X là PE (polietilen)
Câu 17:
Đáp án B
(1) sai vì tinh bột và xenlulozơ không phải là đồng phân cấu tạo của nhau.
(2) sai vì peptit tạo bởi -amino axit → Chỉ có 1 peptit là Ala-Ala.
(5) sai vì nồng độ glucozơ trong máu người bình thường khoảng 0,1%.
Câu 18:
Đáp án A
Li và Na thuộc cùng nhóm IA và ZLi < ZNa→ Bán kính Na > Li
Li, Be và B thuộc cùng chu kỳ 2 và ZLi < ZBe < ZB → Bán kính: Li > Be > B
Chiều tăng dần bán kính: B < Be < Li < Na
Câu 19:
Đáp án D
N2: Không màu nhẹ hơn không khí
N2O: Không màu nặng hơn không khí
NO: Không màu, hóa nâu ngoài không khí
NO2: Màu nâu đỏ
Câu 20:
Đáp án B
nCuO = 0,4 mol
nCO phản ứng = nO trong oxit = 0,4 mol
→ V = 0,4.22,4 = 8,96 lít
Câu 21:
Đáp án B
2. Sửa lại thành: 2Fe + 3Cl2 2FeCl3
4. Ca phản ứng với nước trong dung dịch trước
Ca + 2H2O → Ca(OH)2 + H2
Ca(OH)2 + FeCl2 dung dịch → CaCl2 + Fe(OH)2
→ Phản ứng 2,4 không đúng
Chú ý: Phản ứng 6 là gộp của 2 phản ứng:
Fe + 4HNO3→ Fe(NO3)3 + NO + 2H2O
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2
Câu 22:
Đáp án A
= 0,15 mol
= 2. = 0,3 mol
= 0,3 mol
→ VHCl = 0,3 : 2 = 0,15 lít = 150 ml
Câu 23:
Đáp án A
Sử dụng NaOH để phân biệt
- Hợp kim tan một phần trong NaOH dư: Fe-Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Hợp kim tan hoàn toàn trong NaOH dư: K-Na
2K + 2H2O → 2KOH + H2
2Na + 2H2O → 2NaOH + H2
- Hợp kim không tan trong NaOH dư: Cu-Mg
Câu 24:
Đáp án C
Bào toàn nguyên tố H:
= 0,6 mol
→ mKL + mHCl = m muối +
→ 15,4 + 36,5.0,6 = m muối + 2.0,3
→ m muối = 36,7 gam
Câu 25:
Đáp án D
Amin đơn chức →
Số nguyên tử cacbon là: C =
Số nguyên tử hiđro là: H =
→ Công thức phân tử của amin X là C3H9N
Câu 26:
Đáp án A
Gọi công thức của amino axit X có dạng H2N-R-(COOH)a
Bảo toàn khối lượng ta có:
Công thức của X là H2N-CH2-COOH.
Câu 27:
Đáp án A
(C6H10O5)n → nC6H12O6 → 2n C2H5OH → n butađien-1,3 → caosu buna
→
Khối lượng gỗ cần dùng là:
tấn
Câu 28:
Đáp án A
nX = nNaOH = 0,05 mol →
→ Trong X chứa este HCOOCH3 (M = 60)
Sản phẩm chỉ có 1 muối là HCOONa (0,05).
Bảo toàn khối lượng:
Quy đổi ancol thành CH3OH (0,05 mol) và CH2 (0,02 mol)
Bảo toàn nguyên tố H:
Câu 29:
Đáp án C
[C6H7O2(OH)3]n + 3nHNO3 [C6H7O2(ONO2)3]n + 3nH2O
Phản ứng với lượng dư xenlulozơ → Hiệu suất tính theo axit HNO3.
Khối lượng axit HNO3 cần dùng thực tế là:
28,29 lít
Câu 30:
Đáp án B
Nhận thấy X và Y có cùng số pi
→ amin no hoặc là amin không no 1 nối đôi
Nếu 2 amin không no 1 nối đôi thì = 0,08 mol
→ x + y = 0,08 (loại). Vì x + y + z = 0,08
→ các amin đều no
Ta có: nE = x + y + z = 0,08 (1)
Theo định luật bảo toàn nguyên tố N:
x + 2y = 0,06 (2)
(3)
Từ (1), (2) và (3)
→ x = 0,04 mol; y = 0,01 mol và z = 0,03 mol
Anken có dạng công thức trung bình là CaH2a
Bảo toàn nguyên tố C:
→ n = 3 và a = 7/3 là nghiệm duy nhất
→ E gồm C3H9N 0,04 mol và C3H10N2 0,01 mol và C7/3H14/3 0,03 mol
→ % C3H9N = 57,84%
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Loại dầu nào sau đây không phải là este của axit béo và glixerol?
A. Dầu vừng (mè).
B. Dầu lạc (đậu phộng).
C. Dầu dừa.
D. Dầu luyn.
Câu 2: Glucozơ và fructozơ
A. Đều tạo dung dịch màu xanh thẫm với Cu(OH)2
B. Đều có nhóm chức -CHO trong phân tử
C. Là 2 dạng thù hình của cùng 1 chất
D. Đều tồn tại chủ yếu ở dạng mạch hở
Câu 3: Chất không tham gia phản ứng thủy phân là
A. saccarozơ.
B. xenlulozơ.
C. fructozơ.
D. tinh bột.
Câu 4: Để chứng minh trong phân tử glucozơ có nhiều nhóm -OH ta cho dung dịch
glucozơ phản ứng với
A. dung dịch Br2.
B. dung dịch AgNO3/NH3.
C. Cu(OH)2, to thường.
D. Cu(OH)2 trong NaOH đun nóng.
Câu 5: Cho m gam tinh bột lên men thành ancol etylic với hiệu suất 90%. Toàn bộ
lượng khí sinh ra được hấp thụ hoàn toàn vào dung dịch Ca(OH)2 lấy dư thu được 50
gam kết tủa. Giá trị của m là:
A. 45 gam
B. 55 gam
C. 36,45 gam
D. 90 gam
Câu 6: Chất làm giấy quỳ tím ẩm chuyển thành màu xanh là:
A. H2N-CH2-COOH
B. CH3NH2
C. C6H5NH2
D. CH3COOH
Câu 7: Trong các tên gọi dưới đây, tên nào phù hợp với chất CH3–CH(CH3)–NH2?
A. Metyletylamin.
B. Etylmetylamin.
C. Isopropanamin.
D. Isopropylamin.
Câu 8: Cho 2,67 gam alanin phản ứng hết với dung dịch NaOH. Khối lượng muối thu
được là:
A. 4,44 gam.
B. 3,33 gam.
C. 11,1gam.
D. 2,88 gam.
Câu 9: Cho 10 gam hỗn hợp 3 amin đơn chức, no đồng đẳng liên tiếp (theo tỉ lệ mol
1 : 10 : 5 theo phân tử khối tăng dần) tác dụng vừa đủ với HCl thu được 15,84 gam
muối. Công thức phân tử của 3 amin lần lượt là:
A. CH5N, C2H7N, C3H9N
B. C2H7N, C3H9N, C4H11N
C. C3H7N, C4H9N, C5H11N
D. C3H9N, C4H11N, C5H13N
Câu 10: Cho 37,5 gam axit aminoaxetic (H2N-CH2-COOH) phản ứng hết với dung
dịch HCl. Sau phản ứng, khối lượng muối thu được là:
A. 55,75 gam.
B. 45,45 gam.
C. 35,65 gam.
D. 75,15 gam.
Câu 11: Polime nào sau đây có thể tham gia phản ứng cộng?
A. Xenlulozơ.
B. Cao su Buna.
C. Poli vinylclorua.
D. Polietilen
Câu 12: Có thể điều chế PVC bằng phản ứng trùng hợp monome sau
A. CH3CH2Cl
B. CH2=CHCl
C. CH2CHCH2Cl
D. CH3CH=CH2
Câu 13: Quá trình nhiều phân tử nhỏ (monome) kết hợp với nhau thành phân tử lớn
(polime) đồng thời giải phóng những phân tử nước gọi là phản ứng
A. trao đổi.
B. nhiệt phân.
C. trùng hợp.
D. trùng ngưng.
Câu 14: Khi thủy phân đến cùng peptit và protein đều thu được
A. amino axit.
B. a-amino axit.
C. b-amino axit
D. glucozơ.
Câu 15: Dãy kim loại được sắp xếp theo chiều tăng dần về khả năng dẫn điện là:
A. Fe, Al, Au, Ag, Cu
B. Al, Fe, Cu, Au, Ag
C. Fe, Al, Au, Cu, Ag
D. Ag, Cu, Au, Al, Fe
Câu 16: Kim loại có độ cứng lớn nhất trong các kim loại là:
A. Vonfam.
B. Crom
C. Sắt
D. Đồng
Câu 17: Kim loại Cu không phản ứng được với dung dịch
A. Fe(NO3)3
B. AgNO3
C. HNO3
D. Pb(NO3)2
Câu 18: Dãy gồm các kim loại được xếp theo thứ tự tính khử tăng dần từ trái sang
phải là:
A. Al, Mg, Fe
B. Fe, Al, Mg
C. Fe, Mg, Al
D. Mg, Fe, Al
Câu 19: Phương pháp thích hợp điều chế kim loại K là:
A. Điện phân dung dịch KCl.
B. Điện phân KCl nóng chảy.
C. Nhiệt phân KCl.
D. Nhiệt phân KCl nóng chảy.
Câu 20: Cho 24,3 gam hỗn hợp bột kim loại Mg, Fe và Al tác dụng vừa đủ với dung
dịch HCl thu được 14,56 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được
m gam muối khan. Giá trị của m là:
A. 70,45 gam
B. 47,375 gam
C. 35,8375 gam
D. 40,545 gam
Câu 21: Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi
kim.
D. Các kim loại thường có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy
được.
Câu 22: Kim loại dẫn điện tốt nhất là
A. Au.
B. Ag.
C. Al.
D. Cu.
Câu 23: Hơi thuỷ ngân rất độc, bởi vậy khi làm vỡ nhiệt kế thuỷ ngân thì chất bột
được dùng để rắc lên thuỷ ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Câu 24: Khi cho Cu tác dụng với dung dịch chứa H2SO4 loãng và NaNO3, vai trò của
NaNO3 trong phản ứng là
A. chất xúc tác.
B. chất oxi hoá.
C. môi trường.
D. chất khử.
Câu 25: Kim loại M phản ứng được với: dung dịch HCl, dung dịch Cu(NO3)2, dung
dịch HNO3 (đặc, nguội). Kim loại M là
A. Al.
B. Fe.
C. Ag.
D. Zn.
Câu 26: Cho phương trình hóa học:
aAl + bH2SO4 → cAl2(SO4)3 + dSO2 + eH2O. Tỉ lệ a : b là
A. 1 : 1.
B. 2 : 3.
C. 1 : 3.
D. 1 : 2.
Câu 27: Dãy gồm các kim loại được điều chế trong công nghiệp bằng phương pháp
điện phân hợp chất nóng chảy của chúng, là:
A. Na, Ca, Al.
B. Na, Ca, Zn.
C. Na, Cu, Al.
D. Fe, Ca, Al.
Câu 28: Thực hiện các thí nghiệm với hỗn hợp bột gồm Ag và Cu (hỗn hợp X):
(a) Cho X vào bình chứa một lượng dư khí O3 (ở điều kiện thường).
(b) Cho X vào một lượng dư dung dịch HNO3 (đặc).
(c) Cho X vào một lượng dư dung dịch HCl (không có mặt O2).
(d) Cho X vào một lượng dư dung dịch FeCl3.
Thí nghiệm mà Cu bị oxi hoá còn Ag không bị oxi hoá là
A. (d).
B. (a).
C. (b).
D. (c).
Câu 29: Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3.
(b) Nung FeS2 trong không khí.
(c) Nhiệt phân KNO3.
(d) Cho dung dịch CuSO4 vào dung dịch NH3 (dư).
(e) Cho Fe vào dung dịch CuSO4.
(g) Cho Zn vào dung dịch FeCl3 (dư).
(h) Nung Ag2S trong không khí.
(i) Cho Ba vào dung dịch CuSO4 (dư).
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
A. 3.
B. 5.
C. 2.
D. 4.
Câu 30: Cho 2,24 lít khí CO (đktc) phản ứng vừa đủ với 10 gam hỗn hợp X gồm CuO
và MgO phần trăm khối lượng của MgO trong X là
A. 20%.
B. 40%.
C. 60%.
D. 80%.
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: CH3COOCH=CH2 có tên gọi là
A. Metyl acrylat
B. Vinyl axetat
C. Metyl propionat
D. Vinyl fomat
Câu 2: Để phân biệt tinh bột và xenlulozơ có thể dùng thuốc thử nào sau đây?
A. dung dịch
B. quỳ tím
C. iot
D. Na
Câu 3: Chất không tan trong nước lạnh là
A. glucozơ.
B. tinh bột.
C. saccarozơ.
D. fructozơ.
Câu 4: Đun nóng dung dịch chứa 27 gam glucozơ với dung dịch AgNO3/NH3 thì
khối lượng Ag thu được tối đa là (Cho C = 12, H = 1, O = 16, Ag = 108)
A. 21,6g
B. 10,8g
C. 32,4g
D. 16,2g
Câu 5: Có bao nhiêu đồng phân cấu tạo amin có công thức phân tử C3H9N
A. 2.
B. 4.
C. 5.
D. 3.
Câu 6: Cho các chất sau: C6H5NH2 (1); CH3NH2 (2); NH3 (3). Trật tự tăng dần tính
bazơ (từ trái qua phải) là
A. (1), (2), (3).
B. (2), (3), (1).
C. (1), (3), (2).
D. (3), (2), (1).
Câu 7: Cho 9 gam etylamin (C2H5NH2) tác dụng vừa đủ với axit HCl khối lượng muối thu được là
A. 0,85 gam
B. 7,65 gam.
C. 16,3 gam.
D. 8,1 gam.
Câu 8: Để chứng minh aminoaxit là hợp chất lưỡng tính người ta có thể dùng phản ứng của chất này lần lượt với
A. dung dịch KOH và dung dịch HCl.
B. dung dịch HCl và dung dịch Na2SO4.
C. dung dịch NaOH và dung dịch NH3.
D. dung dịch KOH và CuO.
Câu 9: Nhóm CO-NH là
A. nhóm hiđroxyl.
B. nhóm cacboxyl.
C. nhóm peptit.
D. nhóm cacbonyl.
Câu 10: Chất không có khả năng tham gia phản ứng trùng hợp là
A. toluen (C6H5-CH3).
B. stiren (C6H5-CH=CH2).
C. propen (CH2=CH-CH3).
D. isopren (CH2=C(CH3)-CH=CH2).
Câu 11: Polime có công thức [-CO-(CH2)4-CO-NH-(CH2)6-NH-]n thuộc loại nào?
A. Tơ nilon-6,6
B. Cao su
C. Chất dẻo
D. Tơ capron
Câu 12: C2H5NH2 trong nước không phản ứng với chất nào trong số các chất sau?
A. HCl.
B. H2SO4.
C. NaOH.
D. Quỳ tím
Câu 13: Dung dịch chứa chất nào không làm đổi màu quì tím?
A. Amoniac
B. Natri hiđroxit
C. etyl amin
D. anilin
Câu 14: Để phân H2N-CH2-COOH, CH3COOH, H2N-(CH2)4CH(NH2)COOH người
ta dùng
A. Na.
B. NaOH.
C. quì tím.
D. HCl.
Câu 15: Có các chất: lòng trắng trứng, dung dịch glucozơ, dung dịch anilin, dung
dịch anđehit axetic. Nhận biết chúng bằng thuốc thử
A. dd Br2
B. Cu(OH)2/OH-
C. HNO3 đặc
D. dd AgNO3/NH3
Câu 16: Trùng hợp 2 mol etilen ở điều kiện thích hợp thì thu được bao nhiêu gam
polietilen (PE)?
A. 28 gam
B. 14 gam
C. 56 gam
D. 42 gam
Câu 17: Trong các phản ứng hoá học nguyên tử kim loại thể hiện
A. Tính oxi hoá.
B. Tính khử.
C. Không thể hiện tính oxi hoá và không thể hiện tính khử.
D. Vừa thể hiện tính oxi hoá, vừa thể hiện tính khử.
Câu 18: Hoà tan hoàn toàn m gam Fe cần dùng 200 ml dung dịch CuSO4 1M, tính giá trị m
A. 5,6 gam.
B. 11,2 gam.
C. 16,8 gam.
D. 22,4 gam.
Câu 19: Khối lượng muối thu được khi cho 11,25 gam axit amino axetic
(H2NCH2COOH) tác dụng hết với dung dịch axit HCl là
A. 10,15 gam.
B. 15,15 gam.
C. 11,15 gam.
D. 16,725 gam.
Câu 20: Hòa tan hoàn toàn 15,4 gam hỗn hợp kim loại (Mg và Zn) trong dung dịch
HCl dư thu được 6,72 lít khí H2 (đktc). Khối lượng muối tạo ra trong dung dịch là:
A. 36,7 gam
B. 63,7 gam
C. 35,7 gam
D. 53,7 gam
Câu 21: Kim loại có khối lượng riêng nhỏ nhất là
A. Hg.
B. Cs.
C. Al.
D. Li.
Câu 22: Cho x mol Mg và y mol Zn vào dung dịch chứa m mol Cu2+ và n mol Ag+.
Biết rằng x > . Sau phản ứng thu được dung dịch chứa 3 ion kim loại. Giá trị của y
cần thỏa mãn điều kiện nào sau đây?
A. y > m - x
B. y < m-x
C. y > m – x +
D. y < m – x +
Câu 23: Cho các phát biểu sau về ăn mòn hóa học:
(1) Ăn mòn hóa học không làm phát sinh dòng điện một chiều.
(2) Kim loại tinh khiết không bị ăn mòn hóa học.
(3) Về bản chất, ăn mòn hóa học cũng là một dạng ăn mòn điện hóa.
(4) Ăn mòn hóa học là quá trình oxi hóa – khử.
Trong các phát biểu trên, số phát biểu đúng là:
A. 2.
B. 4.
C. 3.
D. 1.
Câu 24: Hai dung dịch đều phản ứng được với kim loại Fe là
A. AgNO3 và H2SO4 loãng
B. ZnCl2 và FeCl3
C. HCl và AlCl3
D. CuSO4 và HNO3 đặc nguội
Câu 25: Tiến hành các thí nghiệm sau:
(a). Cho Cu vào dung dịch AgNO3.
(b). Cho Fe vào dung dịch Fe2(SO4)3.
(c). Cho Na vào dung dịch CuSO4.
(d). Dẫn khí CO (dư) qua bột CuO nóng.
(e). Nhiệt phân AgNO3.
(f). Cho Mg vào dung dịch FeCl2.
Số thí nghiệm có tạo thành kim loại là
A. 5
B. 4
C. 2
D. 3
Câu 26: Hòa tan hoàn toàn 3,2 gam một oxit kim loại cần vừa đủ 40ml dung dịch HCl
2M. Công thức của oxit là?
A. MgO.
B. Fe2O3.
C. CuO.
D. Fe3O4.
Câu 27: Cho phương trình phản ứng:
aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O. Tỉ lệ a : b là
A. 1 : 3.
B. 2 : 3.
C. 2 : 5.
D. 1 : 4.
Câu 28: Thực hiện các thí nghiệm sau:
(a) Cho Al vào dung dịch HCl.
(b) Cho Al vào dung dịch AgNO3.
(c) Cho Na vào H2O.
(d) Cho Ag vào dung dịch H2SO4 loãng.
Trong các thí nghiệm trên, số thí nghiệm xảy ra phản ứng là
A. 1.
B. 2.
C. 4.
D. 3.
Câu 29: Khi điện phân NaCl nóng chảy (điện cực trơ), tại catôt xảy ra
A. sự khử ion Cl-.
B. sự oxi hoá ion Cl-
C. sự oxi hoá ion Na+
D. sự khử ion Na+
Câu 30: Nhúng một lá sắt vào dung dịch CuSO4, sau một thời gian lấy lá sắt ra cân
thấy nặng hơn so với ban đầu 0,2 gam. Khối lượng đồng đã bám vào lá sắt là
A. 0,2 gam
B. 1,6 gam
C. 3,2 gam
D. 4,8 gam
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 5
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Phát biểu nào sau đây là đúng?
A. Mỡ động vật chủ yếu cấu thành từ các gốc axit béo chưa no.
B. Dầu mỡ sau khi rán có thể được dùng để tái chế thành nhiên liệu
C. Chất béo tan tốt trong nước và trong dung dịch axit clohiđric.
D. Hiđro hóa dầu thực vật lỏng thu được mỡ động vật rắn.
Câu 2: Chất X có các đặc điểm sau:
Phân tử có nhiều nhóm -OH, vị ngọt, hòa tan Cu(OH)2 ở nhiệt độ thường, không làm mất màu nước brom. X là
A. glucozơ. B. tinh bột
C. xenlulozơ D. saccarozơ.
Câu 3: Chất nào sau đây thuộc đisaccarit?
A. Tinh bột. B. Fructozơ
C. Saccarozơ. D. Glucozơ.
Câu 4: Dung dịch đường dùng để tiêm hoặc truyền vào tĩnh mạch cho bệnh nhân là
A. glucozơ. B. fructozơ.
C. amilozơ. D. saccarozơ.
Câu 5: Tráng bạc hoàn toàn m gam glucozơ thu được 43,2 gam Ag. Nếu lên men rượu hoàn toàn m gam glucozơ rồi cho toàn bộ khí CO2 tạo thành vào nước vôi trong dư thì lượng kết tủa thu được là
A. 20 gam. B. 40 gam. C. 80 gam. D. 60 gam.
Câu 6: Nhận định nào sau đây là đúng?
A. Các amin đều phản ứng với dung dịch HCl.
B. Các amin đều tan tốt trong nước.
C. Các nguyên tử H của amin đơn chức là số chẵn.
D. Các amin đều làm quỳ tím hóa xanh.
Câu 7: Amin nào sau đây là amin bậc ba?
A. (C6H5)2NH. B. (CH3)2CHNH2.
C. (CH3)3N. D. (CH3)3CNH2.
Câu 8: Ở điều kiện thường, amin X là chất lỏng, dễ bị oxi hoá khi để ngoài không khí. Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng. Amin nào sau đây thoả mãn tính chất của X?
A. đimetylamin B. benzylamin C. metylamin D. anilin
Câu 9: Số nguyên tử oxi trong phân tử axit glutamic là
A. 1. B. 2. C. 3. D. 4.
Câu 10: Phát biểu nào sau đây là đúng?
A. Ở nhiệt độ thường, các amino axit đều là chất lỏng.
B. Axit glutamic là thành phần chính của bột ngọt,
C. Amino axit thuộc loại hợp chất hữu cơ tạp chức.
D. Các amino axit thiên nhiên hầu hết là các -amino axit.
Câu 11: Số đồng phân amino axit có công thức phân tử C3H7NO2 là
A. 3 B. 4 C. 1 D. 2
Câu 12: Peptit Ala-Gly-Val-Ala-Glu có bao nhiêu liên kết peptit?
A. 4 B. 3 C. 2 D. 5
Câu 13: Một loại tơ nilon-6,6 có phân tử khối là 362956 đvC. Số mắt xích có trong loại tơ trên là:
A. 166. B. 1606. C. 83. D. 803.
Câu 14: Loại tơ nào sau đây được đều chế bằng phản ứng trùng ngưng?
A. Tơ visco B. Tơ nitron. C. Tơ nilon–6,6 D. Tơ xenlulozơ axetat
Câu 15: Tơ được sản xuất từ xenlulozơ?
A. to tằm B. tơ capron C. tơ nilon-6,6 D. tơ visco
Câu 16: Cho các polime: polyisopren, tinh bột, xenlulozơ, cao su lưu hóa. Số polime có cấu trúc mạng không gian là
A. 1. B. 2. C. 3. D. 4.
Câu 17: Thủy phân đến cùng protein thu được
A. glucozơ. B. aminoaxit. C. axit béo. D. chất béo.
Câu 18: Cho các chất sau: NH3, CH3CH2NH2, C6H5NH2, H2NCH2COOH. Chất có lực bazơ mạnh nhất là
A. C6H5NH2. B. CH3CH2NH2.
C. H2NCH2COOH. D. NH3.
Câu 19: Liên kết kim loại là liên kết sinh ra do
A. Lực hút tĩnh điện giữa ion dương và ion âm.
B. Các electron tự do trong tinh thể kim loại.
C. Có sự dùng chung các cặp electron.
D. Lực hút Vanđevan giữa các tinh thể kim loại.
Câu 20: Khi hoà tan hoàn toàn 3 gam hỗn hợp hai kim loại nhóm IA trong dung dịch HCl dư thu được 0,672 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được a gam muối khan, giá trị của a là
A. 4,90 gam B. 5,71 gam C. 5,15 gam D. 5,13 gam
Câu 21: Một viên bi sắt có đường kính 2 cm ngập trong một cốc chứa 100 ml axit có pH = 0, phản ứng xảy ra hoàn toàn. Bán kính viên bi sắt sau phản ứng (coi rằng viên bi bị mòn đều từ mọi phía, khối lượng riêng của sắt là 7,8 g/cm3)là:
A. 0,56cm B. 0,84cm C. 0,78cm D. 0,97cm
Câu 22: Trong các kim loại: Al, Mg, Fe và Cu, kim loại có tính khử mạnh nhất là
A. Cu B. Mg C. Fe D. Al
Câu 23: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p63s2. B. 1s22s22p53s2.
C. 1s22s22p43s1. D. 1s22s22p63s1.
Câu 24: Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hóa học là
A. 4 B. 3 C. 1 D. 2
Câu 25: Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 6,72 B. 4,48 C. 2,24 D. 3,36
Câu 26: Khử hoàn toàn 32 gam CuO thành kim loại cần vừa đủ V lít khí CO (đktc). Giá trị của V là
A. 13,44 B. 8,96 C. 4,48 D. 6,72
Câu 27: Thép inoc là tên gọi của hợp kim nào?
A. Fe-Cr-Mn B. Fe-Mg-Cr
C. Fe-Mg-Cu D. Fe-Zn-Cu
Câu 28: Một mẫu kim loại thủy ngân có lẫn tạp chất kẽm, thiếc, chì. Để làm sạch các tạp chất này có thể cho mẫu thủy ngân trên tác dụng với lượng dư của dung dịch nào sau đây ?
A. Hg(NO3)2 B. Zn(NO3)2
C. Sn(NO3)2 D. Pb(NO3)2
Câu 29: Cho 7,35 gam axit glutamic phản ứng với 140 ml dung dịch HCl 1M, thu được dung dịch X. Cho 250 ml dung dịch NaOH 1M vào X, thu được dung dịch Y. Cô cạn dung dịch Y, thu được m gam chất rắn khan. Biết các phản ứng xảy ra hoàn toàn, giá trị của m là
A. 16,64. B. 19,04. C. 17,74. D. 18,14.
Câu 30: Lên men 36 gam glucozơ tạo thành ancol etylic (hiệu suất 90%). Lượng khí sinh ra hấp thụ vào 260 ml dung dịch NaOH 2M thu được dung dịch X. Cô cạn dung dịch X (chỉ có nước bay hơi) thu được m gam muối khan. Giá trị của m là?
A. 55,12 gam. B. 38,16 gam.
C. 33,76 gam. D. 30,24 gam.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1B |
2D |
3C |
4A |
5B |
6A |
7C |
8D |
9D |
10C |
|
11D |
12A |
13B |
14C |
15D |
16A |
17B |
18B |
19B |
20D |
|
21D |
22B |
23D |
24B |
25C |
26B |
27A |
28A |
29D |
30C |
Câu 1:
Đáp án B
A. Sai vì mỡ động vật có thành phần chính là các chất béo no
B. Đúng
C. Sai vì chất béo không tan trong nước
D. Sai vì hiđro hóa dầu thực vật lỏng thu được bơ nhân tạo
Câu 2:
Đáp án D
Hòa tan được Cu(OH)2 → Có nhiều nhóm -OH cạnh nhau → loại B, C
Không làm mất màu Br2 → Không có nhóm -CHO → loại A
Câu 3:
Đáp án C
+ Monosaccarit: flucozơ, glucozơ.
+ Đisaccarit: Saccarozơ, mantozơ.
+ Polisaccarit: Tinh bột, xenlulozơ
Câu 4:
Đáp án A
Glucozơ có thể được cơ thể hấp thụ trực tiếp nên được dùng để tiêm hoặc truyền cho các bệnh nhân
Câu 5:
Đáp án B
Lưu ý: Nhớ được tỉ lệ của các phản ứng:
Glu → 2Ag
Glu → 2CO2
nAg = 43,2 : 108 = 0,4 mol
Glu → 2Ag
→ nAg = 2nGlu
Glu → 2CO2
→ nCO2 = 2nGlu
→ nCO2 = nAg = 0,4 mol
Sục CO2 vào nước vôi trong dư → nCaCO3= nCO2 = 0,4 mol
→ mCaCO3 = 40 gam
Câu 6:
Đáp án A
A. Đúng. Các amin đều phản ứng với dung dịch HCl.
B. Sai vì có một số amin thơn khó tan trong nước như anilin
C. Sai vì số H của amin đơn chức là số lẻ.
D. Sai vì có một số amin không làm quỳ tím chuyển màu như anilin
Câu 7:
Đáp án C
Lưu ý: Bậc của amin là số gốc hiđrocacbon liên kết với nguyên tử N
A. (C6H5)2NH là amin bậc 2
B. (CH3)2CHNH2 là amin bậc 1
C. (CH3)3N là amin bậc 3
D. (CH3)3CNH2 là amin bậc 1
Câu 8:
Đáp án D
X là chất lỏng → A, C sai.
Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng → X là anilin
Câu 9:
Đáp án D
Số nguyên tử oxi trong phân tử axit glutamic là 4.
Axit glutamic là C5H9NO4, có cấu tạo: HOOC – CH2 – CH2 − CH(NH2) – COOH.
Câu 10:
Đáp án C
A sai vì ở nhiệt độ thường, các amino axit ở thể rắn.
B sai vì thành phần chính của bột ngọt là muối mononatri của axit glutamic.
C đúng.
D sai các amino axit thiên nhiên hầu hết là các -amino axit.
Câu 11:
Đáp án D
C3H7NO2 là amino axit no, mạch hở có 1 nhóm NH2 và 1 nhóm COOH
→ Các đồng phân là
H2N-CH2-CH2-COOH
CH3-CH(NH2)COOH
Câu 12:
Đáp án A
Peptit trên tạo bởi 5 gốc amino axit → Số liên kết peptit là 4.
Câu 13:
Đáp án B
Tơ nilon-6,6 là: [-OC-(CH2)4-CO-HN-(CH2)6-NH-]n (M = 226n).
→ số mắt xích trong loại tơ trên = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93040.png) = 1606
= 1606
Câu 14:
Đáp án C
Vì tơ nilon -6,6 được điều chế bằng cách trùng ngưng hexametylenđiamin và axit ađipic:
nH2N (CH2 )6 NH2 + nHOOC(CH2)4 COOH![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93042.png)
[-HN(CH2 )6 NH-OC(CH2 )4 CO - ]n + 2nH2O
Câu 15:
Đáp án D
Các loại tơ có nguồn gốc từ xenlulozơ là tơ visco và tơ axetat.
Câu 16:
Đáp án A
Chỉ có cao su lưu hóa có cấu trúc mạng không gian
Câu 17:
Đáp án B
Protein được tạo từ các amino axit do đó thủy phân đến cùng protein thu được các amino axit
Câu 18:
Đáp án B
Lưu ý: Những gốc đẩy e làm tăng mật độ điện tích âm trên nguyên tử N → tăng khả năng hút H+ → tăng tính bazơ của amin
Vậy CH3CH2NH2 có tính bazơ mạnh nhất
Câu 19:
Đáp án B
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
Câu 20:
Đáp án D
Bào toàn nguyên tố H:
nHCl = 2. nH2
→ nCl- = nHCl = 0,06 mol
Áp dụng định luật bảo toàn khối lượng:
m muối = m KL + mCl- = 3+ 0,06.35,5 = 5,13g
Câu 21:
Đáp án D
Số mol H+ là 0,1 mol
Fe + 2H+ Fe2+ + H2
Mol 0,05 0,1
Khối lượng sắt bị tan là: 2,8 gam
Vậy thể tích sắt bị mất đi : V = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93055.png) =
=![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93056.png) = 0,36 cm3
= 0,36 cm3
Thể tích ban đầu của viên bi: V1 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93064.png) π.r3 =
π.r3 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93075.png) 3,14.13= 4,19 cm3
3,14.13= 4,19 cm3
Vậy thể tích của viên bi sắt còn lại sau phản ứng là: V2 = V1 – V = 4,19 – 0,36 = 3,83 cm3
Bán kính viên bi còn lại: r = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93086.png) =
= ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93091.png) = 0,97 cm
= 0,97 cm
Câu 22:
Đáp án B
Trong dãy hoạt động hóa học của kim loại, đi từ trái sang phải tính khử của kim loại giảm dần.
Dãy hoạt động hóa học của kim loại
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
→ Mg có tính khử mạnh nhất.
Câu 23:
Đáp án D
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là: 1s22s22p63s1
Câu 24:
Đáp án B.
Fe + 2FeCl3 → 3FeCl2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
→ Có 3 trường hợp xảy ra phản ứng hóa học.
Câu 25:
Đáp án C
nFe = 0,1 mol
Áp dụng định luật bảo toàn electron
n e nhường = n e nhận
→ nFe. hóa trị = Số e nhận. nNO
→ 0,1.3 = 3.nNO
→ nNO = 0,1 mol
→ VNO = 0,1.22,4 = 2,24 lít
Câu 26:
Đáp án B
nCuO = 0,4 mol
nCO phản ứng = nO trong oxit = 0,4 mol
→ V = 0,4.22,4 = 8,96 lít
Câu 27:
Đáp án A
Thép inoc là hợp kim Fe-Cr-Mn. Hợp kim này không bị ăn mòn
Câu 28:
Đáp án A
Khi cho mẫu thuỷ ngân lẫn các tạp chất kém, thiếc, chì phản ứng với Hg(NO3)2 dư sẽ xảy ra các phản ứng:
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Sn + Hg(NO3)2 → Sn(NO3)2 + Hg
Pb + Hg(NO3)2 → Pb(NO3)2 + Hg
Vậy toàn bộ các tạp chất được loại bỏ khỏi Hg
Câu 29:
Đáp án D
nglutamic = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93129.png) = 0,05 mol
= 0,05 mol
nHCL = 0,14 mol
nNaOH = 0,25 mol > 2nglutamic + nHCL
Chất rắn khan bao gồm muối của axit glutamic, NaCl, NaOH dư
nH2O = 2nglutamic + 2nHCL = 0,24 mol
Áp dụng định luật bảo toàn khối lượng ta có:
m = mglutamic + mHCL + mNaOH - mH2O
→ = 18,14 gam
Câu 30:
Đáp án C
C6H12O6![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93134.png) 2CO2 + 2C2H5OH
2CO2 + 2C2H5OH
nglucozo = = 0,2 mol
→ nCO2 = 2 . 0,2 . 90% = 0,36 mol
nNaOH = 0,26 . 2 = 0,52 mol
→ ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93146.png) = 1,44 < 2
= 1,44 < 2
→ Tạo hỗn hợp 2 muối NaHCO3 và Na2CO3.
Gọi số mol của 2 muối NaHCO3 và Na2CO3 lần lượt là a, b mol
→![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93149.png)
→![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93153.png)
→ m = 84a + 106b = 33,76 gam
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 6
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Thủy phân tristearin ((C17H35COO)3C3H5) trong dung dịch NaOH, thu được muối có công thức là
A. C2H3COONa. B. HCOONa.
C. C17H33COONa. D. C17H35COONa.
Câu 2: Số nguyên tử oxi trong phân tử glucozơ là
A. 12. B. 6. C. 5. D. 10
Câu 3: Cho 3 chất: Glucozơ, axit axetic, glixerol. Để phân biệt 3 chất trên chỉ cần dùng 2 hoá chất là
A. Dung dịch Na2CO3 và Na.
B. quỳ tím và dung dịch AgNO3/ NH3, đun nóng.
C. Dung dịch NaHCO3 và dung dịch AgNO3.
D. Quỳ tím và Na.
Câu 4: Phản ứng nào không thể hiện tính khử của glucozơ?
A. Phản ứng tráng gương glucozơ.
B. Cho glucozơ cộng H2 (Ni, tº ).
C. Cho glucozơ cháy hoàn toàn trong oxi dư.
D. Cho glucozơ tác dụng với nước brôm.
Câu 5: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 5 giọt dung dịch CuSO4 0,5% vào ống nghiệm sạch.
Bước 2: Thêm 1 ml dung dịch NaOH 10% vào ống nghiệm, lắc đều; gạn phần dung dịch, giữ lại kết tủa.
Bước 3: Thêm tiếp 2 ml dung dịch glucozơ 1% vào ống nghiệm, lắc đều.
Phát biểu nào sau đây sai?
A. Sau bước 3, kết tủa đã bị hòa tan, thu được dung dịch màu xanh lam.
B. Ở bước 2, trong ống nghiệm xuất hiện kết tủa màu xanh.
C. Ở bước 3, glucozơ bị oxi hóa thành axit gluconic.
D. Thí nghiệm trên chứng minh glucozơ có nhiều nhóm OH liền kề nhau.
Câu 6: Cho 50 ml dung dịch glucozơ chưa rõ nồng độ tác dụng với một lượng dư dung dịch AgNO3/NH3, đun nóng thu được 2,16 gam bạc kết tủa. Nồng độ mol của dung dịch glucozơ đã dùng là
A. 0,20M. B. 0,01M. C. 0,02M. D. 0,10 M.
Câu 7: Polime nào sau đây thuộc loại polime bán tổng hợp?
A. Tơ visco. B. Poli(vinyl clorua).
C. Polietilen. D. Xenlulozơ.
Câu 8: Polime nào sau đây được điều chế bằng phản ứng trùng ngưng?
A. Polipropilen. B. Poli(hexametylen- ađipamit).
C. Poli(metyl metacrylat). D. Polietilen.
Câu 9: Dãy nào sau đây gồm các chất đều có khả năng tham gia phản ứng trùng hợp?
A. etan, etilen, toluen
B. propilen, stiren, vinyl clorua
C. propan, etilen, stiren
D. stiren, clobenzen, isopren
Câu 10: Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
A. 1s22s22p63s2. B. 1s22s22p53s2.
C. 1s22s22p43s1. D. 1s22s22p63s1.
Câu 11: Kết luận nào sau đây sai?
A. Các nguyên tố nhóm A có cấu hình e lớp ngoài cùng ns2 đều là các kim loại.
B. Nguyên tố có Z = 19 có bán kính lớn hơn nguyên tố có Z = 11
C. Li là kim loại có độ âm điện lớn nhất trong số các kim loại kiềm
D. Các nguyên tố nhóm B đều là kim loại
Câu 12: Tính chất nào sau đây không phải tính chất vật lí chung của kim loại?
A. Dẫn nhiệt B. Cứng C. Dẫn điện D. Ánh kim
Câu 13: Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, Cu(NO3)2, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hóa học là
A. 4 B. 3 C. 1 D. 2
Câu 14: Một học sinh tiến hành thí nghiệm: Nhúng một thanh đồng vào dung dịch AgNO3, sau một lúc nhúng tiếp một thanh sắt vào dung dịch này đến phản ứng hoàn toàn. Sau khi thí nghiệm kết thúc, học sinh đó rút ra các kết luận sau :
(I) Dung dịch thu được sau phản ứng có màu xanh nhạt.
(II) Khối lượng thanh đồng bị giảm sau phản ứng.
(III) Khối lượng thanh sắt tăng lên sau phản ứng.
Kết luận không đúng là
A. (I). B. (II). C. (III). D. (I) (II) và (III)
Câu 15: Có các phát biểu sau:
(1) Hợp kim thép (Fe-C) ít bị ăn mòn hơn sắt.
(2) Hợp kim Al-Cu-Mn-Mg nhẹ và cứng, dùng trong chế tạo tên lửa, tàu vũ trụ.
(3) Hợp kim vàng tây (Au-Ag-Cu) cứng hơn vàng nguyên chất.
(4) Hợp kim Bi-Pb-Sn có nhiệt độ nóng chảy rất cao.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 16: Phát biểu nào sau đây đúng?
A. Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác
B. Không có tính dẫn điện, dẫn nhiệt, tính dẻo và ánh kim
C. Hay bị gỉ, mềm, chịu nhiệt tốt, chịu ma sát tốt
D. Hợp kim là vật liệu kim loại có chứa hai kim loại cơ bản
Câu 17: Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
A. Kim loại sắt trong dung dịch HNO3 loãng.
B. Thép cacbon để trong không khí ẩm.
C. Đốt dây sắt trong khí oxi khô.
D. Kim loại kẽm trong dung dịch HCl.
Câu 18: Ngâm một lá Zn vào dung dịch HCl thấy bọt khí thoát ra ít và chậm. Nếu nhỏ thêm vài giọt dung dịch X thì thấy bọt khí thoát ra rất nhiều và nhanh. Chất tan trong dung dịch X là chất nào sau đây ?
A. H2SO4 B. MgSO4 C. NaOH D. CuSO4
Câu 19: Khi điều chế kim loại, các ion kim loại đóng vai trò là chất
A. khử B. cho proton C. bị khử D. nhận proton
Câu 20: Để điều chế Al kim loại ta có thể dùng phương pháp nào trong các phương pháp sau đây?
A. Dùng Zn đẩy AlCl3 ra khỏi muối
B. Dùng CO khử Al2O3
C. Điện phân nóng chảy Al2O3
D. Điện phân dung dịch AlCl3
Câu 21: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Glyxin. B. Metylamin. C. Anilin. D. Glucozơ.
Câu 22: Ở điều kiện thường, amin X là chất lỏng, dễ bị oxi hoá khi để ngoài không khí. Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng. Amin nào sau đây thoả mãn tính chất của X?
A. đimetylamin
B. benzylamin
C. metylamin
D. anilin
Câu 23: Cho 5,9 gam amin đơn chức X tác dụng vừa đủ với dung dịch HC1, tạo ra 9,55 gam muối, số công thức cấu tạo ứng với công thức phân tử của X là
A. 5. B. 4. C. 3. D. 2.
Câu 24: Số nguyên tử oxi trong phân tử axit glutamic là
A. 1. B. 2. C. 3. D. 4.
Câu 25: Hỗn hợp X gồm glyxin, alanin và axit glutamic. Trong X, nguyên tố oxi chiếm 40% về khối lượng. Cho m gam X tác dụng hoàn toàn với dung dịch NaOH, tạo ra 8,16 gam muối. Giá trị của m là
A. 7,2. B. 4.8. C. 5.6. D. 6,4
Câu 26: Chất có phản ứng màu biure là
A. saccarozơ B. anbumin (protein)
C. tinh bột D. chất béo
Câu 27: Khi nấu canh cua thì thấy các mảng “riêu cua” nỗi lên là do
A. phản ứng thủy phân của protein.
B. phản ứng màu của protein,
C. sự đông tụ của lipit.
D. sự đông tụ của protein do nhiệt độ.
Câu 28: Cho một pentapeptit (A) thỏa điều kiện: Khi thủy phân hoàn toàn 1 mol A thì thu được các α- amino axit gồm: 3 mol glyxin, 1 mol alanin, 1 mol valin. Mặt khác khi thủy phân không hoàn toàn peptit A, ngoài thu được các α- amino axit thì còn thu được 2 đipeptit là Ala-Gly; Gly-Ala và 1 tripeptit là Gly- Gly-Val. Công thức cấu tạo của A là
A. Ala-Gly-Gly-Gly-Val. B. Gly-Ala-Gly-Gly-Val.
C. Gly-Gly-Ala-Gly-Val. D. Gly-Ala-Gly-Val-Gly.
Câu 29: Nhóm kim loại không tác dụng được với dung dịch HNO3 đặc nguội là
A. Fe, Cr, Al. B. Cr, Pb, Mn.
C. Al, Ag, Pb. D. Ag, Pt, Au.
Câu 30: Cho 0,1 mol phenyl axetat tác dụng hết với 300 ml dung dịch NaOH 1M. Kết thúc phản ứng, cô cạn dung dịch thì khối lượng chất rắn khan thu được là
A. 16,2 gam. B. 22,0 gam. C. 19,8 gam. D. 23,8 gam.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1D |
2B |
3B |
4B |
5C |
6A |
7A |
8B |
9B |
10D |
|
11A |
12B |
13B |
14B |
15B |
16A |
17B |
18D |
19C |
20C |
|
21B |
22D |
23B |
24D |
25D |
26B |
27D |
28B |
29A |
30D |
Câu 1:
Đáp án D
(C17H35COO)3C3H5 + 3NaOH ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93206.png) 3C17H35COONa + C3H5(OH)3
3C17H35COONa + C3H5(OH)3
Câu 2:
Đáp án B
Công thức phân tử của glucozơ là C6H12O6.
→ Số nguyên tử oxi trong phân tử glucozơ là 6
Câu 3:
Đáp án B
- Thuốc thử là quỳ tím
+ Làm quỳ tím hóa đỏ: axit axetic
+ Không làm quỳ tím đổi màu: glucozơ và glixerol
- Thuốc thử là AgNO3/NH3
+ Xuất hiện kết tủa sáng trắng bám vào thành ống nghiệm: glucozơ
CH2OH[CHOH]4CHO + 2[Ag(NH3)2]OH![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93207.png) CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O
CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O
+ Không hiện tượng: glixerol
Câu 4:
Đáp án B
Phản ứng cộng H2 (Ni, tº ) của glucozơ là phản ứng thể hiện tính oxi hóa của glucozơ
→ Phản ứng này sinh ra sobitol.
Câu 5:
Đáp án C
Ở bước 3, glucozơ chuyển thành phức đồng-glucozơ
Câu 6:
Đáp án A
nAg = 0,02 mol => nglucozo =![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93208.png) nAg = 0,01 mol
nAg = 0,01 mol
CM(glucozo) =![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93209.png) = 0,2M
= 0,2M
Câu 7:
Đáp án A
Các loại polime bán tổng hợp: Tơ visco và tơ xenlulozơ axetat
Câu 8:
Đáp án B
A, C, D là polime được điều chế bằng phản ứng trùng ngưng
B là polime được điều chế bằng phản ứng trùng hợp
Câu 9:
Đáp án B
Chất có liên kết bội hoặc vòng kém bền thì có khả năng tham gia phản ứng trùng hợp.
A loại vì có toluen
B thỏa mãn
C loại vì propan chỉ chứa liên kết đơn bền.
D loại vì clobenzen không tham gia phản ứng trùng hợp.
Câu 10:
Đáp án D
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là: 1s22s22p63s1
Câu 11:
Đáp án A
A. Sai. Vì He có cấu hình e lớp ngoài cùng là 1s2 và là khí hiếm
Câu 12:
Đáp án B.
4 tính chất vật lí chung của kim loại là: Tính dẻo, tính dẫn điện, tính dẫn nhiêt, tính ánh kim.
Câu 13:
Đáp án B.
Fe + 2FeCl3 → 3FeCl2
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
→ Có 3 trường hợp xảy ra phản ứng hóa học.
Câu 14:
Đáp án B
(I) Đúng. Sau phản ứng, dung dịch có màu xanh nhạt của ion Fe2+
(II) Sai. Vì
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Gọi số mol Cu phản ứng là x mol
→Δm = 108.2x – 64x = 152x > 0
→ Khối lượng thanh đồng tăng lên sau phản ứng
(III) Đúng. Vì
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Gọi số mol Fe phản ứng là y mol
→Δm = 64y - 56y = 8y > 0
→ Khối lượng thanh sắt tăng lên sau phản ứng
→ Kết luận (II) không đúng.
Câu 15:
Đáp án B
(1) Sai vì hợp kim thép (Fe-C) bị ăn mòn nhanh hơn sắt.
(2) Đúng
(3) Đúng
(4) Sai vì hợp kim Bi-Pb-Sn có nhiệt độ nóng chảy thấp, ở khoảng 65oC.
→ Các phát biểu đúng : (2) và (3)
Câu 16:
Đáp án A
Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác
Câu 17:
Đáp án B
Thép cacbon để trong không khí ẩm bị ăn mòn điện hóa
Tại anot (-) Fe → Fe2+ + 2e
Tại catot (+) O2 + 2H2O + 4e → 4OH-
Các đáp án còn lại kim loại bị ăn mòn hóa học.
Câu 18:
Đáp án D
Ban đầu xảy ra ăn mòn hóa học:
Zn + 2HCl → ZnCl2 + H2
Nhỏ thêm dung dịch X là CuSO4 thỏa mãn điều kiện xảy ra ăn mòn điện hóa với hai điện cực là Zn và Cu, dung dịch chất điện li là CuSO4
Zn + CuSO4 → ZnSO4 + Cu
Thanh kẽm bị ăn mòn nhanh hơn.
Câu 19:
Đáp án C
Điều chế kim loại là quá trình khử ion kim loại thành kim loại
Rn+ + ne → R
Ion kim loại Rn+ đóng vai trò là chất oxi hóa (chất bị khử)
Câu 20:
Đáp án C
Kim loại nhôm chỉ được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
2Al2O3 ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93210.png) 4Al + 3O2
4Al + 3O2
Câu 21:
Đáp án B
Dung dịch metylamin (CH3NH2) làm quỳ tím chuyển sang màu xanh vì có chứa nhiều
CH3NH2 + H2O ⇌ CH3NH+3 + OH-
Câu 22:
Đáp án D
X là chất lỏng → A, C sai.
Dung dịch X không làm đổi màu quỳ tím nhưng tác dụng với nước brom tạo kết tủa trắng → X là anilin
Câu 23:
Đáp án B
Gọi công thức của amin là RNH2
Phương trình:
RNH2 + HCL → RNH3CL
R + 16 R + 52,5
5,9 9,55
→![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93213.png)
→ R = 43(C3H7-)
Câu 24:
Đáp án D
Số nguyên tử oxi trong phân tử axit glutamic là 4.
Axit glutamic là C5H9NO4, có cấu tạo: HOOC – CH2 – CH2 − CH(NH2) – COOH.
Câu 25:
Đáp án D
nO(X) = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93214.png) = 0,025 m ( mol)
= 0,025 m ( mol)
→ n-COOH(X) = 0,0125m (mol)
Áp dụng tăng giảm khối lượng ta có:
mmuối = mX + 22n-COOH (X)
→ 8,16 = m + 22.0,0125m
→ m = 6,4 gam
Câu 26:
Đáp án B
Từ tripeptit trở lên và protein có phản ứng màu biure.
Câu 27:
Đáp án D
Khi nấu canh cua thì thấy các mảng “riêu cua” nỗi lên là do sự đông tụ của protein khi đun nóng.
Câu 28:
Đáp án B
Số lượng gốc Gly trong A là ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93215.png) = 3
= 3
Số lượng gốc Ala trong A là ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93216.png) = 1
= 1
Số lượng gốc Val trong A là ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-93217.jpeg) = 1
= 1
Thủy phân không hoàn toàn peptit A thu được Ala-Gly; Gly-Ala; Gly- Gly-Val
→ peptit A là Gly-Ala-Gly-Gly-Val
Câu 29:
Đáp án A
Một số kim loại như Fe, Cr, Al thụ động trong HNO3 đặc nguội và H2SO4 đặc nguội
Câu 30:
Đáp án D
nNaOH = 0,3 mol
neste = nH2O = 0,1 mol
Áp dụng định luật bảo toàn khối lượng:
meste + mNaOH = m rắn +mH2O
136.0,1 + 40.0,3 = m rắn + 18.0,1
→ m rắn = 23,8 gam
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 7
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Este có mùi dứa là
A. isoamyl axetat. B. etyl butirat.
C. etyl axetat. D. geranyl axctat.
Câu 2: Trong chế tạo ruột phích người ta thường dùng phương pháp nào sau đây:
A. Cho axetilen tác dụng với dung dịch AgNO3/NH3
B. Cho anđehit fomic tác dụng với dung dịch AgNO3/NH3
C. Cho axit fomic tác dụng với dung dịch AgNO3/NH3
D. Cho glucozơ tác dụng với dung dịch AgNO3/NH3, đun nóng.
Câu 3: Khi bị ốm, mất sức hoặc sau các ca phẫu thuật, nhiều người bệnh thường được truyền dịch “đạm” để cơ thể sớm hồi phục. Chất trong dịch truyền có tác dụng trên là
A. glucozơ. B. saccarozơ. C. amino axit. D. amin.
Câu 4: Từ 81 gam tinh bột, bằng phương pháp lên men rượu, thu được a gam etanol (hiệu suất 80%). Oxi hóa 0,1a gam etanol bằng phương pháp lên men giấm với hiệu suất H% thu được hỗn hợp X. Để trung hòa hỗn hợp X cần vừa đủ 60 ml dung dịch NaOH 1M. Giá trị của H là
A. 80 B. 75 C. 45 D. 60
Câu 5: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Glyxin. B. Metylamin. C. Anilin. D. Glucozơ.
Câu 6: Dung dịch chất nào sau đây không làm đổi màu quỳ tím?
A. Glyxin. B. Lysin. C. Metylamin. D. Axit glutamic.
Câu 7: Có thể phân biệt dung dịch chứa glyxin, lysin, axit glutamic bằng?
A. Nước B. NaOH C. HCl D. Quỳ tím
Câu 8: Phân tử polime nào sau đây có chứa nitơ?
A. Polietilen. B. Poli(vinyl clorua).
C. Poli(metyl metacrylat). D. Poliacrilonitrin.
Câu 9: Phát biểu nào sau đây đúng?
A. Tơ poliamit rất bền trong môi trường axit.
B. Tơ xenlulozơ axetat thuộc loại tơ bán tổng hợp.
C. Polietilen được điều chế bằng phản ứng trùng ngưng etilen.
D. Cao su lưu hóa có tính đàn hồi kém hơn cao su thường.
Câu 10: Cho các phát biểu sau:
(1) Poliacrilonitrin là vật liệu polime có tính dẻo.
(2) Tripanmitin có nhiệt độ nóng chảy cao hơn triolein.
(3) Hàm lượng cacbon trong amilopectin nhiều hơn trong xenlulozơ.
(4) Ở điều kiện thường, alanin là chất lỏng, không màu, rất độc và ít tan trong nước.
(5) Đun nóng các protein đơn giản trong môi trường kiềm, thu được các a-amino axit.
(6) Trùng ngưng caprolactam thu được tơ nilon-6.
(7) Trùng hợp isopren thu được cao su thiên nhiên.
(8) Theo nguồn gốc, người ta chia polime thành hai loại: polime trùng hợp và polime trùng ngưng.
(9) Đa số các polime không tan trong các dung môi thông thường.
(10) Điều kiện để monome tham gia phản ứng trùng hợp là phân tử phải có nhiều nhóm chức.
Số phát biểu sai là:
A. 8 B. 9 C. 7 D. 10
Câu 11: Chất nào sau đây là tripeptit?
A. Gly-Gly. B. Gly-Ala. C. Ala-Ala-Gly. D. Ala-Gly.
Câu 12: Chất nào dưới đây tạo phức màu tím với Cu(OH)2?
A. Gly-Val B. Glucozơ C. Ala-Gly-Val D. metylamin
Câu 13: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A. Axit glutamic. B. Alanin. C. Glyxin. D. Metylamin.
Câu 14: Cho dãy các chất: C6H5NH2 (1), C2H5NH2 (2), (C6H5)2NH (3), (C2H5)2NH (4), NH3 (5). Dãy các chất sắp xếp theo thứ tự lực bazơ giảm dần là
A. (4), (1), (5), (2), (3). B. (3), (1), (5), (2), (4).
C. (4), (2), (3), (1), (5). D. (4), (2), (5), (1), (3).
Câu 15: Đốt cháy hoàn toàn m gam amin X (no, đơn chức, mạch hở) thu được CO2, H2O và 2,24 lít khí N2. Cho m gam X tác dụng hết với dung dịch HCl dư, số mol HCl đã phản ứng là
A. 0,1 mol. B. 0,2 mol. C. 0,3 mol. D. 0,4 mol.
Câu 16: Cho 4,5 gam glyxin tác dụng với dung dịch NaOH vừa đủ, cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 6,66. B. 5,55. C. 4,85. D. 5,82.
Câu 17: Cho 24,25 gam muối H2NCH2COONa tác dụng hoàn toàn với dung dịch HCl (dư), thu được dung dịch X. Cô cạn toàn bộ dung dịch X, thu được m gam muối khan. Giá trị của m là
A. 33,38. B. 16,73. C. 42,50. D. 13,12.
Câu 18: Loại tơ nào sau đây được đều chế bằng phản ứng trùng ngưng?
A. Tơ visco B. Tơ nitron.
C. Tơ nilon–6,6 D. Tơ xenlulozơ axetat
Câu 19: Polime nào sau đây thuộc loại polime tổng hợp?
A. Tinh bột. B. Poli(vinyl clorua).
C. Xenlulozơ. D. Tơ visco.
Câu 20: So với nguyên tử phi kim ở cùng chu kì, nguyên tử kim loại:
A. Thường có bán kính nguyên tử nhỏ hơn
B. Thường có số electron ở các phân lớp ngoài cùng nhiều hơn.
C. Thường dễ nhường electron trong các phản ứng hóa học
D. Thường dễ nhận electron trong các phản ứng hóa học
Câu 21: Hợp kim dẫn điện và dẫn nhiệt kém kim loại nguyên chất vì liên kết hóa học trong hợp kim là?
A. Liên kết kim loại. B. Liên kết ion.
C. Liên kết cộng hóa trị. D. Liên kết ion và cộng hóa trị.
Câu 22: Kim loại Al không tan trong dung dịch
A. HNO3 loãng
B. HCl đặc
C. NaOH đặc
D. HNO3 đặc, nguội
Câu 23: Cặp oxi hóa - khử của kim loại là?
A. Dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại.
B. Dạng oxi hóa và dạng khử của cùng một hợp chất của kim loại.
C. Dạng oxi hóa và dạng khử của các dạng thù hình của một nguyên tố kim loại.
D. Dạng oxi hóa và dạng khử của một cation kim loại và kim loại đó.
Câu 24: Kết luận nào sau đây là sai?
A. Kim loại có nhiệt độ nóng chảy thấp nhất là Hg.
B. Kim loại dẻo nhất là natri.
C. Kim loại dẫn điện tốt nhất là bạc.
D. Kim loại nhẹ nhất là liti.
Câu 25: Trong hợp kim Al-Ni, cứ 10 mol Al thì có 1 mol Ni. Thành phần phần trăm về khối lượng của hợp kim này là
A. 81% Al và 19% Ni B. 82% Al và 18% Ni
C. 83% Al và 17% Ni D. 84% Al và 16% Ni.
Câu 26: Phát biểu nào sau đây sai?
A. Hợp kim có tính dẫn điện
B. Hợp kim có tính dẫn nhiệt
C. Hợp kim có tính dẻo
D. Hợp kim mềm hơn so với các kim loại thành phần
Câu 27: Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất ở đktc). Giá trị của V là
A. 6,72 B. 4,48 C. 2,24 D. 3,36
Câu 28: Lên men dung dịch chứa 300 gam glucozơ thu được 92 gam ancol etylic.
Hiệu suất quá trình lên men tạo thành ancol etylic là
A. 54%. B. 40%. C. 80%. D. 60%.
Câu 29: Cho 0,04 mol amino axit X tác dụng vừa đủ với 400 ml dung dịch HCl 0,1M thu được 7,34 gam muối khan. Mặt khác 0,04 mol X tác dụng vừa đủ với 80 gam dung dịch NaOH 4%. Công thức của X là
A. H2NC3H6COOH. B. H2NC2H3(COOH)2.
C. (H2N)2C3H5COOH. D. H2NC3H5(COOH)2.
Câu 30: Hỗn hợp X gồm axit panmitic, axit stearic và triglixerit Y. Đốt cháy hoàn toàn m gam X, thu được 1,56 mol CO2 và 1,52 mol H2O. Mặt khác, m gam X tác dụng vừa đủ với 0,09 mol NaOH trong dung dịch, thu được glixerol và dung dịch chỉ chứa a gam hỗn hợp muối natri panmitat, natri stearat. Giá trị của a là
A. 26,40 B. 27,70 C. 25,86 D. 27,30
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1B |
2D |
3A |
4B |
5B |
6A |
7D |
8D |
9B |
10A |
|
11C |
12C |
13D |
14D |
15B |
16D |
17C |
18C |
19B |
20C |
|
21C |
22D |
23A |
24B |
25B |
26D |
27C |
28D |
29D |
30C |
Câu 1:
Đáp án B
Este có mùi dứa là etyl butirat.
Câu 2:
Đáp án D
Để chế tạo ruột phích người ta thường cho glucozơ tác dụng với dung dịch AgNO3/NH3, đun nóng.
CH2OH[CHOH]4CHO + 2[Ag(NH3)2]OH ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94043.png) CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O
CH2OH[CHOH]4COONH4 + 2Ag↓ + 3NH3 + H2O
Câu 3:
Đáp án A
Chất trong dịch truyền là glucozơ.
Câu 4:
Đáp án B
C6H12O6![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94044.png) 2C2H5OH + 2CO2
2C2H5OH + 2CO2
C2H5OH + O2![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94045.jpeg) CH3COOH + H2O
CH3COOH + H2O
CH3COOH + NaOH![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94046.jpeg) CH3COONa + H2O
CH3COONa + H2O
NC6H10O5 = 0,5 mol ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94051.png) nC2H5OH = 0,5.0,8.2 = 0,8 mol
nC2H5OH = 0,5.0,8.2 = 0,8 mol
Tính trong 0,1 a gam etanol
nC2H5OH = 0,08 mol ; nCH3COOH = nNaOH = 0,06 mol
→H =![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94061.png) = 75%
= 75%
Câu 5:
Đáp án B
Dung dịch metylamin (CH3NH2) làm quỳ tím chuyển sang màu xanh vì phân li trong nước tạo thành OH-
CH3NH2 + H2O ⇌ CH3NH3+ + OH-
Câu 6:
Đáp án A
Gly có 1 nhóm COOH và 1 nhóm NH2 nên không làm quỳ tím chuyển màu.
Lysin có 1 nhóm COOH và 2 nhóm NH2 nên làm quỳ tím chuyển màu xanh.
Metylamin làm quỳ tím chuyển màu xanh.
Axit glutamic 2 nhóm COOH và 1 nhóm NH2 nên làm quỳ tím chuyển màu đỏ.
Câu 7:
Đáp án D
Dùng quỳ tím để phân biệt chúng vì:
- Glyxin không làm đổi màu quỳ tím
- Lysin làm quỳ chuyển xanh
- Axit glutamic làm quỳ chuyển hồng
Câu 8:
Đáp án D
Phân tử poliacrilonitrin [−CH2 – CH(CN)−]n có chứa nitơ.
Câu 9:
Đáp án B
A sai vì tơ poliamit kém bền trong môi trường axit
C sai vì polietilen được điều chế bằng phản ứng trùng hợp etilen.
D sai vì cao su lưu hóa có tính đàn hồi tốt hơn cao su thường
Câu 10:
Đáp án A
1-sai do poliacrilonitrin là tơ tổng hợp.
2-đúng.
3-sai do công thức phân tử đều có dạng (C6H10O5)n.
4-sai do alanin là chất rắn không màu, ngọt và tan nhiều trong nước.
5-sai do thu được muối.
6-sai do đây là trùng hợp.
7-sai, cao su thiên nhiên được tạo bởi các gốc isopren nhưng trùng hợp isopren thu được cao su tổng hợp isopren.
8-sai, theo nguồn gốc chia làm 3: nhân tạo, tổng hợp, thiên nhiên.
9-đúng.
10-sai, phải có liên kết bội hoặc vòng kém bền.
Câu 11:
Đáp án C
Tripeptit tạo bởi 3 gốc amino axit
Chất trong các đáp án A, B, D đều là đipeptit.
Câu 12:
Đáp án C
A sai vì đipeptit không có phản ứng màu biure với Cu(OH)2
B sai vì glucozơ tạo phức màu xanh đặc trưng với Cu(OH)2 ở nhiệt độ thường.
C đúng vì từ tripeptit trở lên đều tạo phức màu tím với Cu(OH)2
D sai vì metylamin không phản ứng với Cu(OH)2
Câu 13:
Đáp án D
Axit glutamic làm quỳ tím chuyển sang màu đỏ.
Alanin và glyxin không làm quỳ tím chuyển màu.
Metylamin làm quỳ tím chuyển sang màu xanh.
Câu 14:
Đáp án D
Amin no, mạch hở có tính bazơ mạnh hơn amoniac do gốc ankyl có tác dụng làm tăng tính bazơ.
Amin no, bậc 2 (đính với hai gốc ankyl) có tính bazơ mạnh hơn amin bậc 1.
Amin thơm có nguyên tử N gắn trực tiếp vào vòng benzen. Gốc pheyl làm giảm tính bazơ → amin thơm có lực bazơ rất yếu, yếu hơn amoniac.
Sắp xếp theo thứ tự lực bazơ giảm dần là:
(4) > (2) > (5) > (1) > (3)
Câu 15:
Đáp án B
nN2 = 0,1 mol
→nHCl = nN = 2nN2 = 0,2 mol
Câu 16:
Đáp án D
nm = ngly = 0,06 mol
mm = 0,06.97 = 5,82 gam
Câu 17:
Đáp án C
H2NCH2COONa + 2HCl → ClH3NCH2COOH + NaCl
Muối khan gồm: ClH3NCH2COOH và NaCl
nH2NCH2COONa = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94081.png) = 0,25 mol
= 0,25 mol
→nHCl = 0,25 .2 = 0,5 mol
Bảo toàn khối lượng cho phương trình ta có:
mmuối khan = 24,25 + 0,5.36,5 = 42,5 gam
Câu 18:
Đáp án C
Vì tơ nilon -6,6 được điều chế bằng cách trùng ngưng hexametylenđiamin và axit ađipic: nH2N(CH2)6 NH2 + nHOOC(CH2)4 COOH ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94082.png) [-HN(CH2)6 NH- OC(CH2)4 CO-]n + 2nH2O
[-HN(CH2)6 NH- OC(CH2)4 CO-]n + 2nH2O
Câu 19:
Đáp án B
Tinh bột, xenlulozơ là polime thiên nhiên
Tơ visco là polime bán tổng hợp
Poli(vinyl clorua) là polime tổng hợp
Câu 20:
Đáp án C
Vì trong 1 chu kì, kim loại có độ âm điện nhỏ hơn phi kim → nguyên tử kim loại thường dễ nhường electron trong các phản ứng hóa học.
Câu 21:
Đáp án C
Trong hợp kim ngoài liên kết kim loại còn có liên kết công hóa trị vì vậy mật độ electron tự do trong hợp kim giảm đi rõ rệt. Do đó tính dẫn điện, dẫn nhiệt kém hơn kim loại thành phần.
Lưu ý: Độ cứng của hợp kim thường lớn hơn độ cứng của kim loại thành phần.
Câu 22:
Đáp án D
Al thụ động trong HNO3 đặc, nguội
Câu 23:
Đáp án A
Cặp oxi hóa - khử của kim loại là dạng oxi hóa và dạng khử của cùng một nguyên tố kim loại
Câu 24:
Đáp án B
B. Sai vì kim loại dẻo nhất là vàng
Câu 25:
Đáp án B
Giả sử trong hợp kim Al-Ni, có 10 mol Al → có 1 mol Ni
mhợp kim = 10.27 + 1.58 = 328 (gam)
%mAl = % = 82%
%mNi = 100% - 82% = 18%
Câu 26:
Đáp án D
Hợp kim có tính chất vật lí và tính chất cơ học khác nhiều so với các kim loại thành phần
- Có tính dẫn điện, dẫn nhiệt, tính dẻo và ánh kim do trong hợp kim vẫn có các electron tự do.
- Tuy nhiên tính dẫn điện, dẫn nhiệt của hợp kim giảm so với kim loại thành phần do mật độ eletron tự do trong hợp kim giảm đi rõ rệt.
- Có độ cứng cao hơn so với các kim loại thành phần do có sự thay đổi về cấu tạo mạng tinh thể, thay đổi về thành phần của ion trong mạnh tinh thể.
Câu 27:
Đáp án C
nFe = 0,1 mol
Áp dụng định luật bảo toàn electron
n e nhường = n e nhận
→ nFe. hóa trị = Số e nhận. nNO
→ 0,1.3 = 3.nNO
→ nNO = 0,1 mol
→ VNO = 0,1.22,4 = 2,24 lít
Câu 28:
Đáp án D
C6H12O6![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94088.png) 2C2H5OH +2CO2
2C2H5OH +2CO2
180 92
300gam → ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94092.png) gam
gam
H = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94095.png) = 60%
= 60%
Câu 29:
Đáp án D
Gọi công thức của amino axit X là (H2N)aR(COOH)b
nHCl = 0,04 mol
nNaOH = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94100.png) = 0,08 mol
= 0,08 mol
→ mX = 7,34 – 0,04.36,5 = 5,88 gam
![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94102.png) →X:H2NR(COOH)2
→X:H2NR(COOH)2
Áp dụng bảo toàn khối lượng ta có:
mX + mHCl = mmuối
mX = 7,34 - 0,04 . 36,5 = 5,88 gam
→ 16 + R + 90 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94112.png)
→ R =41
→ R : C3H5
→ Công thức của X là H2NC3H5(COOH)2
Câu 30:
Đáp án C
Gọi số mol của các axit béo no và chất béo là x và y (mol)
Khi cho X tác dụng với NaOH: x + 3y = 0,09 (1)
Khi đốt cháy X:
nCO2 - NH2O = 2y
→ y = 0,02 mol
→ x = 0,03 mol
Bảo toàn nguyên tố O:
nO(X) + 2nO2 = 2nCO2 + nH2O
→ (2x + 6y ) 2nO2 = 2.1,56 + 1,52
→ nO2 = 2,23 mol
Bảo toàn khối lượng ta có: m = mCO2 + mH2O - mO2 = 24,64
Xét X tác dụng với NaOH
nH2O = x = 0,03 mol
nglixerol = y = 0,02 mol
Bảo toàn khối lượng:
a = m + mNaOH - mglixerol - mH2O
→ a= 25,86 gam
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 8
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Công thức của triolein là
A. (C17H33COO)3C3H5. B. (HCOO)3C3H5.
B. (C2H5COO)3C3H5. D. (CH3COO)3C3H5.
Câu 2: Phản ứng nào sau đây chuyển glucozơ và fructozơ thành một sản phẩm duy nhất?
A. Phản ứng với Na B. Phản ứng với dd AgNO3/NH3
C. Phản ứng Cu(OH)2, tº D. Phản ứng với H2/Ni,
Câu 3: Phát biểu nào sau đây là đúng?
A. Saccarozơ làm mất màu nước brom.
B. Xenlulozơ có cấu trúc mạch phân nhánh,
C. Amilopectin có cấu trúc mạch phân nhánh.
D. Glucozơ bị khử bởi dung dịch AgNO3 trong NH3.
Câu 4: Saccarozơ và glucozơ đều có phản ứng
A. cộng H2 (Ni, tº ). B. với Cu(OH)2.
C. thủy phân. D. tráng bạc.
Câu 5: Cho các nhận xét sau:
(1) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau.
(2) Hai đồng phân amino axit của C3H7NO2 tạo ra tối đa 3 đipeptit.
(3) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(4) Thủy phân hoàn toàn tinh bột và xenlulozơ mỗi chất chỉ cho 1 loại monosaccarit duy nhất.
(5) Nồng độ glucozơ trong máu người bình thường khoảng 5%.
(6) Tất cả các dung dịch protein đều có phản ứng màu biure.
(7) Dung dịch lòng trắng trứng có phản ứng màu biure.
Số nhận xét đúng là
A. 5. B. 4. C. 3. D. 6.
Câu 6: Tiến hành lên men m gam tinh bột (hiệu suất toàn quá trình đạt 81%) rồi hấp thụ toàn bộ lượng CO2 sinh ra vào nước vôi trong dư thu được 70 gam kết tủa. Giá trị m là:
A. 90. B. 150. C. 120. D. 70.
Câu 7: Amin là hợp chất khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3
A. bằng một hay nhiều gốc NH2
B. bằng một hay nhiều gốc hiđrocacbon.
C. bằng một hay nhiều gốc Cl.
D. bằng một hay nhiều gốc ankyl.
Câu 8: C6H5NH2 tên gọi là
A. Phenol. B. Metyl amin.
C. Benzyl amin. D. Anilin.
Câu 9: Amino axit là hợp chất hữu cơ trong phân tử có chứa nhóm chức
A. cacboxyl và hiđroxyl. B. hiđroxyl và amino,
C. cacboxyl và amino. D. cacbonyl và amino.
Câu 10: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu hồng?
A. Axit glutamic. B. Glyxin.
C. Alanin. D. Valin.
Câu 11: Một amin đơn chức bậc một có 23,73% nitơ về khối lượng, số đồng phân cấu tạo có thể có của amin này là
A. 2. B. 3. C. 4. D. 1.
Câu 12: Số nhóm amino (–NH2) trong phân tử glyxin là
A. 2. B. 4. C. 3. D. 1.
Câu 13: Thủy phân hoàn toàn 1 mol Gly-Ala trong dung dịch HCl dư. Sau phản ứng cô cạn dung dịch thu được m gam rắn khan. Giá trị của m là
A. 127,5 gam B. 118,5 gam
C. 237,0 gam D. 109,5 gam
Câu 14: Cho 4,5 gam glyxin tác dụng với dung dịch NaOH vừa đủ, cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 6,66. B. 5,55. C. 4,85. D. 5,82.
Câu 15: Kết quả thí nghiệm của các dung dịch X, Y, Z với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Quỳ tím chuyển màu hồng |
|
Y |
Cu(OH)2 trong môi trường NaOH |
Hợp chất màu tím |
|
Z |
Nước brom |
Kết tủa trắng |
X, Y, Z lần lượt là
A. axit glutamic, lòng trắng trứng, anilin.
B. anilin, axit glutamic, lòng trắng trứng.
C. axit glutamic, lòng trắng trứng, alanin.
D. alanin, lòng trắng trứng, anilin.
Câu 16: Phát biểu nào sau đây đúng?
A. Sau khi lưu hóa, tính đàn hồi của cao su giảm đi
B. Tơ nilon-6,6 thuộc loại từ thiên nhiên.
C. Tơ nitron được điều chế bằng phản ứng trùng ngưng.
D. Polietilen là polime được dùng làm chất dẻo.
Câu 17: PVC là chất rắn vô định hình, cách điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa, ... PVC được tổng hợp trực tiếp từ monome nào sau đây?
A. vinyl clorua B. acrilonitrin
C. propilen D. vinyl axetat
Câu 18: Một loại tơ nilon-6,6 có phân tử khối là 362956 đvC. Số mắt xích có trong loại tơ trên là:
A. 166. B. 1606. C. 83. D. 803.
Câu 19: Tơ được sản xuất từ xenlulozơ?
A. to tằm B. tơ capron C. tơ nilon-6,6 D. tơ visco
Câu 20: Trong các loại tơ sau: tơ tằm, tơ visco, tơ nilon-6,6, tơ axetat, tơ capron, tơ enang, những loại tơ nào là tơ tổng hợp?
A. tơ nilon-6,6 và tơ capron.
B. tơ tằm và tơ enang.
C. tơ visco và tơ nilon- 6,6.
D. tơ visco và tơ axetat.
Câu 21: Cho viên kẽm tác dụng với HNO3, sau phản ứng không thấy có khí sinh ra. Tổng hệ số cân bằng của phản ứng là
A. 26 B. 22
C. 24 D. 23
Câu 22: Cho các kim loại sau: Li, Mg, Al, Zn, Fe, Ni. Có bao nhiêu kim loại tác dụng với HCl và Cl2 thu được cùng một muối?
A. 6 B. 3 C. 4 D. 5
Câu 23: Cho các phát biểu sau:
1. Có thể dùng lưu huỳnh để khử độc thủy ngân.
2. Có thể dùng thùng bằng kẽm để vận chuyển HNO3 đặc, nguội.
3. Ngay cả ở nhiệt độ cao, magie không tác dụng với nước.
4. Bạc để lâu trong không khí có thể bị hoá đen do chuyển thành Ag2S.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 24: Cho các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của dạng oxi hóa như sau: Fe2+/Fe; Ni2+/Ni; Cu2+/Cu; Ag+/Ag. Kim loại nào sau đây có tính khử yếu nhất?
A. Cu. B. Fe. C. Ag. D. Ni.
Câu 25: Kim loại Fe phản ứng với dung dịch X (loãng, dư), tạo muối Fe(III). Chất X là
A. HNO3 B. H2SO4 C. HCl D. CuSO4
Câu 26: Có 3 mẫu hợp kim: Cu-Ag ; Cu-Al ; Cu-Zn. Chỉ dùng 1 dung dịch axit thông dụng và 1 dung dịch bazơ thông dụng nào sau đây để phân biệt được 3 mẫu hợp kim trên?
A. HCl và NaOH. B. HNO3 và NH3.
C. H2SO4 và NaOH. D. H2SO4 loãng và NH3
Câu 27: Đốt chày hoàn toàn m gam hỗn hợp E gồm hai este mạch hở X và Y (đều tạo từ axit cacboxylic và ancol, MX < MY < 150), thu được 4,48 lít khí CO2 (đktc). Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được 1 muối và 3,14 gam hỗn hợp ancol Z. Cho toàn bộ Z tác dụng với Na dư, thu được 1,12 lít khí H2 (đktc). Phần trăm khối lượng của X trong E là
A. 29,63%. B. 62,28%. C. 40,40%. D. 30,30%.
Câu 28: Cho a mol lysin vào 250 ml dung dịch NaOH 1M, thu được dung dịch X. Cho dung dịch HCl dư vào X, sau khi các phản ứng xảy ra hoàn toàn thấy số mol HCl phản ứng là 0,65 mol. Giá trị của a là:
A. 0,80. B. 0,40. C. 0,20. D. 0,325.
Câu 29: Ngâm một lá Zn trong dung dịch hòa tan 1,6 gam CuSO4. Phản ứng xong thấy khối lượng lá Zn giảm 0,05%. Khối lượng Zn trước khi tham gia phản ứng là
A. 10 g. B. 13 g. C. 20 g. D. 6,5 g.
Câu 30: Nung một mẫu gang có khối lượng 10 gam trong khí O2 dư thấy sinh ra 0,448 lít CO2 (đktc). Thành phần phẩn trăm khối lượng cacbon trong mẫu gang là
A. 4,8%. B. 2,2%. C. 2,4%. D. 3,6%.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1A |
2D |
3C |
4B |
5B |
6D |
7B |
8D |
9C |
10A |
|
11A |
12D |
13C |
14D |
15A |
16D |
17A |
18B |
19D |
20A |
|
21B |
22D |
23B |
24C |
25A |
26D |
27C |
28C |
29C |
30C |
Câu 1:
Đáp án A
Công thức của triolein là (C17H33COO)3C3H5.
Câu 2:
Đáp án D
Glucozơ và fructozơ khi đun nóng với H2 (xúc tác Ni) thì cùng thu được sản phẩm là sobitol.
Câu 3:
Đáp án C
Amilopectin có cấu trúc mạch phân nhánh.
Câu 4:
Đáp án B
Saccarozơ và glucozơ đều có phản ứng với Cu(OH)2 tạo dung dịch màu xanh lam.
Câu 5:
Đáp án B
(1) sai vì tinh bột và xenlulozơ không phải là đồng phân cấu tạo của nhau.
(2) sai vì peptit tạo bởi -amino axit → Chỉ có 1 peptit là Ala-Ala.
(5) sai vì nồng độ glucozơ trong máu người bình thường khoảng 0,1%.
Câu 6:
Đáp án D
nCO2 = n↓ = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94346.png) = 0,7 mol
= 0,7 mol
Khối lượng tinh bột cần dùng là:
m = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94353.png) = 70gam
= 70gam
Câu 7:
Đáp án B
Khái niệm amin: Khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin.
Câu 8:
Đáp án D
C6H5NH2 có tên gọi là anilin.
Câu 9:
Đáp án C
Amino axit là hợp chất hữu cơ trong phân tử có chứa đồng thời nhóm chức amino (-NH2) và cacboxyl (-COOH).
Câu 10:
Đáp án A
Axit glutamic có 2 nhóm -COOH và 1 nhóm -NH2 nên sẽ làm qùy chuyển sang màu hồng.
Câu 11:
Đáp án A
Gọi công thức của amin đơn chức bậc 1 có công thức dạng RNH2
→ ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94355.png) = 0,2373
= 0,2373
→ R = 43(C3H7-)
→ Công thức phân tử của amin là C3H9N
Số đồng phân amin bậc I là:
CH3CH2CH2-NH2
(CH3)2CH-NH2
Câu 12:
Đáp án D
Công thức cấu tạo của glyxin là H2N-CH2-COOH.
Câu 13:
Đáp án C
Chất rắn khan gồm ClH3N-CH2-COOH (1 mol) và CH3-CH(NH3Cl)-COOH (1 mol)
→ m = 1.111,5 +1.125,5 = 237 gam
Câu 14:
Đáp án D
nm = ngly = 0,06 mol
→ mm = 0,06.97 = 5,82 gam
Câu 15:
Đáp án A
- X làm quỳ tím chuyển sang màu hồng → X là axit glutamic.
- Y tác dụng với Cu(OH)2/NaOH sinh ra hợp chất màu tím → Y là protein hoặc từ tripeptit trở lên → Y là lòng trắng trứng.
- Z tác dụng với nước brom sinh ra kết tủa màu trắng → Z có thể là anilin hoặc phenol → Theo đáp án, Y là anilin.
Câu 16:
Đáp án D
A. sai vì cao su lưu hóa có tính đàn hồi tốt hơn cao su thường
B. sai vì tơ nilon-6,6 thuộc loại tơ tổng hợp
C. sai vì tơ nitron được điều chế bằng phản ứng trùng hợp
Câu 17:
Đáp án A
PVC là poli(vinyl clorua) → monome là vinyl clorua.
Câu 18:
Đáp án B
Tơ nilon-6,6 là: [-OC-(CH2)4-CO-HN-(CH2)6-NH-]n (M = 226n).
→ Số mắt xích trong loại tơ trên = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94365.png) = 1606
= 1606
Câu 19:
Đáp án D
Các loại tơ có nguồn gốc từ xenlulozơ là tơ visco và tơ axetat.
Câu 20:
Đáp án A
- Tơ thiên nhiên: tơ tằm.
- Tơ tổng hợp : tơ nilion-6,6; tơ capron, tơ enang.
- Tơ bán tổng hợp: tơ visco, tơ axetat.
Câu 21:
Đáp án B
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
Tổng hệ số cân bằng của phản ứng là: 4 + 10 + 4 + 1 + 3 = 22
Câu 22:
Đáp án D
Các kim loại tác dụng với HCl và Cl2 cho cùng một muối là: Li; Mg; Al; Zn; Ni.
Sắt là kim loại có nhiều hóa trị. Khi phản ứng với HCl cho muối sắt(II), khi phản ứng với Cl2 cho muối sắt(III)
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94366.png) 2FeCl3
2FeCl3
Câu 23:
Đáp án B
1. Đúng. Thủy ngân có thể phản ứng với lưu huỳnh ở nhiệt độ thường
Hg + S → HgS
2. Sai. Chỉ có Fe, Al, Cr thụ động trong HNO3 đặc, nguội. Zn vẫn có khả năng tan trong dung dịch HNO3 đặc, nguội.
3. Sai. Magie có thể khử nước ở nhiệt độ cao
Mg + H2O ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94367.png) MgO + H2
MgO + H2
4. Đúng. Bạc tiếp xúc với không khí có H2S bị biến đổi thành Ag2S có màu đen
4Ag + 2H2S + O2 → 2Ag2S + 2H2O
→ có hai phát biểu đúng là 1,4
Câu 24:
Đáp án C
Chiều của dãy điện hóa đi từ trái sang phải là chiều tăng dần về tính oxi hóa của các chất oxi hóa trong các cặp oxi hóa – khử và là chiều giảm dần về tính khử của các chất khử trong các cặp oxi hóa khử.
Trong dãy trên Ag+ có tính oxi hóa mạnh nhất → Ag có tính khử yếu nhất
Câu 25:
Đáp án A
Dung dịch HNO3 có tính oxi hóa mạnh nên nó có thể oxi hóa được hầu hết các kim loại (trừ Au, Pt) lên số oxi hóa cao nhất
→ Khi phản ứng với HNO3 thì Fe sẽ bị oxi hóa lên mức cao nhất là Fe3+
Câu 26:
Đáp án D
Ta sử dụng dung dịch H2SO4 loãng và NH3
- Hòa tan từng mẫu hợp kim vào dung dịch H2SO4 loãng
+ Hợp kim không bị hòa tan trong H2SO4 loãng là Cu-Ag
+ Hợp kim bị hòa tan môt phần, có khí thoát ra là: Cu-Al ; Cu-Zn
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Zn + H2SO4 → ZnSO4 + H2
- Nhỏ tiếp NH3 dư vào sản phẩm tạo thành ở hai mẫu Cu-Al ; Cu-Zn.
+ Xuất hiện kết tủa và kết tủa không tan: Cu-Al
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
Do NH3 là bazơ yếu nên không hòa tan được Al(OH)3
+ Xuất hiện kết tủa, kết tủa tan: Cu-Zn
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 27:
Đáp án C
nNaOH = nO (Z) = = 0,1 mol → nC muối >= 0,1
nC (E) = nC (ancol) + nC (muối) = 0,2 mol
→ nC (ancol) = nC (muối) = nNa (muối) = 0,1 mol
→ ancol là CH3OH (a mol), C2H4(OH)2 (b mol) và muối HCOONa (0,1 mol)
Bảo toàn Na: a + 2b = 0,1 (1)
mancol = 32a + 62 b = 3,14 (2)
Từ (1) và (2) → a = 0,04 mol; b = 0,03 mol
→ X là HCOOCH3 (0,04 mol) và Y là (HCOO)2C2H4 (0,03 mol)
→ %mX = 40,40%
Câu 28:
Đáp án C
Vì trong cấu tạo của lysin có chứa 2 nhóm –NH2.
→ ∑nHCl = nNaOH + 2nLysin
→ nLysin =![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94371.png) = 0,2 mol.
= 0,2 mol.
Câu 29:
Đáp án C
Phương trình phản ứng
Zn + CuSO4 → ZnSO4 + Cu
nCu = nCuSO4= 0,01 mol
Gọi số mol Zn phản ứng là x (mol)
→ nZn phản ứng = nCu = 0,01 mol
Khối lượng lá kẽm giảm = m Cu tạo thành - m Zn phản ứng
→ ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94375.png) .m Zn ban đầu = 64.0,01 + 65.0,01
.m Zn ban đầu = 64.0,01 + 65.0,01
→ m Zn ban đầu = 20 gam
Câu 30:
Đáp án C
nCO2 = 0,02 mol
C + O2![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94376.png) CO2
CO2
→ nC = nCO2 = 0,02 mol
%mC =![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94378.png) = 2,4%
= 2,4%
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 9
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
Câu 1: Este X được tạo bởi ancol etylic và axit axetic. Công thức của X là
A. CH3COOCH3. B. HCOOC2H5.
C. HCOOCH3. D.CH3COOC2H5.
Câu 2: Số nguyên tử hiđro trong phân tử glucozơ là
A. 11. B. 22. C. 6. D. 12.
Câu 3: Chất nào sau đây không có phản ứng thủy phân?
A. Glucozơ B. Chất béo C. Saccarozơ D. Xenlulozơ
Câu 4: Glucozơ lên men thành ancol etylic theo phương trình phản ứng sau:
C6H12O6![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94423.png) 2C2H5OH +2CO2
2C2H5OH +2CO2
Để thu được 92 gam C2H5OH cần dùng m gam glucozơ. Biết hiệu suất của quá trình lên men là 60%. Giá trị của m là
A. 360 B. 300 C. 108 D. 270
Câu 5: Amin no, đơn chức, mạch hở có công thức tổng quát là
A. CnH2nN. B. CnH2n+1N.
C. CnH2n+3N. D. CnH2n+2N.
Câu 6: Chất có tính bazơ mạnh nhất là
A. C2H5NH2. B. (C6H5)3N. C. (CH3)2NH. D. CH3NH2.
Câu 7: Dung dịch chất nào sau đây làm quỳ tím chuyển thành màu xanh?
A. Alanin. B. Glyxin. C. Lysin. D. Valin.
Câu 8: Hợp chất nào dưới đây thuộc loại amino axit
A. CH3COOC2H5 B. HCOONH4
C. C2H5NH2 D. H2NCH2COOH
Câu 9: Chất X vừa tác dụng được với axit, vừa tác dụng được với bazơ. Chất X là
A. CH3COOH B. CH3CHO
C. CH3NH2 D. H2NCH2COOH
Câu 10: Chất nào dưới đây tạo phức màu tím với Cu(OH)2?
A. Gly-Val B. Glucozơ
C. Ala-Gly-Val D. metylamin
Câu 11: Phân tử khối của peptit Ala-Gly là
A. 164 B. 160 C. 132 D. 146
Câu 12: Polime nào sau đây thuộc loại polime thiên nhiên?
A. Polietilen. B. Poli(vinyl clorua)
C. Polibutađien. D. Xenlulozơ.
Câu 13: Chất nào sau đây không có khả năng tham gia phản ứng trùng hợp?
A. propen B. stiren C. isopren D. toluen
Câu 14: Polime X là chất rắn trong suốt có khả năng cho ánh sáng truyền qua tốt nên được dùng chế tạo thuỷ tinh hữu cơ plexiglas. Tên gọi của X là
A. polietilen. B. poliacrilonitrin.
C. poli(metyl metacrylat). D. poli(vinyl clorua).
Câu 15: PVC là chất rắn vô định hình, cách dẫn điện tốt, bền với axit, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa,... PVC được tổng hợp trực tiếp từ monome nào sau đây?
A. Vinyl clorua. B. Vinyl axetat. C. Acrilonitrin. D. Propilen.
Câu 16: Polime X có phân tử khối là 336000 và hệ số trùng hợp là 12000. Vậy X là
A. PE B. PP C. PVC D. Teflon
Câu 17: Cho các nhận xét sau:
(1) Tinh bột và xenlulozơ là hai đồng phân cấu tạo của nhau.
(2) Hai đồng phân amino axit của C3H7NO2 tạo ra tối đa 3 đipeptit.
(3) Khi đun nóng glucozơ (hoặc fructozơ) với dung dịch AgNO3 trong NH3 thu được Ag.
(4) Thủy phân hoàn toàn tinh bột và xenlulozơ mỗi chất chỉ cho 1 loại monosaccarit duy nhất.
(5) Nồng độ glucozơ trong máu người bình thường khoảng 5%.
(6) Tất cả các dung dịch protein đều có phản ứng màu biure.
(7) Dung dịch lòng trắng trứng có phản ứng màu biure.
Số nhận xét đúng là
A. 5. B. 4. C. 3. D. 6.
Câu 18: Bán kính nguyên tử các nguyên tố: Na, Li, Be, B. Xếp theo chiều tăng dần là:
A. B < Be < Li < Na B. Na < Li < Be < B
C. Li < Be < B < Na D. Be < Li < Na < B
Câu 19: Cho Fe tác dụng với dung dịch HNO3 đặc, nóng thu được khí X có màu nâu đỏ. Khí X là
A. N2 B. N2O C. NO D. NO2
Câu 20: Khử hoàn toàn 32 gam CuO thành kim loại cần vừa đủ V lít khí CO (đktc). Giá trị của V là
A. 13,44 B. 8,96 C. 4,48 D. 6,72
Câu 21: Có các phản ứng như sau :
1. Fe + 2H+→ Fe2+ + H2
2. Fe + Cl2→ FeCl2
3. AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag
4. Ca + FeCl2dung dịch → CaCl2 + Fe
5. Zn + 2FeCl3 ZnCl2 + 2FeCl2
6. 3Fe dư + 8HNO3loãng → 3Fe(NO3)2 + 2NO + 4H2O
Trong các phản ứng trên, số phản ứng viết không đúng là
A. 1 B. 2. C. 3. D. 4.
Câu 22: Cho một mẫu hợp kim K-Na tác dụng với nước dư, thu được dung dịch X và 3,36 lít H2 (đktc). Thể tích dung dịch axit HCl 2M cần dùng để trung hòa dung dịch X là
A. 150 ml B. 75 ml C. 60 ml D. 30 ml
Câu 23: Có 3 mẫu hợp kim: Fe - Al; K - Na; Cu - Mg. Hoá chất có thể dùng để phân biệt 3 mẫu hợp kim trên là
A. dung dịch NaOH. B. dung dịch HCl.
C. dung dịch H2SO4. D. dung dịch MgCl2
Câu 24: Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch X. Cô cạn dung dịch X được bao nhiêu gam muối khan?
A. 26,05 gam B. 26,35 gam
C. 36,7 gam D. 37,3 gam
Câu 25: Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 1,344 lít khí CO2,
0,224 lít khí N2 (các thể tích khí đo ở đktc) và 1,62 gam H2O. Công thức của X là
A. C4H9N. B. C3H7N. C. C2H7N. D. C3H9N.
Câu 26: Amino axit X chứa một nhóm -NH2. Cho 15 gam X tác dụng với axit HCl (dư), thu được 22,3 gam muối khan. Công thức cấu tạo thu gọn của X là
A. H2NCH2COOH. B. CH3CH2CH(NH2)COOH.
C. H2NCH2CH2COOH. D. CH3CH(NH2)COOH.
Câu 27: Người ta sản xuất cao su buna từ gỗ theo sơ đồ sau:
Gỗ ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94430.png) glucozơ
glucozơ ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94431.png) ancol etylic
ancol etylic ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94432.png) Butađien-1,3
Butađien-1,3 ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94433.png) Cao su Buna.
Cao su Buna.
Tính lượng gỗ cần thiết để sản xuất được 1 tấn cao su, giả sử trong gỗ chứa 50% xenlulozơ?
A. 35,714 tấn. B. 17,857 tấn.
C. 8,929 tấn. D. 18,365 tấn.
Câu 28: Khi thủy phân hết 3,28 gam hỗn hợp X gồm hai este đơn chức, mạch hở thì cần vừa đủ 0,05 mol NaOH, thu được một muối và hỗn hợp Y gồm hai ancol cùng dãy đồng đẳng. Đốt cháy hết Y trong O2 dư, thu được CO2 và m gam H2O. Giá trị của m là
A. 2,16. B. 3,06. C. 1,26. D. 1,71.
Câu 29: Để sản xuất 59,4 kg xenlulozơ trinitrat (hiệu suất phản ứng 90%) cần dùng ít nhất V lít dung dịch HNO3 97,67% (D = 1,52 g/ml) phản ứng với lượng dư xenlulozơ.
Giá trị của V là
A. 27,23. B. 27,72. C. 28,29. D. 24,95.
Câu 30: Hỗn hợp E gồm hai amin X (CnHmN), Y (CnHm+1N2, với n ≥ 2) và hai anken đồng đẳng kế tiếp. Đốt cháy hoàn toàn 0,08 mol E, thu được 0,03 mol N2, 0,22 mol CO2 và 0,30 mol H2O. Phần trăm khối lượng của X trong E là
A. 43,38%. B. 57,84%. C. 18,14%. D. 14,46%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1D |
2D |
3A |
4B |
5C |
6C |
7C |
8D |
9D |
10C |
|
11D |
12D |
13D |
14C |
15A |
16A |
17B |
18A |
19D |
20B |
|
21B |
22A |
23A |
24C |
25D |
26A |
27A |
28A |
29C |
30B |
Câu 1:
Đáp án D
Ancol etylic: C2H5OH
Axit axetic: CH3COOH
C2H5OH + CH3COOH ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94434.png) CH3COOC2H5 (etyl axetat) + H2O
CH3COOC2H5 (etyl axetat) + H2O
Câu 2:
Đáp án D
Công thức phân tử của glucozơ là C6H12O6.
→ Số nguyên tử hiđro trong phân tử glucozơ là 12
Câu 3:
Đáp án A
Glucozơ là monosaccarit, không có phản ứng thủy phân.
Câu 4:
Đáp án B
C6H12O6 → 2C2H5OH + CO2
nC2H5OH = 2mol → nglucozơ = 1mol
Khối lượng glucozơ tính theo lí thuyết là mglucozơ = 1.180 = 180 gam
Do hiệu suất phản ứng 60% → khối lượng thực mà glucozơ cần dùng là:![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94622.png) = 300 (g)
= 300 (g)
Câu 5:
Đáp án C
Amin no, đơn chức, mạch hở có công thức tổng quát là CnH2n+3N.
Câu 6:
Đáp án C
Thứ tự tăng dần tính bazơ là: amin thơm < NH3 < amin no
Amin bậc 2 có tính bazơ mạnh hơn amin bậc 1
→ Chất có tính bazơ mạnh nhất là (CH3)2NH.
Câu 7:
Đáp án C
A, B, D không làm quỳ tím đổi màu vì đều có 1 nhóm NH2 và 1 nhóm COOH
C. lysin làm quỳ chuyển sang màu xanh vì có 2 nhóm NH2 và 1 nhóm COOH
Câu 8:
Đáp án D
Amino axit là hợp chất hữu cơ tạp chất hữu cơ tạp chức mà trong phân tử chứa đồng thời nhóm amino (NH2) và nhóm cacboxyl (COOH).
→ Hợp chất thuộc loại amino axit là H2NCH2COOH
A là este, B là muối, C là amin
Câu 9:
Đáp án D
Glyxin: H2NCH2COOH là chất lưỡng tính, tác dụng được với cả axit và bazơ:
H2NCH2COOH + HCl → ClH3NCH2COOH
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
Câu 10:
Đáp án C
A sai vì đipeptit không có phản ứng màu biure với Cu(OH)2
B sai vì glucozơ tạo phức màu xanh đặc trưng với Cu(OH)2 ở nhiệt độ thường.
C đúng vì từ tripeptit trở lên đều tạo phức màu tím với Cu(OH)2
D sai vì metylamin không phản ứng với Cu(OH)2
Câu 11:
Đáp án D
Phân tử khối của peptit Ala-Gly là:
M = 89 + 75 - 18 = 146(g/mol)
Câu 12:
Đáp án D
Polime thiên nhiên là xenlulozơ, tơ tằm, cao su thiên nhiên
Câu 13:
Đáp án D
Toluen có công thức là C6H5CH3 → không tham gia phản ứng trùng hợp vì vòng benzen chứa liên kết bội nhưng rất bền.
Câu 14:
Đáp án C
Thủy tinh hữu cơ hay còn gọi là poli(metyl metacrylat).
Phương trình điều chế:
![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94627.png)
Câu 15:
Đáp án A
PVC là viết tắt của Poli(vinyl clorua).
→ PVC được tổng hợp từ monome vinyl clorua (CH2=CHCl).
![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94628.png)
Câu 16:
Đáp án A
Phân tử khối của một mắt xích trong X là ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94630.png) = 28 đvC
= 28 đvC
→ Mắt xích là -CH2-CH2-
→ X là PE (polietilen)
Câu 17:
Đáp án B
(1) sai vì tinh bột và xenlulozơ không phải là đồng phân cấu tạo của nhau.
(2) sai vì peptit tạo bởi -amino axit → Chỉ có 1 peptit là Ala-Ala.
(5) sai vì nồng độ glucozơ trong máu người bình thường khoảng 0,1%.
Câu 18:
Đáp án A
Li và Na thuộc cùng nhóm IA và ZLi < ZNa→ Bán kính Na > Li
Li, Be và B thuộc cùng chu kỳ 2 và ZLi < ZBe < ZB → Bán kính: Li > Be > B
Chiều tăng dần bán kính: B < Be < Li < Na
Câu 19:
Đáp án D
N2: Không màu nhẹ hơn không khí
N2O: Không màu nặng hơn không khí
NO: Không màu, hóa nâu ngoài không khí
NO2: Màu nâu đỏ
Câu 20:
Đáp án B
nCuO = 0,4 mol
nCO phản ứng = nO trong oxit = 0,4 mol
→ V = 0,4.22,4 = 8,96 lít
Câu 21:
Đáp án B
2. Sửa lại thành: 2Fe + 3Cl2![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94633.png) 2FeCl3
2FeCl3
4. Ca phản ứng với nước trong dung dịch trước
Ca + 2H2O → Ca(OH)2 + H2
Ca(OH)2 + FeCl2dung dịch → CaCl2 + Fe(OH)2
→ Phản ứng 2,4 không đúng
Chú ý: Phản ứng 6 là gộp của 2 phản ứng:
Fe + 4HNO3→ Fe(NO3)3 + NO + 2H2O
Fe dư + 2Fe(NO3)3 → 3Fe(NO3)2
Câu 22:
Đáp án A
nH2= 0,15 mol
nOH= 2.nH2 = 0,3 mol
nOH-= nH+ = 0,3 mol
→ VHCl = 0,3 : 2 = 0,15 lít = 150 ml
Câu 23:
Đáp án A
Sử dụng NaOH để phân biệt
- Hợp kim tan một phần trong NaOH dư: Fe-Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Hợp kim tan hoàn toàn trong NaOH dư: K-Na
2K + 2H2O → 2KOH + H2
2Na + 2H2O → 2NaOH + H2
- Hợp kim không tan trong NaOH dư: Cu-Mg
Câu 24:
Đáp án C
Bào toàn nguyên tố H:
nH+ = nHCl = 2nH2 = 0,6 mol
→ mKL + mHCl = m muối +
→ 15,4 + 36,5.0,6 = m muối + 2.0,3
→ m muối = 36,7 gam
Câu 25:
Đáp án D
nCO2 = 0,06 mol ; nN2 = 0,01 mol ; nH2O = 0,09 mol
Amin đơn chức → namin = 2nN2 = 0,02 mol
Số nguyên tử cacbon là: C = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94642.png) = 3
= 3
Số nguyên tử hiđro là: H = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94643.png) = 9
= 9
→ Công thức phân tử của amin X là C3H9N
Câu 26:
Đáp án A
Gọi công thức của amino axit X có dạng H2N-R-(COOH)a
Bảo toàn khối lượng ta có:
nHCl = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94646.png) = 0,2 mol → nX = nHCl = 0,2 mol
= 0,2 mol → nX = nHCl = 0,2 mol
→ 16 + R + 45a = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94648.png)
→R +45a = 59
→a = 1; R = 14
Công thức của X là H2N-CH2-COOH.
Câu 27:
Đáp án A
(C6H10O5)n → nC6H12O6 → 2n C2H5OH → n butađien-1,3 → caosu buna
→ ncaosu buna = n xenlulozo
Khối lượng gỗ cần dùng là:
![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94651.png) = 35,714 tấn
= 35,714 tấn
Câu 28:
Đáp án A
nX = nNaOH = 0,05 mol → ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94656.png) = 65,6
= 65,6
→ Trong X chứa este HCOOCH3 (M = 60)
Sản phẩm chỉ có 1 muối là HCOONa (0,05).
Bảo toàn khối lượng:
mX = mNaOH = mHCOONa + mancol
→ mancol = 3,28 + 0,05.40 - 0,05.68 = 1,88
Quy đổi ancol thành CH3OH (0,05 mol) và CH2 (0,02 mol)
Bảo toàn nguyên tố H:
nH2O = 0,05.2+0,02 = 0,12mol
→ mH2O = 0,12.18 = 2,16 gam
Câu 29:
Đáp án C
[C6H7O2(OH)3]n + 3nHNO3![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94661.png) [C6H7O2(ONO2)3]n + 3nH2O
[C6H7O2(ONO2)3]n + 3nH2O
Phản ứng với lượng dư xenlulozơ → Hiệu suất tính theo axit HNO3.
Khối lượng axit HNO3 cần dùng thực tế là:
mHNO3 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94669.png) = 42.103 gam
= 42.103 gam
→ mddHNO3 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94671.png) ≈ 43.103 gam
≈ 43.103 gam
→ VddHNO3 = ![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94672.png) = 28,29.103 ml
= 28,29.103 ml
→VddHNO3 = 28,29 lít
Câu 30:
Đáp án B
![[Năm 2022] Đề thi Học kì 1 Hóa học lớp 12 có đáp án (6 đề)](https://vietjack.com/de-thi/images/de-thi-hoc-ki-1-hoa-hoc-lop-12-co-dap-an-dtvj2022-94674.png)
Nhận thấy X và Y có cùng số pi
nH2O > nCO2 → amin no hoặc là amin không no 1 nối đôi
Nếu 2 amin không no 1 nối đôi thì namin = nH2O - nCO2 = 0,08 mol
→ x + y = 0,08 (loại). Vì x + y + z = 0,08
→ các amin đều no
Ta có: nE = x + y + z = 0,08 (1)
Theo định luật bảo toàn nguyên tố N:
x + 2y = 0,06 (2)
nH2O - nCO2 = 1,5x + 2y
→ 0,08 = 1,5x + 2y (3)
Từ (1), (2) và (3)
→ x = 0,04 mol; y = 0,01 mol và z = 0,03 mol
Anken có dạng công thức trung bình là CaH2a
Bảo toàn nguyên tố C:
nCO2 = 0,04n + 0,01n + 0,03a = 0,22
→5n + 3a = 22
→ n = 3 và a = 7/3 là nghiệm duy nhất
→ E gồm C3H9N 0,04 mol và C3H10N2 0,01 mol và C7/3H14/3 0,03 mol
→ % C3H9N = 57,84%
Đề thi Học kì 1 Hóa học lớp 12 có đáp án đề số 10
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học 12
Thời gian làm bài: 45 phút
Câu 1: Chất nào sau đây thuộc loại este no, đơn chức, mạch hở?
A. CH3-COOC6H5. B. CH2=CH-COOCH3.
C. CH3-COOCH=CH2. D. CH3-COOC2H5.
Câu 2: Cho dãy các chất: glucozơ, saccarozơ, xenlulozơ, tinh bột. Số chất trong dãy tham gia phản ứng thủy phân là
A. 2. B. 4.
C. 1. D. 3.
Câu 3: Khi cho dung dịch iot vào dung dịch hồ tinh bột, dung dịch chuyển màu
A. xanh tím. B. đỏ gạch.
C. không chuyển màu. D. vàng.
Câu 4: Chất nào sau đây được dùng làm thuốc súng không khói?
A. tơ visco. B. xenlulozơ trinitrat.
C. tơ axetat. D. xenlulozơ.
Câu 5: Số đồng phân cấu tạo amin bậc hai có cùng công thức phân tử C4H11N là
A. 4. B. 1.
C. 2. D. 3.
Câu 6: Hợp chất nào dưới đây thuộc loại amino axit ?
A. H2NCH2COOH. B. CH3COOC2H5.
C. C2H5NH2. D. HCOONH4.
Câu 7: Công thức phân tử của glyxin (axit aminoaxetic) là
A. C3H7O2N. B. C2H5O2N.
C. C2H7O2N. D. C4H9O2N.
Câu 8: Số gốc α-amino axit trong phân tử tripeptit mạch hở là
A. 1. B. 3.
C. 2. D. 4.
Câu 9: Chất nào sau đây không tham gia vào phản ứng màu biure?
A. Ala-Val-Gly-Val. B. Gly-Ala-Ala.
C. Val-Gly-Ala. D. Gly-Ala.
Câu 10: Tơ visco thuộc loại polime
A. bán tổng hợp. B. thiên nhiên.
C. tổng hợp. D. trùng hợp.
Câu 11: Cho dãy các chất: H2NCH2COOH, C2H5NH2, CH3NH2, CH3COOH. Số chất trong dãy phản ứng với HCl trong dung dịch là
A. 4. B. 1.
C. 2. D. 3.
Câu 12: Cho các phát biểu sau:
(1) Fructozơ và glucozơ đều có khả năng tham gia phản ứng tráng bạc;
(2) Saccarozơ và tinh bột đều không bị thủy phân khi có axit H2SO4 (loãng) làm xúc tác;
(3) Tinh bột được tạo thành trong cây xanh nhờ quá trình quang hợp;
(4) Xenlulozơ và saccarozơ đều thuộc loại đisaccarit.
Phát biểu đúng là
A. (2) và (4). B. (1) và (3).
C. (3) và (4). D. (1) và (2).
Câu 13: Để trung hòa 3,1 gam một amin đơn chức X cần dùng vừa đủ 100 ml dung dịch HCl 1M. Công thức phân tử của X là
A. C3H9N. B. CH5N.
C. C2H5N. D. C2H7N.
Câu 14: Thủy phân hoàn toàn 1 mol peptit mạch hở X chỉ thu được 3 mol Gly và 2 mol Ala. Phân tử khối của X là
A. 331. B. 349.
C. 335. D. 326.
Câu 15: Thuỷ phân 13,2 gam etyl axetat bằng 300 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch, thu được m gam chất rắn khan. Giá trị của m là
A. 12,30. B. 12,84.
C. 15,60. D. 4,92.
Câu 16: Để điều chế etyl axetat trong phòng thí nghiệm, người ta lắp dụng cụ như hình vẽ sau:
Hóa chất được cho vào bình 1 trong thí nghiệm trên là
A. CH3COOH, C2H5OH và H2SO4 đặc.
B. CH3COOH, CH3OH và HCl đặc.
C. CH3COOH, C2H5OH và H2SO4 loãng.
D. CH3COOH, CH3OH và H2SO4 đặc.
Câu 17: Nhận xét nào sau đây đúng ?
A. Khi thủy phân CH3COOCH=CH2 bằng dung dịch NaOH thu được muối và ancol tương ứng.
B. Muối natri stearat không thể dùng để sản xuất xà phòng.
C. Vinyl axetat, metyl metacrylat đều có khả năng tham gia phản ứng trùng hợp.
D. Phản ứng thủy phân este trong môi trường axit là phản ứng một chiều.
Câu 18: Trong các kim loại sau đây, kim loại nào dẻo nhất?
A. Sn. B. Au.
C. Cu. D. Al.
Câu 19: Trong các kim loại: Na, Ca, Fe và Cu, số kim loại phản ứng với nước ở điều kiện thường là
A. 2. B. 4.
C. 3. D. 1.
Câu 20: Cho 5,6 gam Fe tác dụng hết với dung dịch HNO3 (dư), sinh ra V lít khí NO (ở đktc, sản phẩm khử duy nhất). Giá trị của V là
A. 1,12. B. 3,36.
C. 4,48. D. 2,24.
Câu 21: Cho 15,2 gam hỗn hợp bột Mg và Cu vào dung dịch HCl (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí H2 (đktc). Khối lượng Cu trong hỗn hợp là
A. 6,4 gam. B. 12,8 gam.
C. 9,6 gam. D. 4,8 gam.
Câu 22: Phản ứng nào sau đây không xảy ra ?
A. Fe + CuSO4 → FeSO4 + Cu.
B. 2Ag + Cu(NO3)2 → Cu + 2AgNO3.
C. Cu + 2FeCl3 → CuCl2 + 2FeCl2.
D. Hg + S → HgS.
Câu 23: Có 3 chất saccarozơ, mantozơ, anđehit axetic. Dùng thuốc thử nào để phân biệt?
A. AgNO3/NH3 B. Cu(OH)2/NaOH.
C. Dung dịch Br2 D. Na.
Câu 24: Đun nóng dung dịch chứa 27 gam glucozơ với dung dịch AgNO3/NH3(dư) thì khối lượng Ag tối đa thu được là
A. 21,6 gam B. 32,4 gam
C. 16,2 gam D. 10,8 gam
Câu 25: Lên men 162 gam tinh bột với hiệu suất toàn bộ quá trình lên men là 72%. Biết khối lượng riêng của C2H5OH nguyên chất là 0,8 g/ml. Thể tích dung dịch rượu 40o thu được là
A. 115 ml. B. 230 ml.
C. 207 ml. D. 82,8 ml.
Câu 26: Cho m gam một este E vào một lượng vừa đủ KOH đun nóng thu được dung dịch X. Cô cạn X thu được 16,5 gam muối khan của một axit đơn chức và 6,9 gam một ancol đơn chức Y. Cho toàn bộ Y tác dụng với Na dư thu được 1,68 lít khí (ở đktc). Tên của E là
A. etyl propionat B. etyl acrylat
C. metyl metacrylat D. etyl axetat
Câu 27: Phản ứng lưu hóa cao su thuộc loại:
A. Giữ nguyên mạch polime
B. Giảm mạch polime
C. Đề polime hóa
D. Tăng mạch polime
Câu 28: X là một aminoaxit. Cứ 0,01 mol X tác dụng vừa hết 80ml dung dịch HCl 0,125M thu được 1,835g muối. Mặt khác 0,01 mol X tác dụng với dung dịch NaOH thì cần 25 gam dung dịch NaOH 3,2%. Vậy công thức cấu tạo của X là
A. H2NC3H5(COOH)2 B. (H2N)2C3H5COOH
C. H2NC3H6COOH D. H2NC7H12COOH
Câu 29: Chọn câu sai:
A. Lòng trắng trứng có phản ứng màu biure với Cu(OH)2.
B. Liên kết của nhóm CO với nhóm NH giữa hai đơn vị α-amino axit được gọi là liên kết peptit.
C. Thủy phân hoàn toàn protein đơn giản thu được các α-amino axit.
D. Pentapeptit: Tyr – Ala – Gly – Val – Lys (mạch hở) có 5 liên kết peptit.
Câu 30: Thủy phân 14,6 gam Gly-Ala trong dung dịch NaOH dư thu được m gam muối. Giá trị của m là
A. 16,8. B. 18,6.
C. 20,8. D. 20,6.
Đáp án & Thang điểm
Câu 1: Đáp án D
CH3-COOC2H5 là este no, đơn chức, mạch hở.
Câu 2: Đáp án D
Saccarozơ, xenlulozơ, tinh bột tham gia phản ứng thủy phân.
Câu 3: Đáp án A
Khi cho dung dịch iot vào dung dịch hồ tinh bột, dung dịch chuyển màu xanh tím.
Câu 4: Đáp án B
Xenlulozơ trinitrate được ứng dụng làm thuốc súng không khói.
Câu 5: Đáp án D
Các amin bậc II ứng với công thức phân tử C4H11N là:
CH3 – NH – CH2 – CH2 – CH3; CH3 – NH – CH (CH3)2; C2H5 – NH – C2H5.
Câu 6: Đáp án A
Amino axit là hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm – NH2 và – COOH.
→ H2NCH2COOH là amino axit.
Câu 7: Đáp án B
Glyxin: H2N – CH2 – COOH → CTPT là: C2H5O2N.
Câu 8: Đáp án B
Trong phân tử tripeptit mạch hở có 3 gốc α-amino axit.
Câu 9: Đáp án D
Chỉ peptit có từ 2 liên kết peptit trở nên mới có phản ứng màu biure.
Câu 10: Đáp án A
Tơ visco thuộc loại polime bán tổng hợp.
Câu 11: Đáp án D
H2NCH2COOH, C2H5NH2, CH3NH2 phản ứng được với HCl.
Câu 12: Đáp án B
2 – sai vì Saccarozơ và tinh bột đều bị thủy phân khi có axit H2SO4 (loãng) làm xúc tác;
4 – sai vì Xenlulozơ thuộc loại polisaccarit.
Câu 13: Đáp án B
Đặt công thức amin là R-NH2
→ Mamin = 3,1 : 0,1 = 31. Vậy amin là CH3NH2 → CTPT: CH5N.
Câu 14: Đáp án A
Phân tử khối của X là: 75.3 + 2.89 – 4.18 = 331 (g/ mol).
Câu 15: Đáp án D
CH3COOC2H5 (0,15) + NaOH (0,06 mol) → CH3COONa + C2H5OH
Theo phản ứng este dư, vậy chất rắn sau phản ứng chỉ gồm CH3COONa: 0,06 mol
→ m = 0,06.82 = 4,92 gam.
Câu 16: Đáp án A
Câu 17: Đáp án C
A sai vì CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO.
B sai vì Muối natri stearat dùng để sản xuất xà phòng.
D sai vì Phản ứng thủy phân este trong môi trường axit là phản ứng thuận nghịch.
Câu 18: Đáp án B
Kim loại dẻo nhất là Au
Câu 19: Đáp án A
Na và Ca phản ứng với nước ở điều kiện thường.
Câu 20: Đáp án D
Bảo toàn electron có: 3.nFe = 3.nNO → nFe = nNO = 0,1mol.
Vkhí = 0,1.22,4 = 2,24 lít.
Câu 21: Đáp án B
Cu không phản ứng.
Mg (0,1) + 2HCl → MgCl2 + H2 (0,1 mol)
→ mCu = 15,2 – 0,1.24 = 12,8 gam.
Câu 22: Đáp án B
Ag + Cu(NO3)2 → không xảy ra.
Câu 23: Đáp án B
Dùng Cu(OH)2/NaOH phân biệt saccarozơ, mantozơ, anđehit axetic.
Ở nhiệt độ thường saccarozơ, mantozơ hòa tan Cu(OH)2 tạo dung dịch phức đồng màu xanh lam, anđehit axetic không hiện tượng → nhận ra anđehit axetic.
Sau đó đun nóng hai ống nghiệm có phức xanh → xuất hiện chất kết tủa màu đỏ
gạch Cu2O → mantozơ.
Câu 24: Đáp án B
Trong phản ứng tráng gương cứ 1 mol glucozơ → 2 mol Ag
nglucozơ = 0,15 mol ⇒ nAg = 0,3 mol
⇒ mAg = 0,3.108 = 32,4g.
Câu 25:
(C6H10O5)n → nC6H12O6 → 2nC2H5OH .
nC2H5OH = 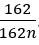
Thể tích rượu C2H5OH 40o là:
Câu 26: Đáp án B
Giả sử E là RCOOR'
Cô cạn X thu được 16,5 gam muối RCOOK và 6,9 gam R'OH
2R'OH (0,15) + 2Na → 2R'ONa + H2 (0,075 mol)
⇒ MR'OH = 6,9 : 0,15 = 46 ⇒ MR' = 29 ⇒ R' là C2H5-.
nRCOOK = nR'OH = 0,15 mol
⇒ MRCOOK = 16,5 : 0,15 = 110 ⇒ MR = 27 ⇒ R là CH2=CH-
X + KOH → CH2=CHCOOK + CH3CH2OH
Vậy X là CH2=CHCOOCH2CH3: etyl acrylat
Câu 27: Đáp án D
Phản ứng lưu hóa chuyển cao su từ mạch thẳng thành mạch không gian ⇒ Tăng mạch polime.
Câu 28: Đáp án A
Ta có: nX = nHCl = 0,01mol ⇒ X chứa 1 nhóm -NH2
nNaOH = 0,02 = 2nX ⇒ X chứa 2 nhóm -COOH
⇒ Aminoaxit X có dạng: H2N-R-(COOH)2
mX = mmuối - mHCl = 1,835 - 0,01.36,5 = 1,47gam
⇒ M = 147 ⇒ R = 41 ⇒ R là -C3H5
Vậy X là H2NC3H5(COOH)2
Câu 29: Đáp án D
D sai vì pentapeptit chỉ có 4 liên kết peptit.
Câu 30: Đáp án C
MGly-Ala = 75 + 89 - 18 = 146
Muối sau phản ứng là: NH2CH2COONa 0,1 mol và CH3CH(NH2)COONa 0,1 mol
mmuối = 0,1.(97 + 111) = 20,8 gam.
Để xem trọn bộ Đề thi Hóa học 12 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi lớp 12 chọn lọc, hay khác:
Đề thi Học kì 1 Toán lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Tiếng anh lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Địa Lí lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Vật lí lớp 12 năm 2022 - 2023 có đáp án
Đề thi học kì 1 Lịch sử lớp 12 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 GDCD lớp 12 năm 2022 - 2023 có đáp án
Xem thêm các chương trình khác:
- Góp ý sgk lớp 12 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi chính thức các môn THPT Quốc Gia các năm
- (3000+) Đề thi thử THPT Quốc Gia (các năm) từ các trường, sở trên cả nước
- Đề minh họa THPT quốc gia các năm
- Đề thi Đánh giá năng lực năm 2023 | Thông tin | Cấu trúc ĐGNL ĐHQG Hà Nội, HCM, ĐHBK, Bộ Công an