Lý thuyết KHTN 8 Bài 13 (Chân trời sáng tạo): Muối
Tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Bài 13: Muối đầy đủ, chi tiết sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 8.
Lý thuyết KHTN 8 Bài 13: Muối
A. Kiến thức trọng tâm KHTN 8 Bài 13: Muối
I. Khái niệm muối
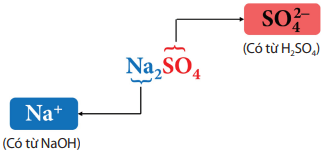
Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium ().
Ví dụ: Na2SO4 là muối có thành phần sau:
Cách gọi tên muối:
- Cách gọi tên muối của kim loại:
Tên kim loại + hoá trị (kim loại nhiều hoá trị) + tên gốc acid
- Cách gọi tên muối của ammonium ():
Ammonium + tên gốc acid
Ví dụ một số muối và tên gọi tương ứng:
|
Tên muối |
Công thức hoá học |
|
Potassium carbonate |
K2CO3 |
|
Iron(III) sulfate |
Fe2(SO4)3 |
|
Copper(II) chloride |
CuCl2 |
|
Ammonium nitrate |
NH4NO3 |
|
Sodium acetate |
CH3COONa |
|
Calcium phosphate |
Ca3(PO4)2 |
II. Tính tan của muối
Tuỳ thuộc vào khả năng tan trong nước của muối, ta có: muối tan, muối không tan hoặc ít tan.
- Một số muối tan được trong nước:
+ Tất cả các muối của kim loại nhóm IA (Li, Na, K, …)
+ Tất cả các muối ammonium.
+ Tất cả các muối nitrate.
+ Các muối sulfate ngoại trừ BaSO4, PbSO4.
+ Các muối chloride ngoại trừ AgCl, PbCl2.
- Một số muối không tan trong nước:
+ Các muối carbonate ngoại trừ Na2CO3, K2CO3, (NH4)2CO3 …
+ BaSO4, PbSO4 …
+ AgCl, PbCl2 …
III. Điều chế muối
Các phương pháp điều chế muối từ:
- Oxide acid:
Oxide acid + Base → Muối + H2O
Ví dụ: SO2 + Ba(OH)2 → BaSO3 + H2O.
- Oxide base:
Oxide base + Acid → Muối + H2O
Ví dụ: FeO + 2HCl → FeCl2 + H2O
- Dung dịch acid và base:
Acid + Base → Muối + H2O
Ví dụ: HCl + NaOH → NaCl + H2O
- Kim loại và acid:
M + (HCl, H2SO4 loãng, …) → Muối + H2↑
M là một số kim loại như Mg, Al, Zn, Fe, …
Ví dụ: Fe + 2HCl → FeCl2 + H2↑
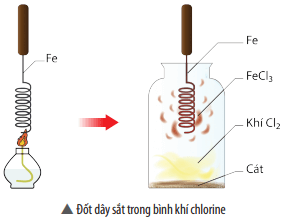
Ngoài ra, đa số kim loại tác dụng với phi kim thu được muối. Ví dụ đốt dây sắt trong bình khí chlorine thu được muối FeCl3.
IV. Tính chất hoá học của muối
Một số tính chất hoá học của muối:
- Dung dịch muối phản ứng với kim loại (KL):
Muối KL(A) + KL(B) → Muối KL(B) + KL(A)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu.
- Dung dịch muối phản ứng với dung dịch base:
Muối + Base → Muối mới + Base mới
Ví dụ: 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl.
- Dung dịch muối phản ứng với dung dịch acid:
Muối + Acid → Muối mới + Acid mới
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
- Dung dịch muối phản ứng với dung dịch muối:
Muối (A) + Muối (B) → Muối (C) + Muối (D)
Ví dụ: K2CO3 + CaCl2 → CaCO3↓ + 2KCl.
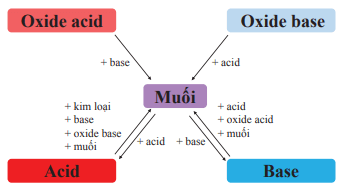
V. Mối quan hệ giữa acid, base, oxide và muối
Các hợp chất acid, base, oxide, muối có quan hệ với nhau theo sơ đồ sau:
B. Bài tập KHTN 8 Bài 13: Muối
Đang cập nhật
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo