Lý thuyết KHTN 8 Bài 12 (Chân trời sáng tạo): Oxide
Tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Bài 12: Oxide đầy đủ, chi tiết sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 8.
Lý thuyết KHTN 8 Bài 12: Oxide
A. Kiến thức trọng tâm KHTN 8 Bài 12: Oxide
I. Khái niệm oxide – phương trình hoá học tạo oxide
1. Khái niệm oxide
Oxide là hợp chất gồm 2 nguyên tố, trong đó có nguyên tố oxygen.
Công thức hoá học chung của oxide là MxOy.
Một số oxide trong tự nhiên có nhiều ứng dụng vào đời sống:
+ Silicon dioxide (SiO2) là thành phần chính của cát, nguyên liệu trong sản xuất thuỷ tinh, vật liệu silicate, …
+ Aluminium oxide (Al2O3) là thành phần chính của quặng bauxite, nguyên liệu trong điều chế aluminium.
+ Carbon dioxide (CO2) có trong thành phần không khí, là nguyên liệu cho quá trình quang hợp của thực vật.
2. Tìm hiểu phản ứng tạo oxide
Các phản ứng hoá học tạo ra oxide:
- Kim loại phản ứng với oxygen:
Kim loại + O2 Oxide kim loại
Phản ứng trên xảy ra với hầu hết các kim loại (trừ Au, Pt, Ag).
Chú ý:
Ở nhiệt độ thường, một số kim loại phản ứng chậm với oxygen trong không khí tạo thành một lớp oxide bao quanh bề mặt kim loại:
+ Sắt để lâu trong không khí sẽ bị gỉ sét.
+ Đồ dùng bằng nhôm tự tạo lớp oxide bao quanh bên ngoài, lớp oxide này có tác dụng bảo vệ nhôm.
- Phi kim phản ứng với oxygen:
Phi kim + O2 Oxide phi kim
Các phi kim thường gặp: C, S, P, …
II. Phân loại oxide
Có 4 loại oxide:
- Oxide acid là loại oxide phản ứng được với dung dịch base tạo ra muối và nước.
Ví dụ: CO2, SO2, SO3 …
- Oxide base là loại oxide phản ứng được với dung dịch acid tạo ra muối và nước.
Ví dụ: CaO, BaO, Na2O …
- Oxide lưỡng tính là các oxide vừa phản ứng được với dung dịch acid vừa phản ứng được với dung dịch base đều tạo ra muối và nước.
Ví dụ: Al2O3, ZnO …
- Oxide trung tính là các oxide không phản ứng được với dung dịch acid và dung dịch base.
Ví dụ: CO, NO…
Các oxide trung tính thường là các oxide của nguyên tố phi kim có hoá trị trong oxide < IV và không có acid tương ứng.
III. Tính chất hoá học của oxide
1. Oxide base phản ứng với dung dịch acid
Oxide base phản ứng với dung dịch acid tạo ra muối của acid tương ứng và nước.
Ví dụ:
ZnO + H2SO4 → ZnSO4 + H2O
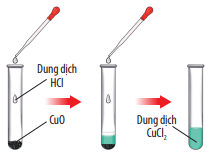
CuO + 2HCl → CuCl2 + H2O
CuO phản ứng với dung dịch HCl
2. Oxide acid phản ứng với dung dịch base
Oxide acid phản ứng với dung dịch base tạo ra muối của acid tương ứng và nước.
Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O
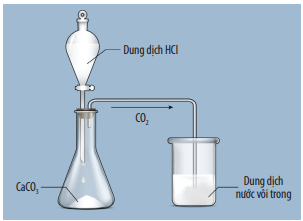
CO2 + Ca(OH)2 → CaCO3 + H2O
Thí nghiệm điều chế và thử tính chất của CO2
Mở rộng:
Oxide acid phản ứng với dung dịch base tạo muối có thành phần gồm kim loại trong base và gốc acid tương ứng của oxide acid theo bảng sau:
|
Oxide acid |
Kí hiệu gốc acid |
Tên kí hiệu gốc acid |
Hoá trị |
|
CO2 |
=CO3 |
Carbonate |
II |
|
CO2 |
−HCO3 |
Hydrogen carbonate |
I |
|
SO2 |
=SO3 |
Sulfite |
II |
|
SO2 |
−HSO3 |
Hydrogen sulfite |
I |
|
SO3 |
=SO4 |
Sulfate |
II |
|
P2O5 |
≡PO4 |
Phosphate |
III |
B. Bài tập KHTN 8 Bài 12: Oxide
Đang cập nhật
Xem thêm các bài lý thuyết KHTN 8 sách Chân trời sáng tạo hay, chi tiết tại:
Lý thuyết Bài 14: Phân bón hoá học
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo