Lý thuyết KHTN 8 Bài 3 (Chân trời sáng tạo): Phản ứng hoá học và năng lượng trong các phản ứng hoá học
Tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Bài 3: Phản ứng hoá học và năng lượng trong các phản ứng hoá học đầy đủ, chi tiết sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt KHTN 8.
Lý thuyết KHTN 8 Bài 3: Phản ứng hoá học và năng lượng trong các phản ứng hoá học
A. Kiến thức trọng tâm KHTN 8 Bài 3: Phản ứng hoá học và năng lượng trong các phản ứng hoá học
I. Phản ứng hoá học
Quá trình biến đổi chất này thành chất khác được gọi là phản ứng hoá học.
Chất tham gia phản ứng gọi là chất đầu.
Chất mới tạo thành gọi là sản phẩm.
Ví dụ: Hỗn hợp sắt (iron) và lưu huỳnh (sulfur) đã phản ứng với nhau khi đun nóng để tạo thành hợp chất iron(II) sulfide (FeS).
Trong đó chất đầu là sắt và lưu huỳnh; sản phẩm là iron(II) sulfide.
II. Diễn biến của phản ứng hoá học
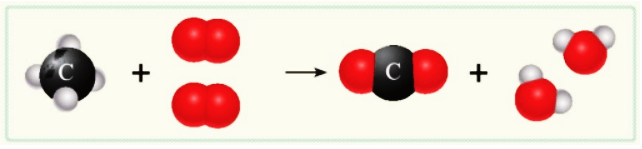
Trong phản ứng hoá học, có sự phá vỡ liên kết cũ và hình thành liên kết mới. Kết quả là chất này biến đổi thành chất khác.
Sơ đồ mô tả phản ứng đốt cháy khí methane trong không khí thu được carbon dioxide và nước
III. Một số dấu hiệu nhận biết có phản ứng hoá học xảy ra
Một số dấu hiệu có thể nhận biết phản ứng hoá học xảy ra: xuất hiện chất khí, chất kết tủa; thay đổi màu sắc, mùi; phát sáng, giải phóng hoặc hấp thụ nhiệt năng, …
 |
 |
|
Gas cháy sẽ toả nhiệt |
Phản ứng phân huỷ đường thành than và hơi nước |
 |
 |
|
Kẽm tác dụng với dung dịch hydrochloric acid tạo bọt khí |
Chất kết tủa tạo thành sau phản ứng |
IV. Năng lượng trong phản ứng hoá học
1. Phản ứng toả nhiệt, phản ứng thu nhiệt
Trong một phản ứng hoá học, luôn có sự thay đổi năng lượng. Năng lượng có thể toả ra hoặc nhận vào, thường dưới dạng nhiệt. Vì vậy, ta có thể chia phản ứng thành hai nhóm: phản ứng toả nhiệt và phản ứng thu nhiệt.
+ Phản ứng toả nhiệt là phản ứng có sự giải phóng năng lượng ra môi trường bên ngoài, thể hiện ở sự gia tăng nhiệt độ.
Những phản ứng toả nhiệt có thể được viết tổng quát như sau:
Chất phản ứng → Sản phẩm + năng lượng
+ Phản ứng thu nhiệt là những phản ứng hấp thụ năng lượng từ môi trường xung quanh.
Những phản ứng thu nhiệt có thể được viết tổng quát như sau:
Chất phản ứng + năng lượng → Sản phẩm
2. Các ứng dụng phổ biến của phản ứng toả nhiệt
Sự đốt cháy nhiên liệu (than, dầu hoả, gas, …) tạo ra năng lượng nhiệt phục vụ cho việc nấu nướng, sưởi ấm, …
Quá trình hô hấp trong cơ thể cung cấp năng lượng để cơ thể hoạt động, đồng thời tạo nên thân nhiệt ổn định và hỗ trợ quá trình vận động.
B. Bài tập KHTN 8 Bài 3: Phản ứng hoá học và năng lượng trong các phản ứng hoá học
Đang cập nhật
Xem thêm các bài lý thuyết KHTN 8 sách Chân trời sáng tạo hay, chi tiết tại:
Lý thuyết Bài 4: Định luật bảo toàn khối lượng và phương trình hoá học
Lý thuyết Bài 5: Mol và tỉ khối của chất khí
Lý thuyết Bài 6: Tính theo phương trình hoá học
Xem thêm các chương trình khác:
- Soạn văn lớp 8 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 8 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 8 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 8 - Chân trời sáng tạo
- Giải SBT Ngữ văn 8 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Chân trời sáng tạo
- Soạn văn 8 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 8 – Chân trời sáng tạo
- Lý thuyết Toán 8 – Chân trời sáng tạo
- Giải sbt Toán 8 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 8 – Friends Plus
- Giải sbt Tiếng Anh 8 - Friends plus
- Trọn bộ Từ vựng Tiếng Anh 8 Friends plus đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 8 Friends plus đầy đủ nhất
- Giải sgk Lịch sử 8 – Chân trời sáng tạo
- Lý thuyết Lịch sử 8 - Chân trời sáng tạo
- Giải sbt Lịch sử 8 – Chân trời sáng tạo
- Giải sgk Địa lí 8 – Chân trời sáng tạo
- Lý thuyết Địa lí 8 - Chân trời sáng tạo
- Giải sbt Địa lí 8 – Chân trời sáng tạo
- Giải sgk Giáo dục công dân 8 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 8 – Chân trời sáng tạo
- Giải sgk Công nghệ 8 – Chân trời sáng tạo
- Lý thuyết Công nghệ 8 - Chân trời sáng tạo
- Giải sbt Công nghệ 8 – Chân trời sáng tạo
- Giải sgk Tin học 8 – Chân trời sáng tạo
- Lý thuyết Tin học 8 - Chân trời sáng tạo
- Giải sbt Tin học 8 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 8 – Chân trời sáng tạo