Lý thuyết Amine – Hóa lớp 12 Kết nối tri thức
Với lý thuyết Hóa lớp 12 Bài 8: Amine chi tiết, ngắn gọn và bài tập tự luyện có lời giải chi tiết sách Kết nối tri thức sẽ giúp học sinh nắm vững kiến thức trọng tâm để học tốt môn Hóa 12.
Lý thuyết Hóa 12 Bài 8: Amine - Kết nối tri thức
A. Lý thuyết Amine
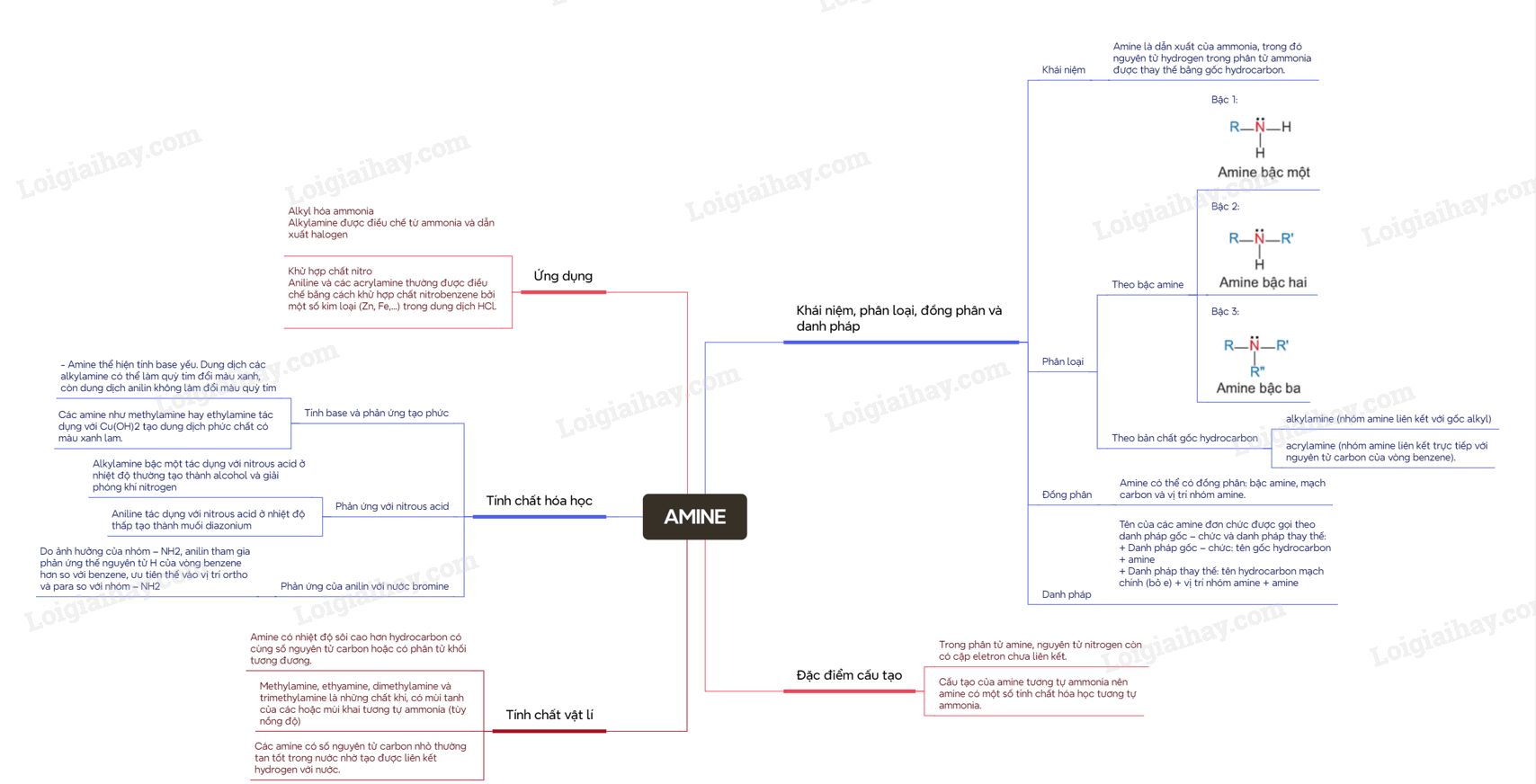
I. Khái niệm, phân loại, đồng phân và danh pháp
1. Khái niệm
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
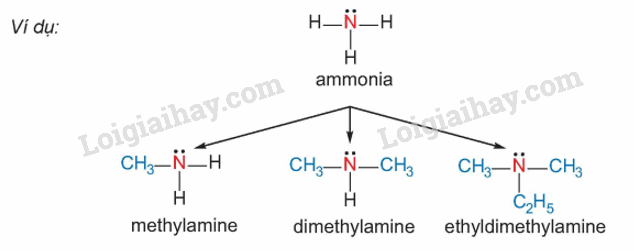
2. Phân loại
Amine thường được phân loại theo bậc của amine và bản chất gốc hydrocarbon
- Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
Theo đó được phân loại thành amine bậc một, amine bậc hai và amine bậc ba
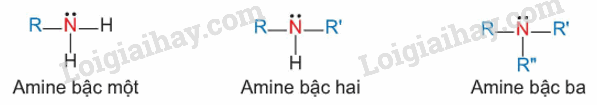
- Dựa trên đặc điểm cấu tạo của gốc hydrocaron, amine được phân thành nhiều loại, trong đó hai loại điểm hình là alkylamine (nhóm amine liên kết với gốc alkyl) và acrylamine (nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene).
3. Đồng phân
Các amine có từ hai nguyên tử carbon trong phân tử bắt đầu xuất hiện đồng phân. Amine có thể có đồng phân: bậc amine, mạch carbon và vị trí nhóm amine.
4. Danh pháp
Tên của các amine đơn chức được gọi theo danh pháp gốc – chức và danh pháp thay thế:
+ Danh pháp gốc – chức: tên gốc hydrocarbon + amine
+ Danh pháp thay thế: tên hydrocarbon mạch chính (bỏ e) + vị trí nhóm amine + amine
II. Đặc điểm cấu tạo
Hình dạng phân tử của methylamine và anilin được mô tả như sau:
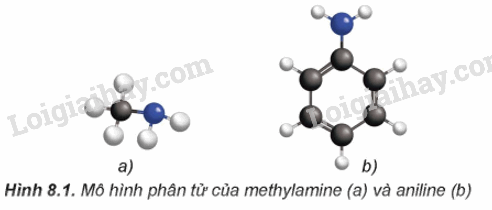
- Trong phân tử amine, nguyên tử nitrogen còn có cặp eletron chưa liên kết. Cấu tạo của amine tương tự ammonia nên amine có một số tính chất hóa học tương tự ammonia.
III. Tính chất vật lí
- Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
- Methylamine, ethyamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của các hoặc mùi khai tương tự ammonia (tùy nồng độ). Các amine có số nguyên tử carbon nhỏ thường tan tốt trong nước nhờ tạo được liên kết hydrogen với nước.
IV. Tính chất hóa học
1. Tính base và phản ứng tạo phức
- Amine thể hiện tính base yếu. Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh, còn dung dịch anilin không làm đổi màu quỳ tím
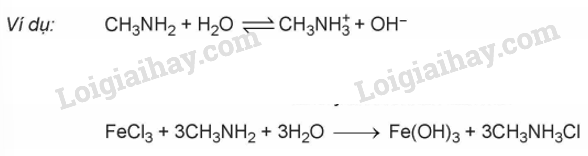
- Các amine như methylamine hay ethylamine tác dụng với Cu(OH)2 tạo dung dịch phức chất có màu xanh lam.
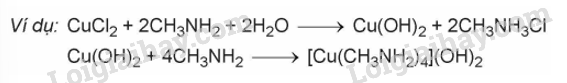
2. Phản ứng với nitrous acid
- Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng khí nitrogen (phản ứng này thường được dùng để nhận biết alkylamine bậc một)
Ví dụ: CH3NH2 + HONO CH3OH + N2 + H2O
- Aniline tác dụng với nitrous acid ở nhiệt độ thấp tạo thành muối diazonium
3. Phản ứng của anilin với nước bromine
- Do ảnh hưởng của nhóm – NH2, anilin tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene, ưu tiên thế vào vị trí ortho và para so với nhóm – NH2
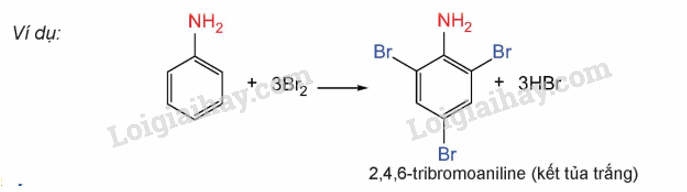
V. Ứng dụng
1. Alkyl hóa ammonia
Alkylamine được điều chế từ ammonia và dẫn xuất halogen
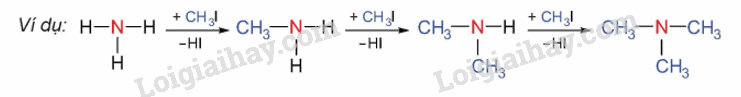
2. Khử hợp chất nitro
Aniline và các acrylamine thường được điều chế bằng cách khử hợp chất nitrobenzene bởi một số kim loại (Zn, Fe,…) trong dung dịch HCl.
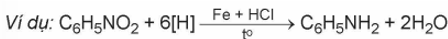
B. Trắc nghiệm Amine
Đang cập nhật …
C. Sơ đồ tư duy Amine
Xem thêm các chương trình khác:
- Soạn văn 12 Kết nối tri thức (hay nhất)
- Văn mẫu 12 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 12 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 12 - Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 12 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn 12 – Kết nối tri thức
- Giải sgk Toán 12 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 12 – Kết nối tri thức
- Lý thuyết Toán 12 – Kết nối tri thức
- Giải sbt Toán 12 – Kết nối tri thức
- Bài tập Tiếng Anh 12 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 12 - Global success
- Trọn bộ Từ vựng Tiếng Anh 12 Global success đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 12 Global success đầy đủ nhất
- Giải sbt Tiếng Anh 12 – Global Success
- Giải sgk Vật lí 12 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 12 – Kết nối tri thức
- Lý thuyết Vật lí 12 – Kết nối tri thức
- Giải sbt Vật lí 12 – Kết nối tri thức
- Giải sgk Sinh học 12 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 12 – Kết nối tri thức
- Lý thuyết Sinh học 12 – Kết nối tri thức
- Giải sbt Sinh học 12 – Kết nối tri thức
- Giải sgk Lịch sử 12 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 12 – Kết nối tri thức
- Giải sbt Lịch sử 12 – Kết nối tri thức
- Giải sgk Địa lí 12 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 12 – Kết nối tri thức
- Giải sbt Địa lí 12 – Kết nối tri thức
- Giải sgk Tin học 12 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 12 – Kết nối tri thức
- Giải sbt Tin học 12 – Kết nối tri thức
- Lý thuyết Tin học 12 - Kết nối tri thức
- Giải sgk Công nghệ 12 – Kết nối tri thức
- Giải sgk Kinh tế pháp luật 12 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 12 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng 12 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 12 – Kết nối tri thức
