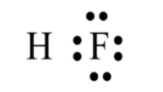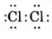Giáo án điện tử Liên kết cộng hóa trị | Bài giảng PPT Hóa 10 Cánh diều
Với Giáo án PPT Liên kết cộng hóa trị Hóa 10 sách Cánh diều sẽ giúp thầy cô dễ dàng biên soạn và giảng dạy bằng giáo án điện tử hay POWERPOINT Liên kết cộng hóa trị.
Chỉ 400k mua trọn bộ Giáo án Hóa 10 Cánh diều bản PPT (cả năm) đẹp mắt (Chỉ 40k cho 1 bài giảng bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu





Tài liệu có 36 trang, trên đây trình bày tóm tắt 5 trang của Giáo án POWERPOINT Liên kết cộng hóa trị Hóa 10 Cánh diều.
Giáo án Hóa 10 Bài 11 (Cánh diều): Liên kết cộng hóa trị (4 tiết)
I. MỤC TIÊU
1) Kiến thức
Học xong bài này, học sinh có thể:
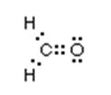
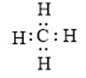
- Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc octet.
- Viết được công thức Lewis của một số chất đơn giản.
- Trình bày được khái niệm liên kết cho - nhận.
- Phân biệt được các loại liên kết (liên kết cộng hoá trị không phân cực, phân cực, liên kết ion) dựa theo độ âm điện.
- Giải thích được sự hình thành liên kết σ và liên kết π qua sự xen phủ AO.
- Trình bày được khái niệm năng lượng liên kết (cộng hóa trị).
- Lắp được mô hình phân tử một số chất.
2) Năng lực
a) Năng lực chung
- Năng lực tự chủ và tự học: học sinh xác định đúng đắn động cơ, thái độ học tập, tự đánh giá và điều chỉnh được kế hoạch học tập; tự nhận ra được những sai sót và khắc phục.
- Năng lực giao tiếp: tiếp thu kiến thức, trao đổi học hỏi bạn bè thông qua việc thực hiện nhiệm vụ các hoạt động cặp đôi, nhóm; có thái độ tôn trọng, lắng nghe, có phản ứng tích cực trong giao tiếp.
- Năng lực hợp tác: học sinh xác định được nhiệm vụ của tổ/ nhóm, trách nhiệm của bản thân, đề xuất được những ý kiến đóng góp, góp phần hoàn thành nhiệm vụ học tập.
b) Năng lực chuyên biệt
- Năng lực nhận thức hóa học:
+ Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc octet.
+ Viết được công thức Lewis của một số chất đơn giản.
+ Trình bày được khái niệm liên kết cho - nhận.
+ Phân biệt được các loại liên kết (liên kết cộng hoá trị không phân cực, phân cực, liên kết ion) dựa theo độ âm điện.
+ Giải thích được sự hình thành liên kết σ và liên kết π qua sự xen phủ AO.
+ Trình bày được khái niệm năng lượng liên kết (cộng hóa trị).
+ Lắp được mô hình phân tử một số chất.
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Thông qua hoạt động khai thác vốn kiến thức, kĩ năng đã học kết hợp thông tin trong SGK, HS tìm tòi khám phá được kiến thức, kĩ năng mới.
- Năng lực vận dụng kiến thức, kỹ năng đã học: Tự thiết kế được mô hình phân tử C2H4; C2Cl2 bằng các vật liệu dễ kiếm ….
3) Phẩm chất
- Yêu nước: nhận biết được vẻ đẹp của tự nhiên, của đất nước thông qua bộ môn Hóa học.
- Trách nhiệm: nghiêm túc thực hiện các nhiệm vụ học tập được giao đúng tiến độ.
- Trung thực: thành thật trong việc thu thập các tài liệu, viết báo cáo và các bài tập.
- Chăm chỉ: tích cực trong các hoạt động cá nhân, tập thể.
- Nhân ái: quan tâm, giúp đỡ, chia sẻ những khó khăn trong việc thực hiện nhiệm vụ học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- GV: Sưu tầm hình ảnh, nội dung có liên quan đến bài học, thiết kế phiếu học tập.
- HS: Ôn tập bài cũ và chuẩn bị bài mới.
III. TIẾN TRÌNH DẠY HỌC
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu: Tạo tình huống có vấn đề và tâm lý hứng thú cho HS khi bắt đầu bài học mới.
b) Nội dung:
HS làm việc cá nhân: Nhắc lại quy tắc octet. Viết công thức của N2 và nhận xét cách viết công thức có thể hiện được quy tắc octet hay không, từ đó liên hệ với liên kết cộng hoá trị.
c) Sản phẩm: Các câu trả lời của HS. HS có thể trả lời chưa đúng hoặc chưa chính xác, GV bổ sung và lưu ý cho HS về liên kết cộng hoá trị đã học.
d) Tổ chức thực hiện:
- GV sử dụng phương pháp đàm thoại gợi mở.
- GV gọi HS trả lời các câu hỏi:
(1) Nhắc lại quy tắc octet. Liên kết ion là gì? Liên kết cộng hoá trị là gì?
(2) Làm bài tập trong hoạt động mở đầu SGK của bài. Nhận xét kí hiệu trong công thức (1) và cặp electron chung trong công thức (2).
(3) Tương tự như vậy, em hãy biểu thị liên kết cộng hoá trị trong phân tử hợp chất HCl và CO2 đã học theo hai dạng công thức (1) và (2).
- Từ đó, HS xác định nhiệm vụ của bài học.
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC MỚI
|
Hoạt động 1: Liên kết cộng hóa trị Mục tiêu: + Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc octet. + Viết được công thức Lewis của một số chất đơn giản. + Trình bày được khái niệm liên kết cho - nhận. |
||||||||||||||||
|
Hoạt động của GV và HS |
Sản phẩm dự kiến |
|||||||||||||||
|
GV: Các nguyên tử khi tham gia hình thành liên kết ngoài việc nhường hoặc nhận electron tạo nên kiểu liên kết ion thì còn hình thành nên một loại liên kết bằng việc góp chung electron giữa hai nguyên tử tham gia liên kết nhằm thỏa mãn quy tắc octet (có cấu hình electron lớp ngoài cùng giống như nguyên tử khí hiếm). Giao nhiệm vụ học tập: GV chia lớp làm 4 nhóm, hoàn thành phiếu học tập sau: |
Phiếu bài tập số 1:
|
|||||||||||||||
………………………………………….
………………………………………….
………………………………………….
Xem trước và mua tài liệu:
Xem thêm các chương trình khác:
- Giáo án Toán 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Hóa 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Vật lí 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Sinh học 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Lịch sử 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Địa lí 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Tin học 10 Kết nối tri thức năm 2023 (mới nhất)
- Giáo án Kinh tế pháp luật 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Chuyên đề KTPL 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Công nghệ 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án Tiếng Anh 10 Global Success năm 2024 (mới nhất)
- Giáo án Giáo dục quốc phòng 10 Kết nối tri thức năm 2024 (mới nhất)
- Giáo án PPT Tiếng Anh 10 Global success
- Giáo án PPT Toán 10 Kết nối tri thức
- Giáo án PPT Vật lí 10 Kết nối tri thức
- Giáo án PPT Hóa 10 Kết nối tri thức
- Giáo án Ngữ Văn 10 Kết nối tri thức (mới nhất)
- Giáo án Toán 10 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Hóa 10 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Vật lí 10 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Sinh học 10 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Lịch sử 10 Chân trời sáng tạo năm 2024 (mới nhất)
- Giáo án Tiếng Anh 10 Friends Global năm 2024 (mới nhất)
- Giáo án Ngữ Văn 10 Chân trời sáng tạo (mới nhất)