Các dạng bài tập Hóa học lớp 9 Học kì 1
Tổng hợp các dạng bài tập Hóa học lớp 9 Học kì 1 gồm các dạng Hóa học từ cơ bản đến nâng cao với phương pháp giải chi tiết giúp học sinh nắm vững kiến thức từ đó biết cách giải bài tập Hóa học 9.
Các dạng bài tập Hóa học lớp 9 Học kì 1
Các dạng bài tập Các loại hợp chất vô cơ
Bài tập chuỗi phản ứng hóa học hợp chất vô cơ và cách giải
Bài tập nhận biết và phân biệt các chất vô cơ và cách giải
Bài tập Oxit bazơ tác dụng với axit và cách giải
Bài tập oxit axit tác dụng với bazơ và cách giải
Bài tập axit tác dụng với bazơ và cách giải
Bài tập muối tác dụng với muối và cách giải
Bài tập muối tác dụng với axit và cách giải
Bài tập muối tác dụng với bazơ và cách giải
Bài tập tổng hợp phản ứng trao đổi hóa vô cơ và cách giải
Bộ câu hỏi trắc nghiệm lý thuyết kim loại chọn lọc, có đáp án
Bài tập về dãy hoạt động của kim loại và cách giải
Bài tập kim loại tác dụng với axit và cách giải
Bài tập kim loại tác dụng với muối và cách giải
Bài tập kim loại tác dụng với nước và cách giải
Bài tập tổng hợp nhôm và sắt và cách giải
Bài tập chuỗi phản ứng hóa học hợp chất vô cơ và cách giải - Hóa lớp 9
I. Lý thuyết và phương pháp giải
Dạng bài này gồm một chuỗi các phản ứng hóa học nên yêu cầu học sinh phải nắm chắc sơ đồ, cũng như mối liên hệ giữa các hợp chất vô cơ, cụ thể:
a/ Sơ đồ các loại hợp chất vô cơ:
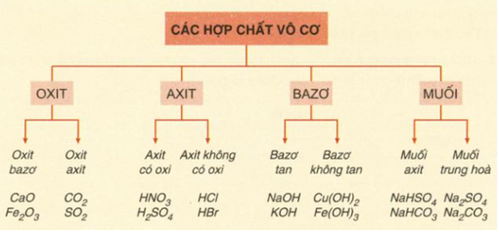
b/ Sơ đồ mối liên hệ giữa các chất vô cơ:
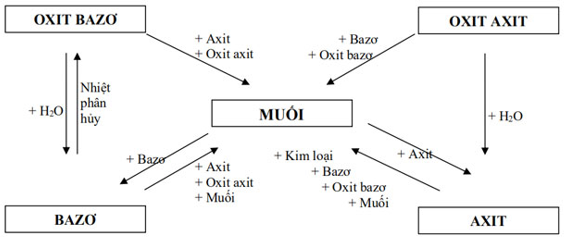
Các bước hoàn thành chuỗi phản ứng:
- Bước 1: Xác định chính xác các chất trong chuỗi (nếu chuỗi phản ứng hóa học ẩn chất).
- Bước 2: Viết phương trình phản ứng hóa học.
II. Ví dụ minh họa
Ví dụ 1: Hoàn thành chuỗi phản ứng sau:
SO2 → SO3 → H2SO4 → ZnSO4 → Zn(OH)2 → ZnO
Hướng dẫn giải:
1) 2SO2 + O2 2SO3
2) SO3 + H2O → H2SO4
3) H2SO4 +Zn → ZnSO4 + H2
4) ZnSO4 dư + 2NaOH → Zn(OH)2 ↓ + Na2SO4
5) Zn(OH)2 ZnO + H2O
Ví dụ 2: Hoàn thành chuỗi phản ứng sau và viết phương trình phản ứng hóa học:
Hướng dẫn giải:
Các chất A, B, C lần lượt là :
Các phương trình phản ứng hóa học:
(1) 2Ca + O2 2CaO
(2) CaO + H2O → Ca(OH)2
(3) Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
III. Bài tập tự luyện
Bài 1:
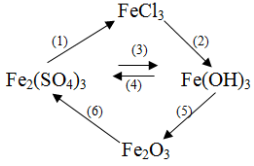
Viết phương trình phản ứng hóa học cho chuỗi phản ứng trên.
Hướng dẫn giải:
(1) Fe2(SO4)3 + 3BaCl2 → 3BaSO4 ↓ + 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
(3) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
(4) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
(5) 2Fe(OH)3 Fe2O3 + 3H2O
(6) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Bài 2: Hoàn thành chuỗi phản ứng sau:
Na → Na2O → NaOH → Na2CO3 → NaCl → NaOH → NaHCO3
Hướng dẫn giải:
1) 4Na + O2 2Na2O
2) Na2O + H2O → 2NaOH
3) 2NaOH + CO2 → Na2CO3 + H2O
4) Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
5) 2NaCl + H2O 2NaOH + H2 + Cl2
6) NaOH + CO2 → NaHCO3
Bài 3: Viết phương trình phản ứng hóa học cho chuỗi phản ứng sau:
MgCO3 → MgSO4 → MgCl2 → Mg(OH)2 → MgO → MgSO4.
Hướng dẫn giải:
(1) MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
(2) MgSO4 + BaCl2 → MgCl2 + BaSO4↓
(3) MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl
(4) Mg(OH)2 MgO + H2O
(5) MgO + H2SO4 → MgSO4 + H2O
Bài 4:
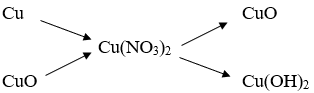
Viết phương trình phản ứng hóa học cho chuỗi phản ứng trên.
Hướng dẫn giải:
(1) Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
(2) CuO + 2HNO3 → Cu(NO3)2 + H2O
(3) 2Cu(NO3)2 2CuO + 4NO2 + O2
(4) Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Bài 5:
FeS2 + O2 A + B
A + O2 C
C + D → Axit E
E + Cu → F + A + D
A + D → Axit G
Xác định A, B, C, D, E, F, G và hoàn thành các phương trình phản ứng hóa học trên.
Hướng dẫn giải:
(1) 4FeS2 + 11O2 8SO2 + 2Fe2O3
(2) 2SO2 + O2 2SO3
(3) SO3 + H2O → H2SO4
(4) 2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
(5) SO2 + H2O → H2SO3
A: SO2
B: Fe2O3
C: SO3
D: H2O
E: H2SO4
F: CuSO4
G: H2SO3
Bài 6:
? + ? → CaCO3 ↓ + ?
Al2O3 + H2SO4 → ? + ?
NaCl + ? → ? + ? + NaOH
KHCO3 + Ca(OH)2 → ? + ? + ?
Hướng dẫn giải:
(1) Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
(2) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
(3) 2NaCl + 2H2O 2NaOH + H2 + Cl2
(4) 2KHCO3 + Ca(OH)2 → CaCO3↓ + K2CO3 + 2H2O
Bài 7: Viết phương trình phản ứng hóa học cho chuối phản ứng sau:
Al → Al2O3 → NaAlO2 →Al(OH)3 → Al2(SO4)3 → AlCl3→ Al(NO3)3
Hướng dẫn giải:
1) 4Al + 3O2 2Al2O3
2) Al2O3 + 2NaOH → 2NaAlO2 + H2O
3) 2NaAlO2 + CO2 + 3H2O → Na2CO3 + 2Al(OH)3↓
4) 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
5) Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4↓
6) AlCl3 + 3AgNO3 → Al(NO3)3 + 3AgCl↓
Bài 8: Hoàn thành sơ đồ phản ứng sau:
MnO2 Cl2 HCl X FeCl2 + FeCl3
Hướng dẫn giải:
1) MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
(2) Cl2 + H2 2HCl(k)
(3) HCl (k) + H2O → dd HCl
(4) 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
B: H2
C: Fe3O4
X: HCl
Bài 9: Thay các chữ cái bằng các công thức hóa học thích hợp và hoàn thành các phản ứng sau:
A + H2SO4 → B + SO2 + H2O
B + NaOH → C + Na2SO4
C → D + H2O
D + H2 → A + H2O
A + E → Cu(NO3)2 + Ag
Hướng dẫn giải:
A: Cu
B: CuSO4
C: Cu(OH)2
D: CuO
E: AgNO3
Phương trình phản ứng hóa học:
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Cu(OH)2 CuO + H2O
CuO + H2 Cu + H2O
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Bài 10: Bổ túc và hoàn thành phương trình phản ứng:
A → B + CO2
B + H2O → C
C + CO2 → A + H2O
A + H2O + CO2 → D
D A + H2O + CO2
Hướng dẫn giải:
A: CaCO3
B: CaO
C: Ca(OH)2
D: Ca(HCO3)2
Phương trình phản ứng hóa học:
CaCO3 CaO + CO2
CaO + H2O → Ca(OH)2
Ca(OH)2 + CO2 → CaCO3 + H2O
CaCO3+ H2O + CO2 → Ca(HCO3)2
Ca(HCO3)2 CaCO3 + H2O + CO2
..........
Bộ câu hỏi trắc nghiệm lý thuyết kim loại chọn lọc, có đáp án - Hóa lớp 9
Bài 1: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al)
B. Bạc (Ag)
C. Đồng (Cu)
D. Sắt (Fe)
Bài 2: Trong các kim loại sau đây, kim loại có nhiệt độ nóng chảy cao nhất là:
A. Đồng (Cu)
B. Sắt (Fe)
C. Kẽm (Zn)
D. Vonfam (W)
Bài 3: Kim loại nào sau đây nhẹ nhất (có khối lượng riêng nhỏ nhất)?
A. Kali (K)
B. Na (Natri)
C. Liti (Li)
D. Rubiđi (Rb)
Bài 4: Kim loại được dùng làm vật liệu chế tạo vỏ máy bay do có tính bền và nhẹ, đó là kim loại:
A. Na
B. Zn
C. Al
D. K
Bài 5: Các kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là các kim loại:
A. Ag, Al.
B. Au, Ag.
C. Au, Cu.
D. Cu, Al.
Bài 6: Đơn chất tác dụng với dung dịch H2SO4 loãng giải phóng khí hiđro là:
A. Đồng
B. Lưu huỳnh
C. Bạc
D. Sắt
Bài 7: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Al, Mg
Bài 8: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. Ca, Al, Mg, Cu, Fe
B. Cu, Fe, Mg, Al, Ca
C. Ca, Cu, Al, Mg, Fe
D. Cu, Fe, Al, Mg, Ca
Bài 9: Từ Cu và hoá chất nào dưới đây để điều chế được CuSO4?
A. H2SO4 đặc, nóng
B. Al2(SO4)3
C. H2SO4 loãng
D. MgSO4
Bài 10: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4, có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn
B. Mg
C. Fe
D. Cu
Bài 11: Để làm sạch một mẫu đồng kim loại có lẫn sắt kim loại và kẽm kim loại có thể ngâm mẫu đồng vào dung dịch
A. FeCl2 dư
B. ZnCl2 dư
C.CuCl2 dư
D. AlCl3 dư
Bài 12: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al, Ag, Fe
B. Zn, Pb, Fe
C. Au, Fe, Ag
D. Fe, Na, Al
Bài 13: Hiện tượng xảy ra khi cho 1 thanh sắt vào dung dịch H2SO4 đặc nguội:
A. Không có hiện tượng
B. Thanh sắt tan dần
C. Khí không màu và không mùi thoát ra
D. Khí có mùi hắc thoát ra
Bài 14: Kim loại vừa tác dụng với dung dịch HCl vừa tác dụng được với dung dịch KOH:
A. Fe, Al
B. Ag, Zn
C. Al, Cu
D. Al, Zn
Bài 15: Có hỗn hợp kim loại gồm Fe, Cu, Ag có thể thu được Ag tinh khiết bằng cách sau:
A. Hoà tan hỗn hợp vào dung dịch HCl.
B. Hoà tan hỗn hợp kim loại vào dung dịch AgNO3.
C. Hoà tan hỗn hợp vào HNO3 đặc nguội.
D. Dùng nam châm tách Fe và Cu ra khỏi Ag.
Bài 16: Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hidro:
A. Ba, Ca
B. Zn, Al
C. Mg, Ca
D. Cu, Ba
Bài 17: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Bài 18: Cho các kim loại Fe, Cu, Ag, Al, Mg. Kết luận nào sau đây là SAI:
A. Kim loại không tác dụng với H2SO4 đặc, nguội Al, Fe.
B. Kim loại tác dụng với dung dịch H2SO4 loãng, HCl: Cu, Ag
C. Kim loại tác dụng với dung dịch NaOH là Al
D. Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên.
Bài 19 : Lấy một ít bột Fe cho vào dung dịch HCl vừa đủ rồi nhỏ từ từ dung dịch NaOH đến dư vào dung dịch. Hiện tượng xảy ra là:
A. Ban đầu có khí thoát ra và có kết tủa trắng xanh rồi chuyển dần thành màu nâu đỏ.
B. Không thấy hiện tượng gì.
C. Có khí bay ra và dung dịch có màu xanh lam.
D. Có khí thoát ra và tạo kết tủa màu xanh đến khi kết thúc.
Bài 20 : Hiện tượng xảy ra khi đốt sắt trong bình khí clo là:
A. Khói màu trắng sinh ra.
B. Xuất hiện những tia sáng chói.
C. Tạo chất bột trắng bám xung quanh thành bình.
D. Có khói màu nâu đỏ tạo thành.
Đáp án minh họa
|
1B |
2D |
3C |
4C |
5B |
6D |
7A |
8D |
9A |
10B |
|
11C |
12B |
13A |
14D |
15B |
16A |
17D |
18B |
19A |
20D |
Bài tập về dãy hoạt động của kim loại và cách giải - Hóa lớp 9
I. Lý thuyết và phương pháp giải
Bằng nhiều thí nghiệm khác nhau, người ta sắp xếp các kim loại thành dãy theo chiều giảm dần mức độ hoạt động hóa học.
- Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
- Ý nghĩa của dãy hoạt động hóa học của kim loại:
Dãy hoạt động hóa học của kim loại cho biết:
+ Mức độ hoạt động hóa học của kim loại giảm dần từ trái sang phải.
+ Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng H2.
Ví dụ:
2K + 2H2O → 2KOH + H2 (↑)
Ba + 2H2O → Ba(OH)2 + H2 (↑)
+ Kim loại đứng trước H tác dụng với một số dung dịch axit (HCl, H2SO4 loãng,…) sinh ra khi H2.
Ví dụ:
Mg + 2HCl → MgCl2 + H2 (↑)
Mg + H2SO4 → MgSO4 + H2 (↑)
+ Kim loại đứng trước (trừ K, Na, Ba, Ca … hay trừ các kim loại tác dụng với nước ở điều kiện thường) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Ví dụ:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (↓)
Lưu ý: Khi cho kim loại tan trong nước (K, Na, Ca, Ba…) tác dụng với dung dịch muối, phương trình phản ứng hóa học xảy ra như sau:
Ví dụ: Cho Na tác dụng với dung dịch FeSO4
2Na + 2H2O → 2NaOH + H2 (↑)
2NaOH + FeSO4 → Fe(OH)2 (↓) + Na2SO4
- Gợi ý cách học thuộc, dễ nhớ dãy hoạt động hóa học của một số kim loại:
Khi (K) Nào (Na) Bạn (Ba) Cần (Ca) Mua (Mg) Áo (Al) Záp (Zn) Sắt (Fe) Nhớ (Ni) Sang (Sn) Phố (Pb) Hỏi (H) Cửa (Cu) Hàng (Hg) Á (Ag) Phi (Pt) Âu (Au)
II. Ví dụ minh họa
Ví dụ 1: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
Hướng dẫn giải:
Đồng là một kim loại đứng sau Hiđro trong dãy hoạt động hóa học của kim loại.
Đồng không phản ứng với dung dịch H2SO4.
Không có hiện tượng gì xảy ra.
Ví dụ 2: Nhúng thanh sắt có khối lượng 50 gam vào 400ml dung dịch CuSO4. Sau một thời gian khối lượng thanh sắt tăng 2 gam. (Giả sử đồng sinh ra đều bám vào thanh sắt)
a. Xác định lượng Cu sinh ra.
b. Tính nồng độ mol/l của dung dịch sắt(II) sunfat tạo thành. Giả sử thể tích dung dịch không thay đổi.
Hướng dẫn giải:
Do sắt đứng trước đồng trong dãy hoạt động hóa học của kim loại Sắt có thể đẩy đồng ra khỏi dung dịch muôi.
Đặt: nFe = x mol
Phương trình phản ứng hóa học:
mthanh sắt tăng = mCu sinh ra – mFe phản ứng = 64x – 56x= 2g x = 0,25
a/ mCu sinh ra = 0,25.64 = 16g
b/ = x = 0,25 mol
= 0,25 : 0,4 = 0,625M
III. Bài tập tự luyện
Bài 1: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Al, Mg
Bài 2: Kim loại nào dưới đây làm sạch được một mẫu dung dịch Zn(NO3)2 lẫn Cu(NO3)2 và AgNO3 ?
A. Zn
B. Cu
C. Fe
D. Pb
Bài 3: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư , thấy thoát ra 4,48 lít khí hidro (ở đktc). Vậy kim loại M là :
A. Ca
B. Mg
C. Fe
D. Ba
Bài 4: Có 4 kim loại X, Y, Z, T đứng sau Mg trong dãy hoạt động hóa học. Biết Z và T tan trong dung dịch HCl, X và Y không tan trong dung dịch HCl , Z đẩy được T trong dung dịch muối T, X đẩy được Y trong dung dịch muối Y. Thứ tự hoạt động hóa học của kim loại tăng dần như sau:
A. T, Z, X, Y
B. Z, T, X, Y
C. Y, X, T, Z
D. Z, T, Y, X
Bài 5: Cho 5,4 gam nhôm vào dung dịch HCl dư, thể tích khí thoát ra (ở đktc) là:
A. 4,48 lít
B. 6,72 lít
C. 13,44 lít
D. 8,96 lít
Bài 6: Cho lá đồng vào dung dịch AgNO3, sau một thời gian lấy lá đồng ra cân lại khối lượng lá đồng thay đổi như thế nào ?
A. Tăng so với ban đầu
B. Giảm so với ban đầu
C. Không tăng, không giảm so với ban đầu
D. Giảm một nửa so với ban đầu
Bài 7: Cho 1 viên Natri vào dung dịch CuSO4, hiện tượng xảy ra:
A. Viên Natri tan dần, sủi bọt khí, dung dịch không đổi màu
B. Viên Natri tan dần,không có khí thoát ra, có kết tủa màu xanh lam
C. Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh lam
D. Không có hiện tượng .
Bài 8: Hoà tan hoàn toàn 32,5 gam một kim loại M (hoá trị II) bằng dung dịch H2SO4 loãng được 11,2 lít khí hiđro (ở đktc). M là
A. Zn
B. Fe
C. Mg
D. Cu
Bài 9: Ngâm 1 lá Zn vào dung dịch CuSO4 sau 1 thời gian lấy lá Zn ra thấy khối lượng dung dịch tăng 0,2g. Vậy khối lượng Zn phản ứng là
A. 0,2 g
B. 13 g
C. 6,5 g
D. 0,4 g
Bài 10: Cho 10 gam hỗn hợp gồm Al và Cu vào dung dịch HCl dư thấy thoát ra 6,72 lít khí hidro (ở đktc). Phần trăm của nhôm trong hỗn hợp là:
A. 81 %
B. 54 %
C. 27 %
D. 40 %
Đáp án tham khảo
|
1A |
2A |
3B |
4C |
5B |
6A |
7C |
8A |
9B |
10B |
Xem thêm các chương trình khác:
- Giải sgk Hóa học 9
- Giải sbt Hóa học 9
- Giải vở bài tập Hóa học 9
- Lý thuyết Hóa học 9
- Các dạng bài tập Hóa học lớp 9
- Tóm tắt tác phẩm Ngữ văn 9
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9
- Soạn văn 9 (ngắn nhất)
- Văn mẫu lớp 9
- Tác giả - tác phẩm Ngữ văn 9
- Giải sgk Toán 9
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Bài tập Tiếng Anh 9 theo Unit có đáp án
- Giải sgk Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Góp ý sgk lớp 9 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi vào 10 môn Toán | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Toán mới nhất
- Đề thi vào 10 môn Địa lí
- Đề thi vào 10 môn Văn | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Ngữ Văn mới nhất
- Đề thi vào 10 môn Tiếng Anh | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Tiếng Anh mới nhất
- Lý thuyết Công nghệ 9
