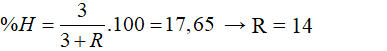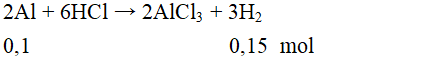TOP 15 Đề thi Học kì 1 Hóa học 9 năm 2023 có đáp án
Bộ 15 Đề thi Học kì 1 Hóa học lớp 9 có đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 9 Học kì 1. Mời các bạn cùng đón xem:
Chỉ từ 270k mua trọn bộ Đề thi Học kì 1 Hóa học 9 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi Học kì 1 Hóa học lớp 9 năm 2023 có đáp án
Bài giảng Hóa học lớp 9 Ôn tập học kì 1
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 1
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg =24, Ca = 40, P = 31, Cl = 35,5, F = 9, Si =27, N = 14, S = 32)
Câu 1: Công thức hoá học của sắt(III) oxit là:
A. Fe2O3.
B. Fe3O4.
C. FeO.
D. Fe3O2.
Câu 2: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC. Công thức hoá học của oxit là:
A. P2O3.
B. P2O5.
C. PO2.
D. P2O4.
Câu 3: Khí CO bị lẫn tạp chất là khí CO2. Cách làm nào sau đây có thể thu được CO tinh khiết?
A. Dẫn hỗn hợp qua dung dịch Ca(OH)2 dư.
B. Dẫn hỗn hợp qua dung dịch PbCl2 dư
C. Dẫn hỗn hợp qua NH3.
D. Dẫn hỗn hợp qua dung dịch Cu(NO3)2.
Câu 4: Tính chất hóa học của oxit axit là
A. tác dụng với nước.
B. tác dụng với dung dịch bazơ.
C. tác dụng với một số oxit bazơ.
D. cả 3 đáp án trên.
Câu 5: Oxit nào sau đây phản ứng với nước ở điều kiện thường?
A. Al2O3.
B. CuO.
C. Na2O.
D. MgO.
Câu 6: Sản phẩm của phản ứng phân hủy canxi cacbonat bởi nhiệt là:
A. CaO và CO
B. CaO và CO2
C. CaO và SO2
D. CaO và P2O5
Câu 7: Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Câu 8: MgCO3 tác dụng với dung dịch HCl sinh ra:
A. Chất khí cháy được trong không khí
B. Chất khí làm vẫn đục nước vôi trong.
C. Chất khí duy trì sự cháy và sự sống.
D. Chất khí không tan trong nước.
Câu 9: Cho phản ứng: BaCO3 + 2X → H2O + Y + CO2
X và Y lần lượt là:
A. H2SO4 và BaSO4
B. HCl và BaCl2
C. H3PO4 và Ba3(PO4)2
D. H2SO4 và BaCl2
Câu 10: Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric loãng. Thể tích khí hiđro thu được ở đktc là:
A. 44,8 lít
B. 4,48 lít
C. 2,24 lít
D. 22,4 lít
Câu 11: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
A. 0,896 lít
B. 0,448 lít
C. 8,960 lít
D. 4,480 lít
Câu 12: Muốn pha loãng axit sunfuric đặc ta phải:
A. Rót nước vào axit đặc.
B. Rót từ từ nước vào axit đặc.
C. Rót nhanh axit đặc vào nước.
D. Rót từ từ axit đặc vào nước.
Câu 13: Để nhận biết dung dịch axit sunfuric và dung dịch axit clohiđric ta dùng thuốc thử:
A. NaNO3.
B. KCl.
C. MgCl2.
D. BaCl2.
Câu 14: Trung hoà 200g dung dịch HCl 3,65% bằng dung dịch KOH 1M. Thể tích dung dịch KOH cần dùng là:
A. 100 ml
B. 300 ml.
C. 400 ml.
D. 200 ml.
Câu 15: Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư là:
A. Mẩu Mg tan dần, không có bọt khí thoát ra
B. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu
C. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được có màu xanh lam
D. Không xảy ra hiện tượng gì
Câu 16: Cặp chất không tồn tại trong một dung dịch (chúng xảy ra phản ứng với nhau) là
A. CuSO4 và KOH
B. CuSO4 và NaCl
C. MgCl2 và Ba(NO3)2
D. AlCl3 và Mg(NO3)2
Câu 17: Sục 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
A. NaHCO3
B. Na2CO3
C. Na2CO3 và NaOH
D. NaHCO3 và NaOH
Câu 18: Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Câu 19: Muối kali nitrat (KNO3):
A. không tan trong trong nước.
B. tan rất ít trong nước.
C. tan nhiều trong nước.
D. không bị phân huỷ ở nhiệt độ cao.
Câu 20: Để nhận biết 2 loại phân bón hoá học là: NH4NO3 và NH4Cl. Ta dùng dung dịch:
A. KOH
B. Ca(OH)2
C. AgNO3
D. BaCl2
Câu 21: Các loại phân bón hóa học đều là những hóa chất có chứa:
A. các nguyên tố dinh dưỡng cần thiết cho cây trồng.
B. nguyên tố nitơ và một số nguyên tố khác.
C. nguyên tố photpho và một số nguyên tố khác.
D. nguyên tố kali và một số nguyên tố khác.
Câu 22: Kim loại ở trạng thái lỏng ở điều kiện thường là
A. Na.
B. Rb.
C. Hg.
D. Mn.
Câu 23: Tính chất hóa học chung của kim loại gồm:
A. Tác dụng với phi kim, tác dụng với axit.
B. Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
C. Tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
D. Tác dụng với oxit bazơ, tác dụng với axit.
Câu 24: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al, Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe, Ag
D. Na, Mg, Al
Câu 25: Cho dây nhôm vào trong ống nghiệm chứa dung dịch nào sẽ có phản ứng hóa học xảy ra?
A. CuSO4.
B. Na2SO4.
C. MgSO4.
D. K2SO4.
Câu 26: Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính:
A. dẻo
B. dẫn điện
C. dẫn nhiệt
D. ánh kim
Câu 27: Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%.
B. 4,0%.
C. 23,0%.
D. 5,8%.
Câu 28: Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với
A. Cl2.
B. dung dịch HCl.
C. O2.
D. S.
Câu 29: Gang và thép là hợp kim của Fe. Tìm phát biểu đúng.
A. Gang là hợp kim Fe – C (5% đến 10%).
B. Nguyên tắc sản suất gang là khử Fe trong oxit bằng CO, H2 hay Al ở nhiệt độ cao.
C. Nguyên tắc sản xuất thép là oxi hoá các tạp chất trong gang (C, Si, Mn, S, P) thành oxit nhằm giảm hàm lượng của chúng.
D. Thép là hợp kim Fe – C (2% đến 5%).
Câu 30: Các dụng cụ như: cuốc, xẻng, dao, búa,… khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích
A. thể hiện tính cẩn thận của người lao động.
B. làm các thiết bị không bị gỉ.
C. để cho mau bén.
D. để sau này bán lại không bị lỗ.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1A |
2B |
3A |
4D |
5C |
6B |
7A |
8B |
9B |
10B |
|
11A |
12D |
13D |
14D |
15B |
16A |
17B |
18A |
19C |
20C |
|
21A |
22C |
23A |
24A |
25D |
26A |
27B |
28C |
29C |
30B |
Công thức hoá học của sắt(III) oxit là Fe2O3
Đối với các đáp án còn lại:
B. Fe3O4 oxit sắt từ.
C. FeO sắt(II) oxit
D. Fe3O2 công thức sai
Câu 2: Đáp án B
Đặt công thức hóa học của oxit là PxOy.
Theo bài ra: 31x + 16y = 142 (1)
%mP = 43,66%
→
→ x = 2
Thay x = 2 vào (1) được y = 5.
Vậy công thức hóa học của oxit là P2O5.
Câu 3: Đáp án A
Dẫn hỗn hợp khí qua bình đựng dung dịch Ca(OH)2 dư; CO2 phản ứng bị giữ lại trong bình, CO không phản ứng thoát ra khỏi bình thu được CO tinh khiết.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 4: Đáp án D
Oxit axit tác dụng với nước tạo thành dung dịch axit, tác dụng với dung dịch bazơ tạo thành muối và nước, tác dụng với oxit bazơ tạo thành muối.
Câu 5: Đáp án C
Na2O tác dụng với nước ở điều kiện thường. Phương trình phản ứng:
Na2O + H2O → 2NaOH
Câu 6: Đáp án B
Phản ứng phân hủy canxi cacbonat bởi nhiệt là
CaCO3 CaO + CO2
Câu 7: Đáp án A
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
→ Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Câu 8: Đáp án B
MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
CO2 là khí không cháy, không duy trì sự cháy, sự sống.
Khí CO2 tan ít trong nước và làm đục nước vôi trong theo phản ứng:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 9: Đáp án B
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
Câu 10: Đáp án B
nMg = 4,8 : 24 = 0,2 mol
Mg + H2SO4 → MgSO4 + H2
Theo phương trình:
= nMg = 0,2 mol
→ Vkhí = 0,2.22,4 = 4,48 lít.
Câu 11: Đáp án A
= 0,1.0,4 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3↓ + H2O
Từ phương trình → = = 0,04 mol
→ = 0,04.22,4 = 0,896 lít
Câu 12: Đáp án D
Muốn pha loãng axit sunfuric đặc ta phải rót từ từ axit đặc vào nước.
Không làm ngược lại vì axit sunfuric đặc bắn ra ngoài gây nguy hiểm.
Câu 13: Đáp án D
Dùng thuốc thử là dung dịch BaCl2.
BaCl2 + HCl → không phản ứng
BaCl2 + H2SO4 → BaSO4 (↓ trắng) + 2HCl
Câu 14: Đáp án D
→ nHCl = 7,3 : 36,5 = 0,2 mol
HCl + KOH → KCl + H2O
Theo phương trình: nKOH = nHCl = 0,2 mol
→ VKOH = lít = 200 ml
Câu 15: Đáp án B
Khi cho mẩu magie vào ống nghiệm chứa axit HCl dư mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu: Mg + 2HCl → MgCl2 + H2↑
Dung dịch MgCl2 thu được không có màu.
Câu 16: Đáp án A
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Câu 17: Đáp án B
= 2,24 : 22,4 = 0,1 mol
Từ phương trình hóa học ta có CO2 phản ứng vừa đủ với NaOH
→ Dung dịch chỉ chứa Na2CO3
Câu 18: Đáp án A
Thuốc thử để nhận biết Ca(OH)2 là Na2CO3.
Phản ứng tạo kết tủa trắng.
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
Câu 19: Đáp án C
Muối kali nitrat (KNO3) tan nhiều trong nước.
Câu 20: Đáp án C
Sử dụng AgNO3
+ Có kết tủa trắng → NH4Cl
NH4Cl + AgNO3 → AgCl (↓ trắng) + NH4NO3
+ Không có hiện tượng gì → NH4NO3
Câu 21: Đáp án A
Các loại phân bón hóa học đều là những hóa chất có chứa các nguyên tố dinh dưỡng cần thiết cho cây trồng. (đạm (N), lân (P), kali (K)
Câu 22: Đáp án C
Kim loại ở trạng thái lỏng ở điều kiện thường là thủy ngân (Hg).
Câu 23: Đáp án A
Tính chất hóa học chung của kim loại gồm tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
Câu 24: Đáp án A
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
→ Đáp án A thỏa mãn.
Câu 25: Đáp án D
Phương trình phản ứng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Câu 26: Đáp án A
Các kim loại có tính dẻo nên có thể dát mỏng.
Cây 27: Đáp án B
nNa = 2,3 : 23 = 0,1 mol
mdd = mNa + - = 2,3 + 97,8 – 0,05.2 = 100 gam
C% dung dịch NaOH = = 4%
Câu 28: Đáp án C
Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với O2
3Fe + 2O2 Fe3O4
Câu 29: Đáp án C
A sai vì: Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2-5%
B sai vì: Nguyên tắc sản xuất gang: dùng CO khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
D sai vì: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác (C, Mn, S, Si,…), trong đó hàm lượng cacbon chiếm dưới 2%.
Câu 30: Đáp án B
Các dụng cụ như: cuốc, xẻng, dao, búa,… khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích chính là làm các thiết bị không bị gỉ.
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 2
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg =24, Ca = 40, P = 31, Cl = 35,5, F = 9, Si =27, N = 14, S = 32)
Câu 1: Dãy chất đều là oxit bazơ:
A. SO2, K2O, Na2O
B. FeO, Cu2O, CO
C. SO2, P2O5, CO2
D. CuO, Na2O, BaO
Câu 2: Khí có tỉ khối đối với hiđro bằng 32 là:
A. N2O
B. SO2
C. SO3
D. CO2
Câu 3: Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3 , CO2 .
B. K2O, P2O5, CaO.
C. BaO, SO3, P2O5.
D. CaO, BaO, Na2O.
Câu 4: Để nhận biết 2 lọ mất nhãn đựng CaO và MgO ta dùng:
A. HCl
B. NaOH
C. HNO3
D. Quỳ tím ẩm
Câu 5: Cho 0,2 mol canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g
B. 22,2 g
C. 22,3 g
D. 23,2 g
Câu 6: Dung dịch nào sau đây có pH < 7:
A. NaCl
B. HCl
C. KOH
D. Ca(OH)2
Câu 7: Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?
A. Làm đổi màu quỳ tím và phenophtalein
B. Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước.
C. Tác dụng với oxit axit tạo thành muối và nước
D. Tác dụng với axit tạo thành muối và nước
Câu 8: Cặp chất nào sau đây phản ứng tạo ra dung dịch có màu vàng nâu?
A. Fe và dung dịch HCl.
B. CuO và dung dịch HNO3.
C. Fe(OH)3 và dung dịch H2SO4.
D. Fe(OH)2 và dung dịch H2SO4.
Câu 9: Dung dịch muối Pb(NO3)2 phản ứng với cả 2 kim loại nào:
A. Cu, Al
B. Fe, Al
C. Ag, Cu
D. Mg, Au
Câu 10: Để phân biệt 2 dung dịch: Na2SO4 và Na2SO3 người ta dùng dung dịch thuốc thử nào sau đây:
A. BaCl2
B. HCl
C. Pb(NO3)2
D. AgNO3
Câu 11: Trung hòa 200ml dung dịch H2SO4 0,1M bằng dung dịch NaOH 10%. Khối lượng dung dịch NaOH cần dùng là:
A. 6g
B. 8g
C. 10g
D. 16g
Câu 12: Cho sơ đồ sau: Cacbon → X1 → X2 → X3 → Ca(OH)2. Trong đó X1, X2, X3 lần lượt là:
A. CO2, CaCO3, CaO.
B. CO, CO2, CaCl2.
C. CO2, Ca(HCO3)2, CaO.
D. CO, CaO, CaCl2.
Câu 13: Bazơ tan và không tan có tính chất hoá học chung là:
A. Làm quỳ tím hoá xanh
B. Tác dụng với oxit axit tạo thành muối và nước
C. Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước.
Câu 14: Dung dịch tác dụng được với các dung dịch: Fe(NO3)2, CuCl2 là
A. Dung dịch NaOH
B. Dung dịch HCl
C. Dung dịch AgNO3
D. Dung dịch BaCl2
Câu 15: Muối kali nitrat (KNO3)
A. Không tan trong trong nước.
B. Tan rất ít trong nước.
C. Tan nhiều trong nước.
D. Không bị phân huỷ ở nhiệt độ cao.
Câu 16: Dãy phân bón hoá học chỉ chứa toàn phân bón hoá học đơn là:
A. KNO3, NH4NO3, (NH2)2CO
B. KCl, NH4H2PO4, Ca(H2PO4)2
C. (NH4)2SO4, KCl, Ca(H2PO4)2
D. (NH4)2SO4, KNO3, NH4Cl
Câu 17: X là kim loại nhẹ, dẫn điện tốt, phản ứng mạnh với dung dịch HCl, tan trong dung dịch kiềm và giải phóng H2. X là:
A. Fe
B. Mg
C. Cu
D. Al
Câu 18: Kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là các kim loại:
A. Ag, Cu.
B. Au, Pt.
C. Au, Al.
D. Ag, Al.
Câu 19: Các kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành kim loại đồng:
A. Al, Zn, Fe
B. Mg, Fe, Ag
C. Zn, Pb, Au
D. Na, Mg, Al
Câu 20: Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch H2SO4 loãng thu được 1,12 lít khí H2 ở đktc. Vậy X là kim loại nào sau đây:
A. Fe
B. Mg
C. Ca
D. Zn
Câu 21: Thứ tự mức độ hoạt động hóa học giảm dần của các kim loại là:
A. Mg, Na, Al, Fe.
B. Na, Mg, Al, Fe.
C. Na, Al, Mg, Fe.
D. Al, Mg, Fe, Na.
Câu 22: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4 , có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn
B. Mg
C. Fe
D. Cu
Câu 23: Hàm lượng sắt trong Fe3O4:
A. 70%
B. 72,41%
C. 46,66%
D. 48,27%
Câu 24: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng.
Câu 25: Hợp chất nào của nhôm dưới đây tan nhiều được trong nước?
A. Al2O3
B. Al(OH)3
C. AlCl3
D. Al3PO4
Câu 26: Cặp chất nào dưới đây có phản ứng?
A. Al + HNO3 đặc, nguội
B. Fe + HNO3 đặc, nguội
C. Al + HCl
D. Fe + Al2(SO4)3
Câu 27: Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là:
A. 1,8 g
B. 2,7 g
C. 4,05 g
D. 5,4 g
Câu 28: Fe phản ứng với cả 2 dung dịch nào sau đây:
A. NaOH, HCl
B. HCl, ZnCl2
C. HCl, CuSO4
D. KOH, MgCl2
Câu 29: Ngâm một lá sắt có khối lượng 20g vào dung dịch bạc nitrat, sau một thời gian phản ứng nhấc lá kim loại ra làm khô cân nặng 23,2g. Lá kim loại sau phản ứng có:
A. 18,88g Fe và 4,32g Ag
B. 1,880g Fe và 4,32g Ag
C. 15,68g Fe và 4,32g Ag
D. 18,88g Fe và 3,42g Ag
Câu 30: Phát biểu nào sau đây đúng?
A. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
B. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon lớn hơn 5%.
C. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
D. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm lớn hơn 5%.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
|
1D |
2B |
3D |
4D |
5B |
6B |
7B |
8C |
9B |
10B |
|
11D |
12A |
13C |
14A |
15C |
16C |
17D |
18B |
19A |
20D |
|
21B |
22B |
23B |
24C |
25C |
26C |
27B |
28C |
29A |
30A |
Câu 1: Đáp án D
A. Loại vì SO2 là oxit axit.
B. Loại vì CO là oxit trung tính.
C. Loại vì SO2, P2O5, CO2 đều là oxit axit.
D. Chọn vì CuO, Na2O, BaO đều là oxit bazơ.
Câu 2: Đáp án B
M khí = 32. = 32.2 = 64 đvC
= 14.2 + 16 = 44 đvC
= 32 + 16.2 = 64 đvC
= 32 + 16.3 = 80 đvC
= 12 + 16.2 = 44 đvC
Câu 3: Đáp án D
Tất cả các oxit trong các đáp án trên đều tác dụng được với nước.
Chỉ các oxit bazơ tác dụng được với HCl tạo muối và nước.
A. Loại vì SO3, CO2 không tác dụng với HCl.
B. Loại vì P2O5 không tác dụng với HCl.
C. Loại vì SO3, P2O5 không tác dụng với HCl.
Câu 4: Đáp án D
- Dùng quỳ tím ẩm để nhận biết hai oxit trên.
- Oxit làm quỳ tím ẩm hóa xanh là CaO.
Do CaO phản ứng với nước tạo dung dịch bazơ làm quỳ tím hóa xanh.
CaO + H2O → Ca(OH)2
- Oxit không làm đổi màu quỳ tím là MgO.
Do MgO không tác dụng với nước.
Câu 5: Đáp án B
nHCl = 0,5.1 = 0,5 mol
Xét tỉ lệ: → CaO hết, HCl dư.
→ = nCaO = 0,2 mol
→ = 0,2.111 = 22,2 gam
Câu 6: Đáp án B
pH của một dung dịch cho biết độ axit hoặc độ bazơ của dung dịch:
Trung tính: pH = 7
Tính axit: pH < 7
Tính bazơ: pH > 7
NaCl có pH = 7
KOH và Ca(OH)2 có pH > 7
HCl có pH < 7
Câu 7: Đáp án B
A. Dung dịch NaOH và KOH là dung dịch bazơ nên làm quỳ tím hóa xanh và làm dung dịch phenolphtalein hóa hồng.
B. Những bazơ không tan mới bị nhiệt phân hủy khi đun nóng. NaOH và KOH đều là những bazơ tan.
C. Dung dịch NaOH và KOH đều tác dụng với oxit axit tạo muối và nước.
Ví dụ:
SO2 + 2NaOH → Na2SO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
D. Dung dịch NaOH và KOH tác dụng với axit tạo thành muối và nước.
Ví dụ: NaOH + HCl → NaCl + H2O
KOH + HCl → KCl + H2O
Câu 8: Đáp án C
Muối sắt(III) có màu vàng nâu.
2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 (vàng nâu) + 6H2O
Câu 9: Đáp án B
Kim loại đứng trước Pb trong dãy hoạt động hóa học của kim loại có khả năng đẩy Pb ra khỏi muối.
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
2Al + 3Pb(NO3)2 → 2Al(NO3)3 + 3Pb
Câu 10: Đáp án B
Ta dùng HCl làm thuốc thử.
+ Tạo khí thoát ra là Na2SO3
2HCl + Na2SO3 → 2NaCl + SO2↑ + H2O
+ Không có hiện tượng gì là Na2SO4
Câu 11: Đáp án D
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Theo phương trình: nNaOH = 2.= 2.0,02 = 0,04 mol
→ mNaOH = 0,04.40 = 1,6 gam
→ m dung dịch NaOH = = 16 gam
Câu 12: Đáp án A
Mỗi mũi tên tương ứng với một phương trình phản ứng.
C + O2 CO2 (X1)
CO2 + CaO CaCO3 (X2)
CaCO3 CaO (X3) + CO2
CaO + H2O → Ca(OH)2 (X4)
Câu 13: Đáp án C
Bazơ tan và không tan có tính chất hoá học chung là tác dụng với axit tạo thành muối và nước.
Ví dụ:
NaOH + HCl → NaCl + H2O
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Câu 14: Đáp án A
Fe(NO3)2 + 2NaOH → Fe(OH)2↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Câu 15: Đáp án C
Muối kali nitrat (KNO3) tan nhiều trong nước (độ tan ở 20oC là 32g/100g H2O)
Câu 16: Đáp án C
- Phân bón hóa học đơn chỉ chứa một trong ba nguyên tố dinh dưỡng chính là đạm (N), lân (P), kali (K). (ví dụ: KNO3; NH4H2PO4)
- Phân bón kép có chứa hai hoặc cả ba nguyên tố dinh dưỡng N, P, K.
Câu 17: Đáp án D
Kim loại thỏa mãn là Al.
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Câu 18: Đáp án B
Au (vàng), Pt (bạch kim hay còn gọi là vàng trắng) thường được dùng làm đồ trang sức.
Ngoài ra Ag cũng thường được dùng làm đồ trang sức.
Câu 19: Đáp án A
Các kim loại hoạt động hóa học mạnh hơn đồng có thể đẩy đồng ra khỏi muối để tạo thành kim loại đồng.
B. Loại vì Ag yếu hơn Cu
C. Loại vì Au yếu hơn Cu.
D. Loại vì Na phản ứng với nước trong dung dịch trước.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + Cu(NO3)2 → Cu(OH)2↓ + 2NaNO3
Câu 20: Đáp án D
= 1,12 : 22,4 = 0,05 mol
M + 2HCl → MCl2 + H2
Theo phương trình: = nM = 0,05 mol
MM = đvC (Zn)
Vậy kim loại M là kẽm (Zn)
Câu 21: Đáp án B
Thứ tự mức độ hoạt động hóa học giảm dần của các kim loại là: Na, Mg, Al, Fe.
Lưu ý: Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
Mức độ hoạt động hóa học giảm dần theo chiều từ trái sang phải.
Câu 22: Đáp án B
Dùng kim loại Mg đẩy Zn ra khỏi muối.
Mg + ZnSO4 → MgSO4 + Zn
Lọc bỏ chất rắn thu được dung dịch MgSO4 tinh khiết.
Câu 23: Đáp án B
%mFe = % = 72,41%
Câu 24: Đáp án C
Đồng (Cu) không phản ứng với dung dịch HCl, H2SO4 loãng.
→ Không có hiện tượng gì.
Câu 25: Đáp án C
Muối nhôm AlCl3 tan được trong nước.
Câu 26: Đáp án C
Loại đáp án A, B vì Fe, Al, Cr,… không phản ứng với HNO3 đặc, nguội và
H2SO4 đặc, nguội
Loại đáp án D vì Fe là kim loại hoạt động yếu hơn Al nên không đẩy được Al ra khỏi muối.
Chọn đáp án C. Phương trình phản ứng xảy ra là:
2Al + 6HCl → 2AlCl3 + 3H2
Câu 27: Đáp án B
= 3,36 : 22,4 = 0,15 mol
2Al + 6HCl → 2AlCl3 + 3H2
Theo phương trình: nAl = .= .0,15 = 0,1 mol
→ mAl = 0,1.27 = 2,7 gam
Câu 28: Đáp án C
Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
Fe + CuSO4 → FeSO4 + Cu
Câu 29: Đáp án A
Gọi x là số mol của Fe tham gia phản ứng
Ta có: m tăng = 23,2 - 20 = 3,2
→ mAg – mFe = 108.2x – 56x = 3,2
→ x = 0,02
m Fe còn lại = 20 - 0,02.56 = 18,88 (g)
mAg = 0,04.108 = 4,32g
Câu 30: Đáp án A
Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
Đề thi Học kì 1 Hóa học lớp 9 năm 2022 - 2023 có đáp án đề số 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học 2022 - 2023
Môn: Hóa học
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Oxit bazơ không có tính chất hóa học nào sau đây?
A. Một số oxit bazơ tác dụng được với nước ở điều kiện thường.
B. Oxit bazơ tác dụng được với dung dịch axit.
C. Oxit bazơ tác dụng được với tất cả kim loại.
D. Một số oxit bazơ tác dụng được với oxit axit.
Câu 2: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit?
A. CO2
B. SO2
C. N2
D. O3
Câu 3: Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3.
B. BaO, K2O, SO2.
C. Al2O3, NO, SO2.
D. CaO, FeO, NO2.
Câu 4: Dẫn từ từ 3,136 lít khí CO2 (đktc) vào một dung dịch có hòa tan 12,8 gam NaOH sản phẩm thu được là muối Na2CO3. Khối lượng muối Na2CO3 thu được là:
A. 14,84 gam
B. 18, 96 gam
C. 16,96 gam
D. 16,44 gam
Câu 5: Cặp chất tác dụng với dung dịch axit clohiđric là
A. NaOH, BaCl2
B. NaOH, BaCO3.
C. NaOH, Ba(NO3)2.
D. NaOH, BaSO4.
Câu 6: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là:
A. Zn.
B. Mg.
C. Fe.
D. Ca.
Câu 7: Để nhận biết các dung dịch sau: H2SO4, NaOH, HCl, người ta dùng
A. quỳ tím và dung dịch BaCl2.
B. quỳ tím và dung dịch KOH.
C. phenolphtalein.
D. phenolphtalein và dung dịch NaCl.
Câu 8: Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl
B. Nước vôi trong
C. Dung dịch HCl
D. Dung dịch NaNO3
Câu 9: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được 2 dung dịch muối trong mỗi cặp chất sau:
A. Na2SO4 và Fe2(SO4)3
B. Na2SO4 và K2SO4
C. Na2SO4 và BaCl2
D. Na2CO3 và K3PO4
Câu 10: Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 8 g
B. 4 g
C. 6 g
D. 12 g
Câu 11: Cho những phân bón có công thức: KNO3, NH4NO3, Ca(H2PO4)2, CO(NH2)2, (NH4)HPO4, KCl, NH4Cl. Số phân bón đơn là:
A. 5
B. 4
C. 3
D. 2
Câu 12: Phát biểu nào sau đây sai?
A. Phân urê cung cấp nitơ cho cây trồng.
B. Urê có công thức là (NH2)2CO.
C. Supephotphat có Ca(H2PO4)2.
D. Phân lân cung cấp kali cho cây trồng.
Câu 13: Trong tất cả các kim loại sau đây, kim loại nào dẫn điện tốt nhất?
A. Vàng (Au)
B. Bạc (Ag)
C. Đồng (Cu)
D. Nhôm (Al)
Câu 14: Hiện tượng xảy ra khi đốt sắt trong bình khí clo là:
A. Khói màu trắng sinh ra.
B. Xuất hiện những tia sáng chói.
C. Tạo chất bột trắng bám xung quanh thành bình.
D. Có khói màu nâu đỏ tạo thành.
Câu 15: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K, Al, Mg, Cu, Fe.
B. Cu, Fe, Mg, Al, K.
C. Cu, Fe, Al, Mg, K.
D. K, Cu, Al, Mg, Fe.
Câu 16: Nhôm là kim loại
A. dẫn điện và nhiệt tốt nhất trong số tất cả kim loại.
B. dẫn điện và nhiệt đều kém
C. dẫn điện tốt nhưng dẫn nhiệt kém.
D. dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Câu 17: Kim loại Fe tác dụng được với bao nhiêu chất trong dãy sau: HCl, H2SO4 đặc nguội, dung dịch NaOH, dung dịch Al(NO3)3; khí Cl2
A. 2
B. 3
C. 4
D. 5
Câu 18: Nguyên tắc luyện thép từ gang là
A. tăng thêm hàm lượng cacbon trong gang để thu được thép.
B. dùng chất khử CO khử oxit sắt thành sắt ở nhiệt độ cao.
C. dùng CaO hoặc CaCO3 để khử tạp chất Si, P, S, Mn, … trong gang để thu được thép.
D. dùng O2 oxi hóa các tạp chất Si, P, S, Mn, … trong gang để thu được thép.
Câu 19: Kim loại nào sau đây có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí?
A. Al
B. Fe
C. Ca
D. Na
Câu 20: “Ăn mòn kim loại” là sự phá huỷ kim loại do:
A. Tác dụng hoá học của các chất trong môi trường xung quanh.
B. Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao.
C. Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng diện.
D. Tác động cơ học.
II – TỰ LUẬN: (3 điểm)
Câu 1: (1 điểm)
Viết phương trình hóa học hoàn thành sơ đồ chuyển hóa sau (ghi rõ điều kiện nếu có)
Al Al2O3 Al2(SO4)3 Al(OH)3 AlCl3.
Câu 2: Cho 7,5 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl 14,6% (vừa đủ) thu được 7,84 lít khí (đktc) và dung dịch Y.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại có trong hỗn hợp X.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I – TRẮC NGHIỆM (7 điểm)
|
1C |
2B |
3B |
4A |
5B |
6B |
7A |
8B |
9A |
10A |
|
11A |
12D |
13B |
14D |
15C |
16D |
17A |
18D |
19A |
20A |
Câu 1: Đáp án C
Oxit bazơ không có tính chất tác dụng được với kim loại.
Câu 2: Đáp án B
SO2 là chất góp phần nhiều nhất vào sự hình thành mưa axit
Câu 3: Đáp án B
Các oxit: PbO2; Al2O3; FeO không tác dụng với nước.
Câu 4: Đáp án A
= = 0,14 mol
nNaOH = = 0,32 mol
Xét tỉ lệ: → CO2 phản ứng hết, NaOH dư
= 0,14 mol
→ = 0,14.106 = 14,84 gam
Câu 5: Đáp án B
NaOH + HCl → NaCl + H2O
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
Chú ý:
- Phản ứng trung hòa axit - bazơ luôn xảy ra.
- Phản ứng giữa axit và muối xảy ra với điều kiện: sản phẩm tạo thành có chất kết tủa hoặc chất bay hơi.
Câu 6: Đáp án B
nkhí = 3,36 : 22,4 = 0,15 mol
Gọi kim loại là R (hóa trị II)
R + H2SO4 (loãng) → RSO4 + H2
Theo phương trình: nR = = 0,15 mol
→ MR = = 24 đvC (Mg)
Vậy kim loại cần tìm là magie (Mg).
Câu 7: Đáp án A
Ta có thể sử dụng thuốc thử là quỳ tím và dung dịch BaCl2.
- Trích mẫu thử của từng dung dịch ra ống nghiệm và đánh số thứ tự
- Thử bằng quỳ tím.
+ Quỳ tím hóa đỏ: H2SO4 và HCl
+ Quỳ tím hóa xanh: NaOH.
- Nhỏ dung dịch BaCl2 vào hai mẫu thử H2SO4 và HCl.
+ Mẫu thử tạo kết tủa trắng là H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
+ Không có hiện tượng gì là HCl.
Câu 8: Đáp án B
Nước vôi trong sẽ phản ứng với các khí trên để loại bỏ chúng.
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2S → CaS + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O
Câu 9: Đáp án A
Sử dụng NaOH có thể phân biệt được cặp Na2SO4 và Fe2(SO4)3
+ Nếu không có hiện tượng gì → Na2SO4
+ Nếu xuất hiện kết tủa đỏ nâu → Fe2(SO4)3
6NaOH + Fe2(SO4)3 → 2Fe(OH)3 (↓ đỏ nâu) + 3Na2SO4.
Câu 10: Đáp án A
Xét tỉ lệ: → CuSO4 phản ứng hết, NaOH dư
Số mol Cu(OH)2 tính theo số mol CuSO4
→ = = 0,1 mol
Cu(OH)2 CuO + H2O
nCuO = = 0,1 mol
→ mCuO = 0,1.80 = 8 gam.
Câu 11: Đáp án A
Phân bón đơn là NH4NO3, Ca(H2PO4)2, CO(NH2)2, KCl, NH4Cl.
Lưu ý:
- Phân bón hóa học đơn chỉ chứa một trong ba nguyên tố dinh dưỡng chính là đạm (N), lân (P), kali (K).
- Phân bón kép có chứa hai hoặc cả ba nguyên tố dinh dưỡng N, P, K.
Câu 12: Đáp án D
Phát biểu sai là: D. Phân lân cung cấp kali cho cây trồng.
Vì phân lân cung cấp nguyên tố P cho cây trồng.
Câu 13: Đáp án B
Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,…
Câu 14: Đáp án D
Hiện tượng: Có khói màu nâu đỏ tạo thành.
Do sắt đã phản ứng với khí clo tạo thành FeCl3
Phương trình phản ứng: 2Fe + 3Cl22FeCl3
Câu 15: Đáp án C
Thứ tự chiều hoạt động hóa học tăng dần của kim loại là: Cu, Fe, Al, Mg, K.
Câu 16: Đáp án D
Nhôm là kim loại dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Kim loại dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,…
Kim loại nào dẫn điện tốt thường cũng dẫn nhiệt tốt.
Câu 17: Đáp án A
Kim loại Fe tác dụng được với: HCl, khí Cl2
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 2FeCl3
Câu 18: Đáp án D
Nguyên tắc luyện thép từ gang là: làm giảm hàm lượng các tạp chất (C, S, Si, Mn,..) có trong gang bằng cách oxi hoá các tạp chất đó thành oxit rồi biến thành xỉ và tách ra khỏi thép
Câu 19: Đáp án A
Kim loại có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí là Al.
Al trong không khí thường có lớp màng oxit Al2O3 bảo vệ.
Câu 20: Đáp án A
Sự phá hủy kim loại và hợp kim do tác dụng hóa học của môi trường được gọi là sự ăn mòn kim loại.
II – TỰ LUẬN: (3 điểm)
Câu 1:
4Al + 3O2 2Al2O3
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH vừa đủ → 2Al(OH)3 ↓ + 3Na2SO4
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Câu 2:
a) Phương trình hóa học:
2Al + 6HCl → 2AlCl3 + 3H2 (1)
Mg + 2HCl → MgCl2 + H2 (2)
b) = = 0,35 mol
Gọi x, y lần lượt là số mol của Al, Mg
Theo đề bài ta có: 27x + 24y = 7,5 (3)
Dựa vào phương trình (1), (2) ta có:
x + y = 0,35 (4)
Giải hệ phương trình (3) và (4) ta được: x = 0,1; y = 0,2
mAl = 27.0,1 = 2,7 gam → %mAl = .100% = 36%
%mMg = 100% - 36% = 64%
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
A. TRẮC NGHIỆM: (2 điểm)
Câu 1: Dãy chất gồm các oxit bazơ là:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
Câu 2: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A . CO2
B. SO2
C. N2
D. O3
Câu 3: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4
B. 1,36 g
C. 13,6 g
D. 27,2 g
Câu 4: Phản ứng nào dưới đây là phản ứng trao đổi ?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 +H2
D. BaCl2+H2SO4 → BaSO4 + 2HCl
Câu 5: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 6: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng .
Câu 7: Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
A. S, C, P.
B. S, C, Cl2.
C. C, P, Br2.
D. C, Cl2, Br2.
Câu 8: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65 %. X là nguyên tố:
A. C.
B. S.
C. N.
D. P.
B. TỰ LUẬN:( 8 điểm )
Câu 1: (1 điểm). Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
a. Dung dịch CuSO4
b. Dung dịch HCl
Câu 2: (1 điểm). Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO3, Na2SO4.
Câu 3: (2 điểm). Hãy lập phương trình hóa học của các phản ứng sau:
a. Al + Cl2 →
b. Cu + AgNO3 →
c. Na2O + H2O →
d. FeCl3 + NaOH →
Câu 4: (1 điểm). Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng ?
Câu 5: (1 điểm). Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn .
Câu 6: (1 điểm). Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch HCl thu được 1,12 lít khí H2 (ở đktc). Hãy xác định tên kim loại X ?
Câu 7: (1 điểm). Ngâm lá sắt có khối lượng 56gam vào dung dịch AgNO3 , sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng?
( Cho: N=14, Na=23, Cu=64, Zn=65, Ag=108, O=16 )
ĐÁP ÁN – BIỂU ĐIỂM KIỂM TRA HỌC KÌ I
Môn: Hóa học 9
Năm học: 2017– 2018
A. TRẮC NGHIỆM: (2 điểm)
Chọn đúng mỗi câu được 0,25đ
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
B |
C |
D |
D |
A |
A |
C |
B. TỰ LUẬN:( 8 điểm )
|
CÂU |
ĐÁP ÁN |
ĐIỂM |
|
1 (1điểm) |
a. Kẽm tan một phần, có lớp chất rắn màu đỏ bám vào viên kẽm, dung dịch màu xanh nhạt dần. PTHH: Zn + CuSO4 → ZnSO4 + Cu↓ b. Kẽm tan và có sủi bọt khí. PTHH: Zn + 2HCl → ZnCl2 + H2↑ |
0,5
0,5 |
|
2 (1điểm) |
- Lấy mỗi lọ 1 ít dung dịch làm mẫu thử. Cho quỳ tím lần lượt vào từng mẫu thử. + Mẫu làm quỳ tím hóa đỏ là dung dịch HCl. + Mẫu làm quỳ tím hóa xanh là dung dịch KOH. + Mẫu không đổi màu quỳ tím là dung dịch NaNO3 và Na2SO4. - Cho dung dịch BaCl2 lần lượt vào 2 mẫu thử còn lại. + Mẫu nào có tạo kết tủa trắng là dung dịch Na2SO4. PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl + Mẫu còn lại là NaNO3.
|
0,25 0,25
0,25
0,25 |
|
3 (2điểm) |
a. 2Al + 3Cl2 → 2AlCl3 b. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ c. Na2O + H2O → 2NaOH d. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
|
0,5 0,5 0,5 0,5
|
|
4 (1điểm) |
nNa = 2,3 /23 = 0,1 (mol) 2Na + 2H2O → 2NaOH + H2 Theo pt: nNaOH = nNa =0,1 mol => mNaOH = 0,1. 40 =4g nH2 = ½ .nH2 = 0,1 : 2 = 0,05 mol => mH2 =2. 0,05 = 0,1 g
mdd sau pư = 2,3 + 97,8 – 0,1 = 100g
C% = |
0,5
0,5
|
|
5 (1điểm) |
nH2 = 2,24 / 22,4 = 0,1 mol Zn + H2SO4 → ZnSO4 + H2 Cu không tác dụng với H2SO4 loãng Theo pt: nZn = nH2 = 0,1 mol ð mZn = 0,1 . 65 = 6,5g ð mCu = 10,5 – 6,5 = 4g %mZn = = 61,9% %mCu = 100% - 61,9% = 38,1% |
0,5
0,5 |
|
6 (1)điểm |
X + 2HCl → XCl2 + H2 nH2 = = 0,05 mol Theo pt: nx = nH2 = 0,05 mol MX = = 65 g/mol =>X là Zn |
0,5
0,5
|
|
7 (1điểm) |
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag Theo bài: m tăng = 57,6 – 56 = 1,6 g =>nFe pư = = 0,1 mol nAg = 2.nFe = 0,1.2 = 0,2 mol mAg = 0,2 .108 = 21,6g |
0,25
0,25
0,5
|
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 5
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
A/ PHẦN TRẮC NGHIỆM( 3đ)
Hãy chọn đáp án đúng ghi vào bài làm.
Câu 1: Axit làm quỳ tím hóa
A. Xanh
B. đỏ
C. Hồng
D. Vàng
Câu 2: Bazơ nào sau đây không tan trong nước.
A. NaOH
B. KOH
C. Ca(OH)2
D. Cu(OH)2
Câu 3: Muối nào sau đây không tan.
A. K2SO3
B. Na2SO3
C. CuCl2
D. BaSO4
Câu 4: Axit nào sau đây dễ bay hơi.
A. H2SO3
B. H2SO4
C. HCl
D. HNO3
Câu 5: Cho 5,6g sắt vào dung dịch đồng sunfat dư. Khối lượng đồng thu được là:
A. 6,4 g
B. 12,8 g
C. 64 g
D. 128 g
Câu 6: Cho 2.7g Nhôm vào dung dịch axit clohiđric dư. Thể tích khí hiđrô thoát ra (đktc) là:
A. 3.36l
B. 2.24l
C. 6.72l
D. 4.48l
B. PHẦN TỰ LUẬN:(7đ)
Câu 1. Hoàn thành chuổi phản ứng hoá học sau:(2.5đ)
FeFeCl3Fe(OH)3 Fe2O3 Fe2(SO4)3
Câu 2. (2đ) Nhận biêt các chất sau bằng phương pháp hóa học :
Na2SO4, HCl , H2 SO4 , NaCl. Viết PTPƯ nếu có. :
Câu 3.( 3đ) Cho một lượng bột sắt dư vào 200ml dung dịch axit H2SO4.Phản ứng xong thu được 4,48 lít khí hiđrô (đktc)
a. Viết phương trình phản ứng hoá học
b. Tính khối lượng sắt đã tham gia phản ứng
c. Tính nồng độ mol của dung dịch axit H2SO4 đã dùng
Fe = 56, O = 16, H = 1, S= 32,
Đáp án
Trắc nghệm mỗi ý đúng 0,5 đ
|
1 |
2 |
3 |
4 |
5 |
6 |
|
B |
D |
D |
A |
A |
A |
Tự luận
Câu 1. Mỗi PTHH đúng 0,5 đ
2 Fe + 3Cl2 2FeCl3
2FeCl3 + 6NaOH 2Fe(OH)3 + 6NaCl
2Fe(OH)3 Fe2O3 + 3H2O
Fe2O3 + 3H2 SO4 Fe2(SO4)3+ 3H2O
Câu 2.
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là: HCl H2 SO4, .. ( nhóm 1) ( 0,5 đ)
+ Quỳ tím không chuyển màu là: Na2SO4 , NaCl. ( nhóm 2) ( 0,5 đ)
- Cho BaCl2 vào nhóm 1, chất nào xuất hiện kết tủa trắng là: H2 SO4, còn lại là HCl (0,5 đ)
BaCl2 + H2 SO4, BaSO4↓ + HCl ( 0,5 đ)
- Cho BaCl2 vào nhóm 2, chất nào xuất hiện kết tủa trắng là: Na2 SO4, còn lại là NaCl (0,5 đ)
BaCl2 + Na2SO4, BaSO4↓ + Na Cl (0,5đ)
Câu 3.
a. Fe + 2H2 SO4, Fe(SO4)2 + 2H2 (0,5đ)
b. Số mol của H2 là n = 4,48/22,4= 0,2 mol (0,5đ)
Theo PTHH suy ra nFe =1/2.nH2 = 0,2: 2= 0,1 mol (0,5đ)
Khối lương Fe tham gia phả ứng là :
mFe = 0,1. 56= 5,6 gam (0,5đ)
c. Số mol của H2 SO4 tham gia phả ứng là :
Theo PTHH suy ra n H2SO4 = nH2 = 0,2 mol (0,5đ)
VH2SO4 = 200ml = 0,2 l
Nồng độ mol của H2 SO4 là:
CM = 0,2/ 0,2 = 1 M (0,5đ)
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 6
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 27, N = 14, S = 32)
I - TRẮC NGHIỆM (7 Điểm)
Câu 1: Có các dung dịch không màu đựng trong các lọ riêng biệt, không dán nhãn gồm: ZnSO4, Mg(NO3)2, Al(NO3)3. Để phân biệt các dung dịch trên có thể dùng:
A. Quì tím
B. NaOH
C. Ba(OH)2
D. BaCl2
Câu 2: Dung dịch của chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra chất không tan (kết tủa). Chất X là:
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4
Câu 3: Cho 1,77 g hỗn hợp Ca và Ba tác dụng hết với nước, sau phản ứng thu được 2,45g hỗn hợp 2 bazơ Ca(OH)2 và Ba(OH)2. Thể tích khí H2 sinh ra ở đktc là:
A. 0,224 lít
B. 0,448 lít
C. 0,336 lít
D. 0,48 lít
Câu 4: Cho cari vào nước được dung dịch A. Cho lượng dư dung dịch Na2CO3 và dung dịch A rồi dẫn tiếp luồng khí CO2 vào đến dư. Hiện tượng nào đúng trong số các hiện tượng sau
A. Sủi bọt khí, xuất hiện kết tủa trắng rồi tan
B. Bari tan, xuất hiện kết tủa trắng, rối tan
C. Bari tan, sủi bọt khí hiđro, đồng thời xuất hiện kết tủa trắng
D. Bari tan, sủi bọt khí hiđro, xuất hiện kết tủa trắng, rồi tan
Câu 5: Trong các kim loại sau, kim loại nào hoạt động mạnh nhất:
A. Cu
B. Al
C. Pb
D. Ba
Câu 6: Chọn mệnh đề đúng:
A. Tất cả các kim loại đều không phản ứng với dung dịch bazơ.
B. Tất cả các kim loại đều không phản ứng với dung dịch axit.
C. Al, Zn phản ứng với dung dịch bazơ
D. Tất cả các mệnh đề trên đều sai.
Câu 7: Tên gọi của Al2O3 và Al(OH)3 lần lượt là:
A. Nhôm oxit và nhôm(III) hiđroxit.
B. Nhôm(III) oxit và nhôm hiđroxit.
C. Nhôm oxit và nhôm hiđroxit.
D. Nhôm(III) oxit và nhôm(III) hiđroxit.
Câu 8: Thí nghiệm 1: Cho 0,3 mol Fe vào dung dịch H2SO4 loãng.
Thí nghiệm 2: Cho 0,3 mol Fe vào trong dung dịch H2SO4 đặc nóng thoát ra khí SO2 (sản phẩm khử duy nhất).
Tỉ lệ mol khí thoát ra ở hai thí nghiệm là:
A. 1:3
B. 2:3
C. 1:1
D. 1: 1,2
Câu 9: Clo hoá 11,2g Fe ở nhiệt độ cao thu được m gam muối. Giá trị của m là
A. 48,75
B. 40,5
C. 24,375
D. 32,5
Câu 10: Một tấn quặng manhetit chứa 81,2% Fe3O4. Khối lượng Fe có trong quặng là:
A. 858 kg
B. 885 kg
C. 588 kg
D. 724 kg
Câu 11: Hoà tan 9 g hợp kim nhôm – magie vào dung dịch H2SO4 dư thu được 10,08 lít khí H2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50%
B. 40% và 60%
C. 60% và 40%
D. 39% và 61%
Câu 12: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là:
A. Zn.
B. Mg.
C. Fe.
D. Ca.
Câu 13: Ngâm 1 lá Zn vào dung dịch CuSO4 sau 1 thời gian lấy lá Zn ra thấy khối lượng dung dịch tăng 0,2 g. Vậy khối lượng Zn phản ứng là
A. 0,2 g
B. 13 g
C. 6,5 g
D. 0,4 g
Câu 14: Cho 13g hỗn hợp A gồm Cu, Al, Mg vào dung dịch HCl dư, phản ứng xong thu được 4 gam chất rắn không tan và 10,08 lít khí H2 (đktc). Tính thành phần phần trăm theo khối lượng của từng kim loại trong hỗn hợp.
A. 30,77%; 27,69%; 41,54%
B. 27,69%; 41,54%; 30,77%
C. 30,77%; 41,54%; 27,69%
D. 27,69%; 30,77%;41,54%
Câu 15: Hoà tan 5,2g hỗn hợp gồm Mg và Fe bằng dung dịch axit HCl 1M, thì thu được 3,36 lit H2 (đktc). Tính thể tích dung dịch axit HCl đã dùng.
A. 200 ml
B. 300 ml
C. 400 ml
D. 500 ml
Câu 16: Các dụng cụ như: cuốc, xẻng, dao, búa, … khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích
A. thể hiện tính cẩn thận của người lao động.
B. làm các thiết bị không bị gỉ.
C. để cho mau bén.
D. để sau này bán lại không bị lỗ.
Câu 17: Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng:
A. ZnO, BaCl2
B. CuO, BaCl2
C. BaCl2, Ba(NO3)2
D. Ba(OH)2, ZnO
Câu 18: Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch H2SO4 loãng, dư
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
A. 3
B. 4
C. 2
D. 1
Câu 19: Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2
D. Na2SO3 và H2SO4
Câu 20: Khối lượng của nguyên tố N có trong 200 g (NH4)2SO4 là
A. 42,42 g
B. 21,21 g
C. 24,56 g
D. 49,12 g
II – TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Thả một mảnh Cu vào các ống nghiệm có chứa các dung dịch sau:
a) AgNO3
b) H2SO4 loãng
c) H2SO4 đăc, nóng
d) MgSO4.
Em hãy cho biết hiện tượng xảy ra trong các trường hợp trên. Viết phương trình hóa học nếu có.
Câu 2: (2 điểm) Cho một khối lượng mạt sắt dư vào 100 ml dung dịch HCl. Phản ứng xong, thu được 6,72 lít khí (đktc).
a) Viết phương trình hóa học.
b) Tính khối lượng mạt sắt đã tham gia phản ứng.
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 7
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Cho biết nguyên tử khối (theo đvC) của các nguyên tố:
Fe = 56; Cu = 64; S = 32; H = 1; O = 16; Zn = 65; Ag = 108; N = 14; Ba = 137; Cl = 35,5
Phần trắc nghiệm
Câu 1. Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 → 2FeCl3
B. 2CO2 + Ca(OH)2 → Ca(HCO3)2
C. 2NaCl + H2SO4 → Na2SO4 + 2HCl
D. Fe + CuSO4 → FeSO4 + Cu
Câu 2. Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam B. 10,8 gam C. 13 gam D. 21,6 gam
Câu 3. Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4
B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4
D. Al, Fe, CO2, H2SO4
Câu 4. Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu B. Fe C. Al D. Na.
Phần tự luận
Câu 5 (3đ). Viết phương trình hóa học hoàn thành chuỗi biến hóa sau, ghi rõ điều kiện (nếu có)
Al -1→ Fe -2→ FeCl3 -3→ Fe(OH)3 -4→ Fe2O3
Câu 6 (2đ) . Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, H2SO4, Na2SO4, HCl. Viết phương trình hóa học (nếu có).
Câu 7 (3đ) . Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a. Xác định phần trăm về khối lượng các chất trong X.
b. Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c. Nếu cho 12 gam X vào 300 ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
Đáp án và Thang điểm
Trắc nghiệm (2,0 điểm). Mỗi câu trả lời đúng được 0,5 điểm
Câu 1. C
Dung dịch NaCl không phản ứng với dung dịch H2SO4.
Câu 2. D
mAg = 0,2.108 = 21,6 gam.
Câu 3. A
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
CO2 + 2NaOH → Na2CO3 + 2H2O
FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Câu 4. B
3Fe + 2O2 → Fe3O4
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + H2SO4 → FeSO4 + H2
Tự luận
Câu 5
Viết đúng mỗi phương trình hóa học được (0.5 điểm); cân bằng đúng mỗi phương trình được (0.25 điểm)
(1) 2Al + 3FeCl2 → 2AlCl3 + 3Fe (0.75 điểm)
(2) 2Fe + 3Cl2 → 2FeCl3 (0.75 điểm)
(3) FeCl3 + 3KOH → Fe(OH)3 + 3KCl (0.75 điểm)
(4) 2Fe(OH)3 → Fe2O3 + 3H2O (0.75 điểm)
Chú ý: Học sinh có thể viết PTHH khác đúng vẫn cho điểm tối đa
Câu 6
Học sinh trình bày được cách nhận biết và viết được PTHH (nếu có) đúng mỗi dung dịch được 0,5 điểm.
Trích mẫu thử và đánh số thứ tự:
- Nhúng quỳ tím vào 4 mẫu thử:
+ 2 mẫu làm quỳ chuyển đỏ là H2SO4 và HCl
+ Mẫu làm quỳ chuyển xanh là NaOH
+ Mẫu không làm quỳ chuyển màu là là Na2SO4
- Nhỏ dd BaCl2 lần lượt vào 2 mẫu H2SO4 và HCl
+ Mẫu có kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Mẫu còn lại là HCl
Câu 7
- Theo giả thiết ta có:
nH2 = 4,48/22,4 = 0,2 mol (0.25 điểm)
- Phương trình hóa học: Fe + H2SO4 → FeSO4 + H2 (1) (0.25 điểm)
Theo PTHH (1) ta có: nFe = nH2 = 0,2 mol
⇒ mFe = 0,2.56 ⇒ mFe = 11,2 (gam)
Suy ra, giá trị m là: m = 11,2 + 8,8 ⇒ m = 20 (gam) (0.5 điểm)
a. Vậy thành phần phần trăm về khối lượng các chất trong X là:
%mFe = (11.2/20).100 = 56%
và %mCu = 100 - 56 = 44% (0.5 điểm)
b. Theo bài ra dung dịch Y gồm FeSO4 và H2SO4 dư
Phương trình hóa học:
BaCl2 + FeSO4 → BaSO4 + FeCl2 (2)
BaCl2 + H2SO4 → BaSO4 + 2HCl (3) (0.5 điểm)
Theo giả thiết, ta có:
nBaSO4 = 69,9/233 ⇒ nBaSO4 = 0,3 mol
Khi đó theo PTHH (1), (2), (3) ta có:
nFeSO4(Y) = 0,2 mol và nH2SO4(Y) = 0,1 mol (0.25 điểm)
Vậy nồng độ mol các chất trong Y là:
CM FeSO4 = 0,2/0,25 = 0,8 M
Và CM H2SO4 = 0,1/0,25 = 0,4 M (0.25 điểm)
c. Theo giả thiết và kết quả ở phần (a) ta có:
Trong 20 gam X có 0,2 mol Fe và 0,1375 mol Cu
Vậy trong 12 gam X có 0,12 mol Fe và 0,0825 mol Cu
Và nAgNO3 = 0,3.0,8 = 0,24 mol (0.25 điểm)
- Phương trình hóa học có thể:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (4)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag (5)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag (6)
Giả sử chỉ xảy ra phản ứng (4) và phản ứng (4) diễn ra hoàn toàn:
Chất rắn sau phản ứng gồm Ag: 0,24 mol và Cu 0,0825 mol
mchất rắn = 0,24.108 + 0,0825.64 = 31,2 > mZ = 28.
Vậy điều giả sử là sai. Sau một thời gian để thu được 28 gam chất rắn Z phản ứng (4) mới diễn ra 1 phần. Gọi số mol Fe phản ứng trong (4) là x mol. Ta có:
Sau một thời gian, thu được chất rắn Z gồm: Fe: (0,12 – x) mol; Ag: 2x mol; Cu: 0,0825 mol
Có mZ = 28 gam
→ 56(0,12 – x) + 108.2x + 64.0,0825 = 28 → x = 0,1.
Vậy số mol Ag có trong Z là 0,2 mol.
Khối lượng Ag có trong Z là 0,2.108 = 21,6 gam. (0.25 điểm)
Chú ý: Học sinh có thể không cần viết đủ cả 3 PTHH (4), (5), (6) nhưng có cách trình bày đúng để tìm được khối lượng của Ag trong Z là 21,6 gam thì vẫn đạt 0,25 điểm.
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 8
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Phần trắc nghiệm
Câu 1: Dãy chất gồm các oxit bazơ là:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
Câu 2: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A . CO2 B. SO2 C. N2 D. O3
Câu 3: Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 20,4 B. 1,36 g C. 13,6 g D. 27,2 g
Câu 4: Phản ứng nào dưới đây là phản ứng trao đổi ?
A. 2Na + 2H2O → 2NaOH + H2
B. BaO + H2O → Ba(OH)2
C. Zn + H2SO4 → ZnSO4 + H2
D. BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 5: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 6: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với:
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng
Câu 7: Dãy phi kim tác dụng với oxi tạo thành oxit axit là:
A. S, C, P.
B. S, C, Cl2.
C. C, P, Br2.
D. C, Cl2, Br2.
Câu 8: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố:
A. C B. S C. N D. P
Phần tự luận
Câu 1: (1 điểm). Hãy cho biết hiện tượng xảy ra khi nhúng một viên kẽm vào:
a. Dung dịch CuSO4
b. Dung dịch HCl
Câu 2: (1 điểm). Bằng phương pháp hóa học hãy nhận biết dung dịch các chất chứa trong các lọ bị mất nhãn sau: HCl, KOH, NaNO3, Na2SO4
Câu 3: (2 điểm). Hãy lập phương trình hóa học của các phản ứng sau:
a. Al + Cl2 →
b. Cu + AgNO3 →
c. Na2O + H2O →
d. FeCl3 + NaOH →
Câu 4: (1 điểm). Hoà tan hết 2,3g Na kim loại vào 97,8g nước . Hãy tính nồng độ % của dung dịch thu được sau phản ứng?
Câu 5: (1 điểm). Cho 10,5g hỗn hợp 2 kim loại Cu và Zn vào dd H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Hãy tính thành phần % theo khối lượng của Cu và Zn .
Câu 6: (1 điểm). Hoà tan hoàn toàn 3,25g một kim loại X (hoá trị II) bằng dung dịch HCl thu được 1,12 lít khí H2 (ở đktc). Hãy xác định tên kim loại X ?
Câu 7: (1 điểm). Ngâm lá sắt có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam. Hãy tính khối lượng Ag sinh ra sau phản ứng?
( Cho: N = 14, Na = 23, Cu = 64, Zn = 65, Ag = 108, O = 16 )
Đáp án và Thang điểm
TRẮC NGHIỆM: (2 điểm)
Chọn đúng mỗi câu được 0,25đ
Câu 1. B
Oxit bazo là oxit của kim loại
Câu 2. B
SO2 góp phần gây nên mưa axit.
Câu 3. C
mmuối = 0,1.136 = 13,6 gam.
Câu 4. D
Phản ứng trao đổi: BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 5. D
Fe + CuSO4 → FeSO4 + Cu
Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 6. A
Al tác dụng với NaOH còn Fe thì không.
Câu 7. A
S + O2 → SO2
C + O2 → CO2
4P + 5O2 → 2P2O5
Cl2 và Br2 không tác dụng trực tiếp với O2.
Câu 8. C
Hợp chất khí có dạng: RH3
Theo bài ra:
TỰ LUẬN
Câu 1
a. Kẽm tan một phần, có lớp chất rắn màu đỏ bám vào viên kẽm, dung dịch màu xanh nhạt dần.
PTHH: Zn + CuSO4 → ZnSO4 + Cu↓ (0.5 điểm)
b. Kẽm tan và có sủi bọt khí.
PTHH: Zn + 2HCl → ZnCl2 + H2↑ (0.5 điểm)
Câu 2
- Lấy mỗi lọ 1 ít dung dịch làm mẫu thử. Cho quỳ tím lần lượt vào từng mẫu thử.
+ Mẫu làm quỳ tím hóa đỏ là dung dịch HCl. (0,25 điểm)
+ Mẫu làm quỳ tím hóa xanh là dung dịch KOH. (0,25 điểm)
+ Mẫu không đổi màu quỳ tím là dung dịch NaNO3 và Na2SO4
- Cho dung dịch BaCl2 lần lượt vào 2 mẫu thử còn lại. (0,25 điểm)
+ Mẫu nào có tạo kết tủa trắng là dung dịch Na2SO4.
PTHH: BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl (0,25 điểm)
+ Mẫu còn lại là NaNO3
Câu 3
a. 2Al + 3Cl2 → 2AlCl3 (0,5 điểm)
b. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓ (0,5 điểm)
c. Na2O + H2O → 2NaOH (0,5 điểm)
d. FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl (0,5 điểm)
Câu 4
nNa = 2,3/23 = 0,1 (mol)
2Na + 2H2O → 2NaOH + H2
Theo pt: nNaOH = nNa = 0,1 mol ⇒ mNaOH = 0,1. 40 = 4g (0,5 điểm)
nH2 = (1/2) .nH2 = 0,1 : 2 = 0,05 mol ⇒ mH2 = 2. 0,05 = 0,1 g
mdd sau pư = 2,3 + 97,8 – 0,1 = 100g
C% = (mNaOH/mdd).100% = (4/100).100% = 4% (0,5 điểm)
Câu 5
nH2 = 2,24 / 22,4 = 0,1 mol
Zn + H2SO4 → ZnSO4 + H2
Cu không tác dụng với H2SO4 loãng (0,5 điểm)
Theo pt: nZn = nH2 = 0,1 mol
⇒ mZn = 0,1.65 = 6,5 g
⇒ mCu = 10,5 – 6,5 = 4 g
% mZn = (6,5/10,5).100% = 61,9%
% mCu = 100% - 61,9% = 38,1% (0,5 điểm)
Câu 6
X + 2HCl → XCl2 + H2
nH2 = 1,12/22,4 = 0,05 mol (0,5 điểm)
Theo pt: nx = nH2 = 0,05 mol
MX = 3,25/0,05 = 65 g/mol
⇒ X là Zn (0,5 điểm)
Câu 7
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (0,25 điểm)
1 mol Fe phản ứng tạo thành 2 mol Ag thì khối lượng tăng thêm là: 2.108 – 56 = 160g (0,25 điểm)
Theo bài: m tăng = 57,6 – 56 = 1,6 g
⇒ nFe pư = 1,6/160 = 0,1 mol
nAg = 2.nFe = 0,1.2 = 0,2 mol
mAg = 0,2 .108 = 21,6 g (0,5 điểm)
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 9
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Câu 1: (2.0 điểm)
a. Trình bày tính chất hóa học của axit. Viết phương trình hóa học minh họa.
b. Hãy giải thích vì sao trong bất cứ hoàn cảnh nào cũng không được cho axit đậm đặc vào nước.
Câu 2: (2.0 điểm)
Phân biệt các dung dịch sau bằng phương pháp hóa học:
a. HNO3, HCl, BaCl2, NaOH
b. Al, Fe, Cu
Câu 3: (1.0 điểm)
Hoàn thành chuỗi phản ứng sau:
Na → NaOH → Na2CO3 → Na2SO4 → NaCl
Câu 4: (2.0 điểm)
Sau một lần đi tham quan nhà máy, khi về lớp làm bài tập tường trình thầy giáo có đặt ra một câu hỏi thực tế: "Khí SO2 và CO2 do nhà máy thải ra gây ô nhiễm không khí rất nặng. Vậy em hãy nêu lên cách để loại bỏ bớt lượng khí trên trước khi thải ra môi trường". Bạn Ân cảm thấy rất khó và không biết cách trả lời em hãy hỗ trợ bạn ấy để giải quyết câu hỏi này.
Câu 5: (3.0 điểm)
Biết 2,24 lít khí Cacbonic (đktc) tác dụng hết với 200 ml dung dịch Ba(OH)2, sản phẩm thu được là muối trung hòa và nước.
a. Viết phương trình xảy ra.
b. Tính nồng độ mol của dung dịch Ba(OH)2 cần dùng.
c. Tính khối lượng kết tủa thu được
Đáp án và Thang điểm
Câu 1
a. TCHH của axit:
- Axit làm đổi màu quỳ tím thành màu đỏ. (0.25 điểm)
- Axit tác dụng với oxit bazơ tạo thành muối và nước. (0.25 điểm)
H2SO4 + CaO → CaSO4 + H2O
- Axit tác dụng với bazo tạo thành muối và nước. (0.25 điểm)
H2SO4 + Ca(OH)2 → CaSO4 + 2H2O
- Axit tác dụng với kim loại tạo thành muối và giải phóng khí hidro. (0.25 điểm)
Fe + 2HCl → FeCl2 + H2
- Axit tác dụng với muối tạo thành muối mới và axit mới.
H2SO4 + BaCl2 → BaSO4 + 2HCl (0.25 điểm)
b. Khi axit gặp nước sẽ xảy ra quá trình hidrat hóa, đồng thời sẽ tỏa ra 1 lượng nhiệt lớn. Axit đặc lại nặng hơn nước nên khi cho nước vào axit thì nước sẽ nổi lên trên mặt axit, nhiệt tỏa ra làm cho nước sôi mãnh liệt và bắn tung tóe gây nguy hiểm. (0.75 điểm)
Nếu TCHH không có phương trình thì sẽ không chấm điểm phần đó.
Câu 2 (2 điểm)
a. Trích mẫu thử và đánh số thứ tự:
- Nhúng quỳ tím vào 4 mẫu thử:
+ 2 mẫu làm quỳ chuyển đỏ là HNO3 và HCl
+ Mẫu làm quỳ chuyển xanh là NaOH
+ Mẫu không làm quỳ chuyển màu là là BaCl2
- Nhỏ dd AgNO3 lần lượt vào 2 mẫu HNO3 và HCl
+ Mẫu có kết tủa trắng là HCl
AgNO3 + HCl → AgCl↓ + HNO3
+ Mẫu không có hiện tượng gì là HNO3
b, Trích mẫu thử và đánh số thứ tự
- Lần lượt cho dung dịch axit loãng HCl vào từng mẫu thử
+ Mẫu kim loại nào không tan là Cu.
+ Mẫu kim loại nào tan có hiện tượng sủi bọt khí không màu không mùi là Al, Fe
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
- Cho dung dịch NaOH vào 2 kim loại còn lại: Al, Fe
Kim loại nào có hiện tượng sủi bọt khí không màu không mùi là Al, không có hiện tượng gì là Fe
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Câu 3
2Na + 2H2O → 2NaOH + H2 (0.25 điểm)
2NaOH + CO2 → Na2CO3 + H2O (0.25 điểm)
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 (0.25 điểm)
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓ (0.25 điểm)
Câu 4 (2 điểm)
Trước khi thải phải có hệ thống lọc khí chứa Ca(OH)2 đề hấp thụ khí thải:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3↓ + H2O
Câu 5
a. Ba(OH)2 + CO2 → BaCO3 + H2O (1 điểm)
b. nCO2 = 2,24 / 22,4 = 0,1 mol (1 điểm)
Theo pt: nBa(OH)2 = nBaCO3 = nCO2 = 0,1 mol
Vdd = 200ml = 0,2 l
CMBa(OH)2 = n/V = 0,1 / 0,2 = 0,5 M
c. mBaCO3 = 0,1 . 197 = 19,7g (1 điểm)
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 10
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Phần trắc nghiệm
Câu 1: Axit làm quỳ tím hóa
A. Xanh B. đỏ C. Hồng D. Vàng
Câu 2: Bazơ nào sau đây không tan trong nước.
A. NaOH B. KOH C. Ca(OH)2 D. Cu(OH)2
Câu 3: Muối nào sau đây không tan.
A. K2SO3 B. Na2SO3 C CuCl2 D BaSO4
Câu 4: Axit nào sau đây dễ bay hơi.
A. H2SO3 B. H2SO4 C. HCl D. HNO3
Câu 5: Cho 5,6g sắt vào dung dịch đồng sunfat dư. Khối lượng đồng thu được là:
A. 6,4 g B 12,8 g C. 64 g D. 128 g
Câu 6: Cho 2.7g Nhôm vào dung dịch axit clohiđric dư. Thể tích khí hiđrô thoát ra (đktc) là:
A. 3.36 l B. 2.24 l C. 6.72 l D. 4.48 l
Phần tự luận
Câu 1. Hoàn thành chuổi phản ứng hoá học sau:(2.5 đ)
Fe -(1)→ FeCl3 -(2)→ Fe(OH)3 -(3)→ Fe2O3 -(4)→ Fe2(SO4)3
Câu 2. (2đ) Nhận biết các chất sau bằng phương pháp hóa học :
Na2SO4, HCl, H2SO4, NaCl. Viết PTPƯ nếu có:
Câu 3. (3đ) Cho một lượng bột sắt dư vào 200ml dung dịch axit H2SO4. Phản ứng xong thu được 4,48 lít khí hiđrô (đktc)
a. Viết phương trình phản ứng hoá học
b. Tính khối lượng sắt đã tham gia phản ứng
c. Tính nồng độ mol của dung dịch axit H2SO4 đã dùng
Fe = 56, O = 16, H = 1, S = 32
Đáp án và Thang điểm
Trắc nghệm mỗi ý đúng (0.5 điểm)
Câu 1. B
Axit làm quỳ tím chuyển sang màu đỏ.
Câu 2. D
Cu(OH)2 không tan trong nước.
Câu 3. D
BaSO4 kết tủa bền, không tan trong nước.
Câu 4. A
H2SO3 là axit yếu, không bền ở điều kiện thường
H2SO3 → H2O + CO2
Câu 5. A
mCu = 0,1.64 = 6,4 gam.
Câu 6. A
→ V = 0,15.22,4 = 3,36 lít.
Tự Luận
Câu 1. Mỗi PTHH đúng 0,5 đ
(1) 2Fe + 3Cl2 → 2FeCl3
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(3) 2Fe(OH)3 → Fe2O3 + 3H2O
(4) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Câu 2.
- Cho quỳ tím vào các mẫu thử:
+ Nếu quỳ tím hóa đỏ là: HCl, H2SO4, .. ( nhóm 1) (0.5 điểm)
+ Quỳ tím không chuyển màu là: Na2SO4 , NaCl. ( nhóm 2) (0.5 điểm)
- Cho BaCl2 vào nhóm 1, chất nào xuất hiện kết tủa trắng là: H2 SO4, còn lại là HCl (0.5 điểm)
BaCl2 + H2SO4 BaSO4↓ + HCl (0.5 điểm)
- Cho BaCl2 vào nhóm 2, chất nào xuất hiện kết tủa trắng là: Na2SO4, còn lại là NaCl (0.5 điểm)
BaCl2 + Na2SO4 → BaSO4↓ + NaCl (0.5 điểm)
Câu 3.
a. Fe + H2SO4 → FeSO4 + H2 (0.5 điểm)
b. Số mol của H2 là n = 4,48/22,4 = 0,2 mol (0.5 điểm)
Theo PTHH suy ra nFe = nH2 = 0,2 mol (0.5 điểm)
Khối lương Fe tham gia phả ứng là :
mFe = 0,2.56 = 11,2 gam (0.5 điểm)
c. Số mol của H2SO4 tham gia phản ứng là :
Theo PTHH suy ra nH2SO4 = nH2 = 0,2 mol (0.5 điểm)
VH2SO4 = 200ml = 0,2 l
Nồng độ mol của H2SO4 là:
CM = 0,2/0,2 = 1 M (0.5 điểm)
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 11
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Phần 1. Trắc nghiệm khách quan
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Câu 1. Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, CaO, HCl, BaCl2
B. Cu, BaO, NaOH, Na2CO3
C. Mg, CuO, HCl, NaCl
D. Zn, BaO, NaOH, Na2CO3
Câu 2. Phản ứng không tạo ra muối Fe(III):
A. Fe tác dụng với dd HCl
B. Fe2O3 tác dụng với dd HCl
C. Fe3O4 tác dụng với dd HCl
D. Fe(OH)3 tác dụng với dd H2SO4
Câu 3. Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2
D. Na2SO3 và H2SO4
Câu 4. Dung dịch của chất X có pH >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
| A. BaCl2 | B. NaOH | C. Ba(OH)2 | D. H2SO4. |
Câu 5. Để loại bỏ khí CO2 có lẫn trong hỗn hợp (O2; CO2). Người ta cho hỗn hợp đi qua dung dịch chứa:
| A. HCl | B. Na2SO4 | C. NaCl | D. Ca(OH)2. |
Câu 6. Có những chất khí sau: CO2; H2; O2; SO2; CO. Khi nào làm đục nước vôi trong.
| A. CO2 | B. CO2; CO; H2 | C. CO2; SO2 | D. CO2; CO; O2 |
Câu 7. Nhỏ vài giọt dung dịch FeCl3 vào ống nghiệm đựng 1ml dung dịch NaOH, thấy xuất hiện:
A. chất không tan màu nâu đỏ
B. chất không tan màu trắng
C. chất tan không màu
D. chất không tan màu xanh lơ
Câu 8. Cho dãy các kim loại sau : Fe, W, Hg, Cu kim loại trong dãy có nhiệt độ nóng chảy thấp nhất:
| A. W | B. Cu | C. Hg | D. Fe |
Phần 2. Tự luận (7 điểm)
Câu 1. Hoàn thành chuỗi phản ứng hóa học sau:
Al → Al2O3 → NaAlO2 → Al(OH)3 → Al2(SO4)3 → AlCl3 → Al(NO3)3
Câu 2. Nêu hiện tượng và viết phương trình hóa học xảy ra trong các thí nghiệm sau:
a) Nhúng đinh sắt đã cạo sạch gỉ vào dung dịch CuSO4
b) Sục khí CO2 vào nước vôi trong
Câu 3. Có 4 lọ mất nhãn chứa 4 dung dịch HCl, Na2SO4, NaCl, Ba(OH)2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Câu 4. Cho 7,5 gam hỗn hợp X gồm Al, Mg tác dụng với dung dịch HCl 14,6% (vừa đủ) thu được 7,84 lít khí (đktc) và dung dịch Y.
a) Viết phương trình hóa học xảy ra.
b) Tính thành phần % khối lượng của mỗi kim loại có trong hỗn hợp X.
Đáp án
Phần 1. Trắc nghiệm
| 1 D | 2 A | 3 D | 4 C |
| 5 D | 6 C | 7 A | 8 C |
Phần 2. Tự luận
Câu 1.
1) 4Al + 3O2 → 2Al2O3
2) Al2O3 + 2NaOH → 2NaAlO2 + H2O
3) NaAlO2 + 2H2O → NaOH + Al(OH)3
4) 2Al(OH)3 + 3ZnSO4 → Al2(SO4)3 + 3Zn(OH)2
5) Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4
6) AlCl3 + 3AgNO3 → Al(NO3)3 + 3AgCl
Câu 2.
a) Nhúng đinh sắt đã cạo sạch gỉ vào dung dịch CuSO4
Hiện tượng: đinh sắt tan dần, màu xanh của dung dịch đồng sunfat nhạt dần. Sau 1 thời gian lấy đinh sắt ra thì thấy 1 lớp kim loại màu đỏ gạch bám ngoài (đó chính là đồng).
Fe + CuSO4 → FeSO4 + Cu
b) Sục khí CO2 vào nước vôi trong
Hiện tượng: Khi sục khí CO2 vào nước vôi trong Ca(OH)2 xuất hiện kết tủa trắng CaCO3
CO2 + Ca(OH)2 → CaCO3 + H2O
c) Cho từ từ dung dịch BaCl2 vào ống nghiệm chứa dung dịch H2SO4
Hiện tượng: Khi cho từ từ dung dịch dung dịch BaCl2 vào ống nghiệm chứa dung dịch H2SO4 sau phản ứng xuất hiện kết tủa trắng
BaCl2 + H2SO4 → BaSO4 + 2HCl
Câu 3. Có 4 lọ mất nhãn chứa 4 dung dịch HCl, Na2SO4, NaCl, Ba(OH)2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Trích mẫu thuốc thử và đánh số thứ tự
| HCl | Na2SO4 | NaCl | Ba(OH)2 | |
| Quỳ tím | Quỳ chuyển sang màu đỏ | Quỳ không chuyển màu | Quỳ không chuyển màu | Quỳ chuyển sang màu xanh |
| Na2SO4 | Không phản ứng | - | - | Kết tủa trắng |
| NaCl | Không phản ứng | - | - | Không phản ứng |
Dấu (-) đã nhận biết được
Phương trình phản ứng xảy ra:
Na2SO4 + Ba(OH)2 → BaSO4 + 2NaOH
Câu 4.
a) Phương trình hóa học:
2Al + 6HCl → 2AlCl3 + 3H2 (1)
Mg + 2HCl → MgCl2 + H2 (2)
b) nH2= 0,35 mol
Gọi x, y lần lượt là số mol của Al, Mg
Theo đề bài ta có:
27x + 24y = 7,5 (3)
Dựa vào phương trình (1), (2) ta có: 3/2x + y = 0,35 (4)
Giải hệ phương trình ta được: x = 0,1; y = 0,2
mAl = 27.0,1 = 2,7 gam => %mAl = (2,7/7,5).100 = 36%
%mMg = 100% - 36% = 64 %
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 12
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Phần 1. Trắc nghiệm khách quan
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Câu 1. Dãy nào dưới đây gồm các dung dịch muối tác dụng được với kim loại Mg?
A. ZnCl2, Fe(NO3)2 và CuSO4
B. CaCl2, NaCl và Cu(NO3)2
C. CaCl2, NaNO3 và FeCl3
D. Ca(NO3)2, FeCl2 và CuSO4
Câu 2. Để phân biệt được các dung dịch HCl, H2SO4 và Ba(OH)2 chỉ cần dùng kim loại nào sau đây?
| A. K | B. Na | C. Ba | D. Cu |
Câu 3. Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn
B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag
D. Ag, Fe, Zn, K
Câu 4. Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng nào sau đây xảy ra?
A. Sủi bọt khí, đá vôi không tan
B. Đá vôi tan dần, không sủi bọt khí.
C. Không sủi bọt khí, đá vôi không tan
D. Sủi bọt khí, đá vôi tan dần.
Câu 5. Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch.
A. NaNO3 và HCl
B. NaNO3 và BaCl2
C. K2SO4 và BaCl2
D. BaCO3 và NaCl
Câu 6. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH
B. H2O và dung dịch HCl
C. Dung dịch NaOH và H2O
D. Dung dịch CuCl2 và H2O
Câu 7. Muối nào dưới đây không bị nhiệt phân hủy
| A. KMnO4 | B. KClO3 | C. KNO3 | D. KCl |
Câu 8. Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong bình khí clo dư
(2) Cho Fe vào dung dịch HNO3 đặc, nguội
(3) Cho Fe vào dung dịch HCl loãng, dư
(4) Cho Fe vào dung dịch HCl loãng, dư
(5) Cho Fe vào dung dịch H2SO4 đặc, nóng
Số thí nghiệm tạo ra muối Fe(II) là:
| A. 3 | B. 4 | C. 2 | D. 1 |
Phần 2. Tự luận
Câu 1. (2 điểm) Hoàn thành sơ đồ phản ứng hóa học sau:
S → SO2 → SO3 → H2SO4 → SO2 → H2SO3 → Na2SO3 → SO2
Câu 2. (2 điểm) Có 3 lọ mất nhãn chứa 3 dung dịch HCl, H2SO4, BaCl2. Chỉ dùng quỳ tím và chính các chất này để xác định các dung dịch trên.
Câu 3. (3 điểm) Cho 2,56 gam Cu vào cốc đựng 40 ml dung dịch AgNO3 1 M. Sau phản khi phản ứng xảy ra hoàn toàn thu được dung dịch X và m gam chất rắn Y.
a) Xác định các chất trong dung dịch X và chất rắn Y.
b) Tính nồng độ mol chất tan trong X và giá trị của m. Giả sử thể tích dung dịch thay đổi không đáng kể.
Đáp án
Phần 1. Trắc nghiệm
| 1 A | 2 C | 3 D | 4 D |
| 5 C | 6 A | 7 D | 8 C |
Phần 2. Tự luận
Câu 1
(1) S + O2 SO2
(2) SO2 + O2 SO3
(3) SO3 + H2O → H2SO4
(4) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
(5) SO2 + H2O→ H2SO3
(6) H2SO3 + 2NaOH → Na2SO3 + 2H2O
(7) H2SO4 + Na2SO3 → Na2SO4 + SO2 + H2O
Câu 2. Trích mẫu thử và đánh số thứ tự.
Bước 1: Nhúng quỳ tím vào 3 dung dịch trên.
Dung dịch không làm đổi màu quỳ là BaCl2
Dùng dịch làm quỳ chuyển sang đỏ là: HCl, H2SO4
Bước 2: Nhỏ dung dịch BaCl2 vừa nhận biết được ở trên vào 2 dung dịch axit
Dung dịch không xảy ra phản ứng là HCl
Dung dịch phản ứng tạo kết tủa trắng là H2SO4 loãng
BaCl2 +H2SO4 → BaSO4 ↓+ 2HCl
Câu 3.
nCu = 0,04 mol
nAgNO3 = 0,04 mol
a) Phương trình hóa học:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,02 ← 0,04 → 0,02 → 0,04
Sau phản ứng, Cu dư, AgNO3 phản ứng hết
Vậy dung dich X: 0,02 mol Cu(NO3)2
Chất rắn Y: 0,04 mol Ag và 0,02 mol Cu dư
b) Nồng độ mol Cu(NO3)2
Khối lượng rắn Y
m = mAg + mCu(dư) = 0,04.108 + 0,02.64 = 5,6 gam
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 13
Chọn đáp án đúng nhất trong các câu hỏi dưới đây
Biết: Ba = 137, Na = 23, K = 39, Fe = 56, C = 12, H =1, O= 16, S = 32, Cl =35,5, Mg =24, Al =27; Zn = 65, Cu = 64
Câu 1. Chất phản ứng được với dung dịch acid Clohiđric sinh ra chất khí nhẹ hơn không khí, cháy trong không khí với nhọn lửa màu xanh nhạt:
| A. BaCO3 | B. Ag | C.FeCl3 | D. Zn |
Câu 2. Các khí ẩm được làm khô bằng CaO là:
| A. H2; O2; N2. | B. H2; CO2; N2. |
| C. H2; O2; SO2. | D. CO2; SO2; HCl. |
Câu 3. Dãy nào sau đây gồm các chất tác dụng được với dung dịch Ca(OH)2
A. CO2, NaHCO3, Na2CO3
B. CO, Na2CO3, NaCl
C. CO2, NaCl, NaHCO3
D. CO, CO2, Na2CO3
Câu 4. Trong các loại phân bón sau, loại phân bón nào có lượng đạm cao nhất?
| A. NH4NO3 | B. NH4Cl | C. (NH4)2SO4 | D. (NH2)2CO |
Câu 5. Chất tác dụng với axit sunfuric loãng tạo thành muối và nước:
| A. Cu | B. CuO | C. CuSO4 | D. CO2 |
Câu 6. Muối nào sau đây không bị nhiệt phân hủy
| A. CaCO3 | B. Na2CO3 | C. KNO3 | D. KClO3 |
Câu 7. Dung dịch Fe(NO3)3 có lẫn tạp chất AgNO3. Dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)3
| A. Ag | B. Fe | C. Cu | D. Zn |
Câu 8. Để trung hòa 11,2 gam KOH 20%, thì cần lấy bao nhiêu gam dung dịch axit H2SO4 35%
| A. 9gam | B. 4,6gam | C. 5,6gam | D. 1,7gam |
Câu 9. Dung dịch H2SO4 có thể tác dụng được
A. CO2, Mg, KOH.
B. Mg, Na2O, Fe(OH)3
C. SO2, Na2SO4, Cu(OH)2
D. Zn, HCl, CuO.
Câu 10. Hòa tan 2,4 gam oxit của kim loại hoá trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
| A. CuO | B. CaO | C. MgO | D. FeO |
Câu 11. Dung dịch của chất X có pH >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
| A. BaCl2 | B. NaOH | C. Ba(OH)2 | D. H2SO4 |
Câu 12. Có hai lọ đựng dung dịch bazơ NaOH và Ca(OH)2. Chất dùng để phân biệt hai chất trên:
| A. Na2CO3 | B. NaCl | C. MgO | D. HCl |
Câu 13. Những cặp chất cũng tồn tại trong một dung dịch.
A. KCl và NaNO3.
B. KOH và HCl
C. Na3PO4 và CaCl2
D. HBr và AgNO3.
Câu 14. Nhỏ vài giọt dung dịch FeCl3 vào ống nghiệm đựng 1ml dung dịch NaOH, thấy xuất hiện:
A .chất tan không màu
B. chất không tan màu trắng
C. chất không tan màu nâu đỏ
D. chất không tan màu xanh lơ
Câu 15. Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, thu được 2,24 lít khí(đktc). Phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 50% và 50%
C. 40% và 60%
D. 30% và 70%
Câu 16. Dãy nào dưới đây được sắp xếp theo thứ tự tăng dần mức độ hoạt động hóa học
A. Na, Al, Cu, Zn
B. Cu, Al, Zn, Na
C. Na, Al, Zn, Cu
D. Cu, Zn, Al, Na
Câu 17. Để nhận ra sự có mặt của các chất khí CO, CO2, trong hôn hợp khí gồm CO, CO2, O2, N2, có thể dẫn hỗn hợp khí qua.
A. bình đựng nước vôi trong dư, sau đó qua ống sứ đựng bột CuO nung nóng
B. ống sứ đựng bột CuO nung nóng, sau đó dẫn qua bình đựng nước vôi trong
C. bình (1) đựng nước và bình (2) đựng nước vôi trong
D. ống đựng bột CuO nung nóng, sau đó qua bình đựng nước
Câu 18. Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g NaOH. Muối được tạo thành là:
A. Na2CO3.
B. NaHCO3
C. Hỗn hợp Na2CO3 và NaHCO3.
D. Na(HCO3)2
Câu 20. Một phần lớn vôi sống được dùng trong công nghiệp luyện kim và làm nguyên liệu cho công nghiệp hóa học. Công thức hóa học của vôi sống là:
A. Na2O
B. Ca(OH)2
C. CaO
D. CaCO3
Câu 21. Cặp chất nào sau đây khi phản ứng không sinh khs CO2?
A. CaCO3 và HCl
B. K2CO3 và Ba(OH)2
C. CO và O2
D. KHCO3 và HCl
Câu 22. Sắt (III) oxit (Fe2O3) tác dụng được với:
A. Nước, sản phẩm là axit.
B. Axit, sản phẩm là muối và nước.
C. Nước, sản phẩm là bazơ.
D. Bazơ, sản phẩm là muối và nước.
Câu 23. Trong thành phần nước Gia-ven có
A. NaCl và HCl
B. NaCl và NaClO
C. NaClO và HCl
D. NaCl, NaClO3
Câu 24. Cho Clo tác dụng vừa đủ nhôm tạo ra 26,7 gam AlCl3: Số gam Cl2 cần dùng là:
| A. 21,3 gam | B. 12,3 gam | C. 13,2 gam | D. 23,1 gam |
Câu 25. Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3, MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm:
A. Cu, Al, Mg
B. Cu, Al, MgO
C. Cu, Al2O3, Mg
D. Cu, Al2O3, MgO
Câu 26. Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngập dưới nước) những tấm kim loại:
| A . Zn | B. Cu | C. Sn | D. Pb |
Câu 27. Cho dãy các kim loại sau: Fe, W, Hg, Cu kim loại trong dãy có nhiệt độ nóng chảy thấp nhất:
| A . W | B. Cu | C. Hg | D. Fe |
Câu 28. Dẫn 4,48 lít khí CO (đktc) đi vào ống đựng Fe2O3 nung nóng, sau một thời gian thấy khối lượng chất rắn trong ống giảm 2,4 gam. Khí đi ra khỏi ống có phần trăm thể tích CO2 bằng
| A. 25% | B. 75% | C. 50% | C. 40% |
Câu 29. Phát biểu nào sau đây không đúng?
A. Khi cho sắt tác dụng với dung dịch HCl tạo thành muối và FeCl2
B. Khi cho clo tác dụng với sắt tạo thành muối FeCl3
C. Khi cho clo tác dụng với sắt tạo thành muối FeCl2
D. Khi cho clo tác dụng với FeCl2 tạo thành muối FeCl3
Câu 30. Cho sơ đồ chuyển hóa sau:
Cacbon → X → Y → Z →Y
Các chất X, Y, Z có thể là
A. CO2, CaCO3, Ca(OH)2
B. CO, CO2, CaCO3
C. CO, CaCO3, Ca(HCO3)2
D. CO, Ca(HCO3)2, CaCO3
Đáp án
| 1 D | 2 A | 3 A | 4 D | 5 B | 6 B | 7 B | 8 C | 9 B | 10 A |
| 11 C | 12 A | 13 A | 14 C | 15 A | 16 C | 17A | 18 B | 19 D | 20 C |
| 21 B | 22 B | 23 C | 24 A | 25 D | 26 A | 27C | 28 B | 29 C | 30 B |
Hướng dẫn giải chi tiế 1 số câu hỏi khó
Câu 10.
Gọi kim loại hóa trị II là R => công thức oxit là RO
mHCl= 21,9.10%100%=2,19(gam) ⇒ nHCl = 0,06 mol
Phương trình hóa học
RO + 2HCl → RCl2 + H2O
0,03mol ← 0,06mol
⇒MRO=2,4/0,03 = 80 => MR + 10 = 80 => MR = 64
=> R là Cu
=> Công thức oxit cần tìm là CuO
Câu 15.
Chỉ có Zn phản ứng với H2SO4, Cu không phản ứng.
nH2 = 0,1 mol
Zn + H2SO4 → ZnSO4 + H2
0,1 ← 0,1 mol
=> mCu = 10,5 – mZn= 10,5 – 0,1.65 = 4 gam
%mZn= 6,5/10,5.100% = 61,9%;
%mCu = 38,1%
Câu 18.
Phương trình hóa học:
CO2+ 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
Xét tỉ lệ: nNaOH/nCO2 = a
+ Gía trị a = 1 ⇒ Sản phẩm tạo muối NaHCO3
+ Gía trị a = 2 ⇒ Sản phẩm tạo muối Na2CO3
+1 < a < 2 ⇒ Sản phẩm tạo muối Na2CO3 và muối NaHCO3
Cụ thể ở bài này:
Số mol CO2 = 11,2 /22,4 = 0,5 (mol)
Số mol NaOH = 20/40 = 0,5 (mol)
Gía trị a = 1 ⇒ Sản phẩm tạo muối NaHCO3
Câu 28.
CO + Ooxit→ CO2
Ta có: mO = mgiảm = 2,4 (gam)
Có : nCO pư= nCO2= nO= 2,4/16 = 0,15 (mol)
Sau phản ứng, khí gồm :
CO2: 0,15 (mol)
CO : 0,2 - 0,15 = 0,05(mol)
Vậy :
%VCO2 = 0,15/(0,15 + 0,05).100%=75%
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 14
Câu 1. Dung dịch H2SO4 tác dụng với dãy chất là:
A. Fe, CaO, HCl.
B. Cu, BaO, NaOH.
C. Mg, CuO, HCl.
D. Zn, BaO, NaOH.
Câu 2. Để phân biệt 2 dung dịch HCl và H2SO4. Người ta dùng thuốc thử là:
A. Quỳ tím.
B. Zn.
C. dung dịch NaOH.
D. dung dịch BaCl2.
Câu 3. Chất gây ô nhiễm và mưa axit là
A. Khí O2.
B. Khí SO2.
C. Khí N2.
D. Khí H2.
Câu 4. Chất tác dụng được với HCl và CO2:
A. Sắt
B. Nhôm
C. Kẽm
D. Dung dịch NaOH.
Câu 5. Phương pháp được dùng để sản xuất khí sunfurơ trong công nghiệp.
A. Phân hủy canxi sunfat ở nhiệt độ cao.
B. Đốt cháy lưu huỳnh trong oxi.
C. Cho đồng tác dụng với axit sunfuric đặc, nóng.
D. Cho muối natrisunfit tác dụng với axit clohiđric.
Câu 6. Dùng Canxi oxit để làm khô khí:
A. Khí CO2
B. Khí SO2
C. Khí HCl
D. CO
Câu 7. Dung dịch axit mạnh không có tính chất là:.
A. Tác dụng với oxit axit tạo thành muối và nước.
B. Tác dụng với bazơ tạo thành muối và nước.
C. Tác dụng với nhiều kim loại giải phóng khí hiđrô.
D. Làm đổi màu quỳ tím thành đỏ.
Câu 8. Hòa tan 23,5 gam K2O vào nước. Sau đó dùng 250ml dung dịch HCl để trung hòa dung dịch trên. Tính nồng độ mol HCl cần dùng.
| A. 1,5M | B. 2,0M | C. 2,5 M | D. 3,0 M |
Câu 9. Khí lưu huỳnh đioxit SO2 được tạo thành từ cặp chất là
A. K2SO4 và HCl.
B. K2SO4 và NaCl.
C. Na2SO4 và CuCl2
D. Na2SO3 và H2SO4
Câu 10. Dung dịch của chất X có pH >7 và khi tác dụng với dung dịch kali sunfat tạo ra chất không tan. Chất X là.
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4.
Câu 11. Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh; nhỏ từ từ dung dịch H2SO4 cho tới dư, vào dung dịch có màu xanh trên thì.
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn.
C. Màu xanh nhạt dần rồi mất hẳn, rồi chuyển sanh màu đỏ
D. Màu xanh đậm thêm dần.
Câu 12. Để phân biệt 3 gói bột: Fe, Cu và Al có thể dùng các dung dịch
A. NaOH và FeCl2
B. HCl và CuCl2
C. Ca(OH)2 và NaCl
D. HCl và NaOH
Câu 13. Có những chất khí sau: CO2; H2; O2; SO2; CO. Khi nào làm đục nước vôi trong .
A. CO2
B. CO2; CO; H2
C. CO2 ; SO2
D. CO2; CO; O2
Câu 14. CaO phản ứng được với tất cả các chất trong dãy
A. NaOH; CaO; H2O
B. CaO; K2SO4; Ca(OH)2
C. H2O; Na2O; BaCl2
D.CO2; H2O; HCl
Câu 15. Khí CO tác dụng được với tất cả các chất trong dãy nào sau đây?
A. Fe2O3, CuO, O2, PbO
B. CuO, CaO, C, O2
C. Al2O3, C, O2, PbO
D. Fe2O3, Al2O3, CaO, O2
Câu 16. Đốt cháy 48 gam Lưu huỳnh với khí oxi, sau phản ứng thu được 96 gam khí Sunfuro. Khối lượng của oxi tác dụng là:
A. 40g
B. 44g
C. 48g
D. 52g
Câu 17. Để hòa tan hoàn toàn 1,3 g kẽm thì cần 14,7g dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng hiđro thu được là:
A. 0,03g
B. 0,04g
C. 0,05g
D. 0,06g
Câu 18. Hòa tan hoàn toàn 14,40 gam kim loại M (hóa trị II) trong dung dịch H2SO4 loãng, dư thu được 13,44 lít khí H2 (đktc). Kim loại M là :
A . Mg
B. Ca
C. Be
D. Ba
Câu 19. Phản ứng giữa các chất nào sau đây không tạo ra muối sắt (II)?
A. Fe với dung dịch HCl
B. Fe với dung dịch HgCl2
C. FeO với dung dịch H2SO4 loãng
D. Fe với Cl2
Câu 20. Khối lượng Fe có thể điều chế được 200 tấn quặng hematit chứa 60% Fe2O3 là
A. 42 tấn
B. 64 tấn
C. 80 tấn
D. 78,13 tấn
Câu 21. Đinh sắt không bị ăn mòn trong trường hợp nào sau đây?
A. Để đinh sắt trong không khí khô.
B. Ngâm đinh sắt trong ống nghiệm đựng nước có hòa tan khí oxi.
C. Ngâm đinh sắt trong ống nghiệm đựng nước muối
D. Ngâm đinh sắt trong ống nghiệm đựng nước có nhỏ vài giọt axit HCl
Câu 22. Để sản xuất gang trong công nghiệp, cần có các nguyên liệu:
A. Quặng pirit sắt (FeS2), than cốc, không khí và chất phụ gia
B. Sắt phế thải, than cốc, không khí và chất phụ gia.
C. Sắt phế thải, không khí và chất phụ gia
D. Quặng sắt hemantit (Fe2O3) hoặc manhetit (Fe3O4), tha cốc, không khí và chất phụ gia
Câu 23. Muối Fe(NO3)2 có lẫn ít muối AgNO3. Có thể dùng kim loại nào sau đây để làm sạch dung dịch Fe(NO3)2?
A. Zn
B. Fe
C. Cu
D. Ag
Câu 24. Cho 5,4 gam hỗn hợp 2 kim loại Fe và Zn tác dụng hoàn toàn với 90 ml dung dịch HCl 2M. Khối lượng muối thu được là
A. 11,79 gam
B. 11,5 gam
C. 15,71 gam
D. 17,19 gam
Câu 25. Cho 5,4 gam Al vào dung dịch NaOH loãng, dư, sau phản ứng thu được V lít khí H2 (ở đktc)
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 5,04 lít
Câu 26. Các đồ vật bằng nhôm bền trong không khí và nước là do:
A. Có một lớp Al(OH)3 bên ngoài bảo vệ
B. Có một lớp Al2O3 bên ngoài bảo vệ
C. Nhôm không tan trong nước
D. Nhôm bền, không bị oxi hóa
Câu 27. Kim loại X có nhiệt độ nóng chảy cao nhất, được sử dụng làm dây tóc bóng đèn. Kim loại X là:
A. Vonfram
B. Sắt
C. Thủy ngân
D. Vàng
Câu 28. Dãy nào dưới đây được sắp xếp theo thứ tự giảm dần mức độ hoạt động hóa học
A. K, Ag, Fe, Zn
B. Ag, Fe, K, Zn
C. K, Zn, Fe, Ag
D. Ag, Fe, Zn, K
Câu 29. Trong số các kim loại X, Y, Z, T thì chỉ có:
X và Y đứng trước H trong dãy hoạt động hóa học kim loại
X và T đẩy được Z ra khỏi dung dịch muối tương ứng.
Dãy sắp xếp các kim loại theo chiều giảm dần mức độ hoạt động hóa học là
A. X, Y, Z, T
B. X, Y, T, Z
C. Z, T, X, Y
D. Y, X, T, Z
Câu 30. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và AgNO3, sản phẩm thu được gồm
A. hai kim loại và một muối
B. ba kim loại và một muối
C. ba kim loại và hai muối
D. hai kim loại và 2 muối
Đáp án
| 1 D | 2 D | 3 B | 4 D | 5 C | 6 D | 7 A | 8 B | 9 D | 10 C |
| 11 C | 12 A | 13 C | 14 D | 15 A | 16 C | 17 B | 18 A | 19 D | 20 B |
| 21 A | 22 D | 23 B | 24 A | 25 B | 26 B | 27 A | 28 D | 29 D | 30 C |
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học ...
Môn: Hóa học
Thời gian làm bài: 45 phút
Đề thi Học kì 1 Hóa học lớp 9 có đáp án đề số 15
Câu 1. Oxit axit nào sau đây được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm?
| A. SO2 | B. SO3 | C. N2O5 | D. P2O5 |
Câu 2. Kim loại nào sau đây là kim loại dẻo nhất trong số các kim loại?
| A. Ag (bạc) | B. Au (vàng) | C. Al (nhôm) | D. Cu (đồng) |
Câu 3. Khí O2 bị lẫn tạp chất là các khí CO2, SO2, H2S. Có thể dùng chất nào sau đẩy để loại bỏ tạp chất?
A. Nước
B. Dung dịch H2SO4 loãng
C. Dung dịch CuSO4
D. Dung dịch Ca(OH)2
Câu 4. Sản phẩm của phản ứng phân hủy Cu(OH)2 bởi nhiệt là:
A. CuO và H2
B. Cu, H2O và O2
C. Cu, O2 và H2
D. CuO và H2O
Câu 24. Cho a g CuO tác dụng với dung dịch H2SO4 thu được 200g dung dịch CuSO4 nồng độ 16%. Giá trị của a là:
| A. 12g | B. 14g | C. 15g | D. 16g |
Câu 5. Dùng thuốc thử nào sau đây có thể dùng để phân biệt dung dịch Na2SO4 và dung dịch Na2CO3?
A. dung dịch BaCl2
B. dung dịch axit HCl
C. dung dịch Pb(NO3)2
D. dung dịch AgNO3
Câu 6. Cặp chất nào trong số các cặp chất cho dưới đây có thể cùng tồn tại trong một dung dịch?
A. NaOH và HBr
B. H2SO4 và BaCl2
C. KCl và NaNO3
D. NaCl và AgNO3
Câu 7. Cho các chất: Ca, Ca(OH)2, CaCO3, CaO. Dãy biến đổi nào sau đây có thể thực hiện được?
A. Ca → CaCO3 → Ca(OH)2 → CaO
B. Ca → CaO → Ca(OH)2 → CaCO3
C. CaCO3 → Ca → CaO → Ca(OH)2
D. CaCO3 → Ca(OH)2 → Ca → CaO
Câu 8. Dãy kim loại nào sau đây được sắp theo thứ tự hoạt động hóa học tăng dần?
A. Na, Al, Zn, Fe, Cu, Ag
B. Al, Na, Zn, Fe, Ag, Cu
C. Ag, Cu, Fe, Zn, Al, Na
D. Ag, Cu, Fe, Zn, Al, Na
Câu 9. Có dung dịch AlCl3 lẫn tạp chất là CuCl2. Có thể dùng chất nào sau đây để làm sạch muối nhôm?
| A. AgNO3 | B. HCl | C. Mg | D. A |
Câu 10. Dung dịch Ba(OH)2 có phản ứng với tất cả các chất nào sau đây:
A. FeCl3, MgCl2, CuO, HNO3
B. H2SO4, SO2, CO2, FeCl2
C. NaOH, HCl, CuSO4, KNO3
D. Fe2O3, Al, H3PO4 , BaCl2
Câu 11. Cho 5,6g bột sắt vào bình khí clo có dư. Sau đó thu được 16,25g muối sắt. Tính khối lượng khí clo đã tham gia phản ứng?
| A. 11,5g | B. 10,65g | C. 13,17g | D. 11,82g |
Câu 12. Chất nào sau đây không phản ứng với Cl2?
| A. NaCl | B. NaOH | C. Fe | D. Ca(OH)2 |
Câu 13. Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. Khối lượng dung dịch NaOH cần dùng là:
| A. 100 gam | B. 80 gam | C. 90 gam | D. 150 gam |
Câu 14. Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g NaOH. Muối được tạo thành là:
| A. Na2CO3. | B. NaHCO3 |
| C. Hỗn hợp Na2CO3 và NaHCO3. | D. Na(HCO3)2 |
Câu 15. Để phân biệt 3 kim loại Fe, Mg và Al cần dùng
A. Dung dịch HCl và dung dịch NaOH
B. H2O và dung dịch HCl
C. Dung dịch NaOH và H2O
D. Dung dịch CuCl2 và H2O
Câu 16. Kim loại có hóa trị II. Cho 8,4 gam kim loại này tác dụng hết với dung dịch HCl sinh ra 7,84 lít khí hidro (đktc). Kim loại M là:
| A. Cu | B. Zn | C. Mg | D. Fe |
Câu 17. Trong trường hợp nào sau đây thanh nhôm bị ăn mòn nhanh nhất?
A. Ngâm trong lọ đựng nước cất
B. Ngâm trong lo đựng dung dịch CuCl2
C. Ngâm trong lọ đựng dung dịch HCl loãng.
D. Ngâm trong lọ đựng dung dịch HCl đặc nóng.
Câu 18. Chọn phản ứng thích hợp để phân biệt 3 khí: CO, Cl2 và CO2
A. Dùng giấy quỳ tím ướt
B. Dùng phenolphtalein
C. Dùng dung dịch Ca(OH)2
D. Dùng dung dịch KCl
Câu 19. Thực hiện các thí nghiệm sau
1) Đốt dây sắt trong bình đựng khí oxi
2) Cho miếng kẽm tác dụng với HCl
3) Cho Sắt tác dụng với dung dịch H2SO4 đặc nóng
4) Cho nhôm tác dụng với dung dịch kiềm NaOH
Số thí nghiệm phản ứng sinh ra khí hidro là:
| A. 1 | B. 2 | C. 3 | D. 4 |
Câu 20. Khi cho kim loại Mg (dư) vào dung dịch gồm 2 muối Cu(NO3)2 và AgNO3, sản phẩm thu được gồm
A. hai kim loại và một muối
B. ba kim loại và một muối
C. ba kim loại và hai muối
D. hai kim loại và 2 muối
Câu 21. Trong phòng thí nghiệm, khí CO2 thường được điều chế bằng cách nào.
A. cho dung dịch HCl tác dụng với đá vôi
B. nhiệt phân canxi cacbonat
C. đốt cacbon trong bình khí oxi
D. nhiệt phân NaHCO3 trong dung dịch
Câu 22. Dung dịch axit clohiđric tác dụng với đồng (II) hiđrôxit tạo thành dung dịch màu:
| A. Vàng đậm | B. Đỏ | C. Xanh lam | D. Da cam |
Câu 23. Để trung hòa tan dung dịch chứa 16 gam NaOH cần 100 gam dung dịch H2SO4. Nồng độ phần trăm của dung dịch axit đã dùng là:
| A. 19,6% | B. 16,9% | C. 32,9% | D. 39,2% |
Câ 24. Một hợp chất có chứa 27,59% oxi về khối lượng, còn lại là Fe. Công thức của oxit sắt đó là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe(OH)2
Câu 25. Phát biểu nào sau đây đúng?
A. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
B. Gang là hợp kim của sắt với cacbon và một số nguyên tố khác, trong hàm lượng cacbon lớn hơn 5%.
C. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm từ 2 - 5%.
D. Gang là hợp kim của nhôm với cacbon và một số nguyên tố khác, trong hàm lượng cacbon chiếm lớn hơn 5%.
Câu 26. Cặp chất nào dưới đây không xảy ra phản ứng
A. Fe và CuCl2
B. Fe và Fe2(SO4)3
C. Fe và H2SO4 đặc nguội
D. Fe và HCl
Câu 27. Chất tác dụng với dung dịch HCl tạo thành chất khí nhẹ hơn không khí là:
A. Mg
B. CaCO3
C. MgCO3
D. Na2SO3
Câu 28. Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may đánh vỡ nhiệt kế thủy ngân thì có thể dùng chất nào cho dưới đây để khử độc?
A. Bột sắt
B. Bột lưu huỳnh
C. Nước
D. Nước vôi
Câu 29. Trộn bột C vừa đủ với hỗn hợp bột gồm Al2O3, CuO và FeO, sau đó cho hỗn hợp vào ống sứ nung nóng đến khi phản ứng hoàn toàn. Chất rắn thu được trong ống sứ là
A. Al, Fe, Cu
B. Al, FeO, Cu
C. Al2O3, FeO, Cu
D. Al2O3, Fe, Cu
Câu 30. Khử 4,64g hỗn hợp A gồm FeO, Fe3O4, Fe2O3 có số mol bằng nhau bằng CO thu được chất rắn B. Khí thoát ra sau phản ứng được dẫn vào dung dịch Ba(OH)2 dư thu được 1,97g kết tủa. Khối lượng của chất rắn B là:
| A. 4,4g | B. 4,84g | C. 4,48g | D. 4,45g |
Đáp án
| 1D | 2B | 3D | 4D | 5B | 6C | 7B | 8A | 9D | 10B |
| 11B | 12A | 13B | 14B | 15A | 16C | 17D | 18A | 19B | 20C |
| 21A | 22C | 23 | 24B | 25A | 26C | 27A | 28A | 29D | 30C |
Để xem trọn bộ Đề thi Hóa học 9 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi lớp 9 chọn lọc, hay khác:
Đề thi Học kì 1 Sinh học lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Ngữ văn lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Địa Lí lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Vật lí lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 1 Lịch sử lớp 9 năm 2022 - 2023 có đáp án
Xem thêm các chương trình khác:
- Góp ý sgk lớp 9 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi vào 10 môn Toán | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Toán mới nhất
- Đề thi vào 10 môn Địa lí
- Đề thi vào 10 môn Văn | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Ngữ Văn mới nhất
- Đề thi vào 10 môn Tiếng Anh | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Tiếng Anh mới nhất