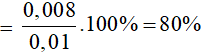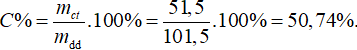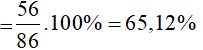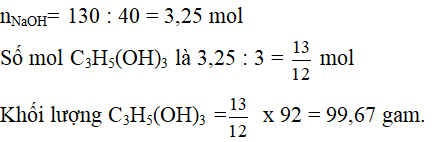TOP 15 Đề thi Học kì 2 Hoá học 9 năm 2024 có đáp án
Bộ 15 Đề thi Học kì 2 Hoá học lớp 9 năm 2024 có đáp án chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 9 Học kì 2. Mời các bạn cùng đón xem:
Chỉ từ 150k mua trọn bộ Đề thi Học kì 2 Hóa học 9 bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận tài liệu.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi Học kì 2 Hoá học lớp 9 năm 2023 - 2024 có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 1
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
Câu 1: Điều kiện để xảy ra phản ứng giữa metan và khí clo là
A. Có ánh sáng
B. Có axit làm xúc tác
C. Có sắt làm xúc tác
D. Có nhiệt độ
Câu 2: Khí C2H4 và CH4 có tính chất hóa học giống nhau là
A. Tham gia phản ứng cháy với khí oxi sinh ra khí CO2 và nước
B. Tham gia phản ứng trùng hợp
C. Tham gia phản ứng thế với brom khi chiếu sáng
D. Tham gia phản ứng cộng với dung dịch brom
Câu 3: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là
A. Etan
B. Axetilen
C. Etilen
D. Metan
Câu 4: Khi dẫn khí etilen vào dung dịch brom đựng trong ống nghiệm có quan sát thấy
A. Màu của dung dịch brom không thay đổi
B. Màu của dung dịch brom nhạt dần, có khí thoát ra
C. Màu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm
D. Màu của dung dịch brom nhạt dần, có chất kết tủa
Câu 5: Trong phân tử benzen có
A. 9 liên kết đơn, 6 liên kết đôi
B. 9 liên kết đơn, 3 liên kết đôi
C. 12 liên kết đơn, 3 liên kết đôi
D. 6 liên kết đơn, 3 liên kết đôi
Câu 6: Những chất cháy được khi cháy tỏa nhiệt và phát sang được gọi là
A. Điện năng
B. Vật liệu
C. Nhiên liệu
D. Nguyên liệu
Câu 7: Khi đốt cháy hoàn toàn 10,4 gam metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
A. 8,89 lít
B. 9,60 lít
C. 10,08 lít
D. 14,56 lít
Câu 8: Thành phần chính của khí thiên nhiên và khí dầu mỏ là
A. Metan
B. Benzen
C. Các hiđrocacbon no
D. Các hiđrocacbon không no
Câu 9: Dẫn 0,55 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 124 gam
B. 176 gam
C. 165 gam
D. 138 gam
Câu 10: Sự cố tràn dầu do chìm tàu chở dầu là thảm họa môi trường vì
A. Do dầu không tan trong nước
B. Do dầu sôi ở những nhiệt độ khác nhau
C. Do dầu nhẹ hơn nước, nổi trên mặt nước cản sự hòa tan của khí oxi làm các sinh vật dưới nước bị chết
D. Dầu lan rộng trên mặt nước bị sóng, gió cuốn đi xa rất khó xử lí
Câu 11: Thể tích khí oxi (đktc) cần dùng để đốt cháy hoàn toàn 11,5 gam rượu etylic nguyên chất là
A. 16,8 lít
B. 20,2 lít
C. 17,8 lít
D. 18,9 lít
Câu 12: Rượu etylic được điều chế từ nguồn nào sau đây?
A. Tinh bột
B. Glucozơ
C. Etilen
D. Cả A, B, C đều đúng
Câu 13: Cho các phát biểu sau:
(1) Trong phân tử rượu etylic có một nguyên tử hiđro không liên kết với nguyên tử cacbon mà liên kết với nguyên tử oxi, tạo ra nhóm –OH.
(2) Rượu etylic tác dụng với axit axetic thu được este.
(3) Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
(4) Nhiệt độ sôi của rượu etylic cao hơn nhiệt độ sôi của nước.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 14: Ứng dụng của axit axetic là
A. Pha giấm ăn
B. Điều chế dược phẩm, thuốc diệt cỏ, diệt côn trùng, phẩm nhuộm
C. Điều chế tơ sợi nhân tạo
D. Cả A, B, C đều đúng
Câu 15: Cho 8 gam NaOH tác dụng với dung dịch CH3COOH, sau phản ứng thu được m gam muối. Giá trị của m là
A. 14,6 gam
B. 16,4 gam
C. 18,6 gam
D. 19,8 gam
Câu 16: Chất có phản ứng trùng hợp tạo nên PE là
A. Etanol
B. Etilen
C. Amino axit
D. Metan
Câu 17: Để phân biệt hai dung dịch C2H5OH và CH3COOH người ta dùng
A. CaO khan
B. Dung dịch NaOH
C. Na
D. Qùy tím
Câu 18: Cho sơ đồ phản ứng sau:
(C17H35COO)3C3H5 + NaOH C17H35COONa + C3H5(OH)3
Tổng hệ số các chất trong phương trình phản ứng trên là
A. 5
B. 6
C. 7
D. 8
Câu 19: Tính chất hóa học đặc trưng của chất béo là
A. Tác dụng với rượu
B. Tác dụng với oxi
C. Tác dụng với nước (thủy phân)
D. Tác dụng với hiđro
Câu 20: Trong công nghiệp để tráng gương soi hay ruột phích nước người ta cho dung dịch AgNO3 trong NH3 tác dụng với
A. Axetilen
B. Glucozơ
C. Saccarozơ
D. Anđehit fomic
Câu 21: Chất hữu cơ A có các tính chất sau: Chất kết tinh không màu, vị ngọt, dễ tan trong nước. Vậy chất hữu cơ A là
A. Etilen
B. Glucozơ
C. Chất béo
D. Axit axetic
Câu 22: Cho 18 gam glucozơ lên men rượu, thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 4,48 lít
B. 2,24 lít
C. 1,12 lít
D. 0,56 lít
Câu 23: Trong công nghiệp saccarozơ được sản xuất chủ yếu từ
A. Củ cải đường
B. Mật ong
C. Quả nho
D. Cây mía
Câu 24: Thủy phân hoàn toàn m gam saccarozơ, thu được 72 gam glucozơ. Giá trị của m là
A. 136,8 gam
B. 135,6 gam
C. 134,9 gam
D. 133,8 gam
Câu 25: Tinh bột và saccarozơ đều có khả năng tham gia phản ứng
A. Hòa tan Cu(OH)2
B. Trùng ngưng
C. Tráng gương
D. Thủy phân
Câu 26: Phân tử khối của tinh bột khoảng 299700 đvC. Số mắt xích (- C6H10O5-) trong phân tử tinh bột là
A. 2050
B. 1950
C. 1850
D. 1750
Câu 27: Tinh bột và xenlulozơ khác nhau ở điểm nào?
A. Công thức phân tử
B. Tính tan trong nước lạnh
C. Phản ứng thủy phân
D. Cấu trúc phân tử
Câu 28: Khi thủy phân hoàn toàn 500 gam protein A thì thu được 178 gam alanin. Nếu phân tử của A là 50000 thì số mắt xích alanin trong phân tử A là
A. 100
B. 200
C. 300
D. 400
Câu 29: Phát biểu nào sau đây là đúng?
A. Protein có khối lượng phân tử lớn và cấu tạo đơn giản
B. Protein có khối lượng phân tử lớn và do nhiều phân tử amino axit giống nhau tạo nên
C. Protein có khối lượng phân tử rất lớn và cấu tạo cực kì phức tạp do nhiều lại amino axit tạo nên
D. Protein có khối lượng phân tử lớn và do nhiều phân tử axit aminoaxetic tạo nên
Câu 30: Trùng hợp 4,48 lít C2H4 ở đktc, nếu hiệu suất phản ứng là 80% thì khối lượng polime thu được là bao nhiêu? (Biết hệ số trùng hợp là 500)
A. 1,12 gam
B. 2,24 gam
C. 4,48 gam
D. 5,60 gam
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 1
|
1A |
2A |
3B |
4C |
5B |
6C |
7D |
8A |
9B |
10C |
|
11A |
12D |
13C |
14D |
15B |
16B |
17D |
18D |
19C |
20B |
|
21B |
22A |
23D |
24A |
25D |
26C |
27D |
28B |
29C |
30C |
Câu 1:
Đáp án A
Điều kiện để xảy ra phản ứng giữa metan và khí clo là có ánh sáng
Phương trình phản ứng:
Câu 2:
Đáp án A
Khí C2H4 và CH4 có tính chất hóa học giống nhau là tham gia phản ứng cháy với khí oxi sinh ra khí CO2 và nước.
Câu 3:
Đáp án B
Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là: Axetilen.
Khi axetilen cháy trong oxi, nhiệt độ ngọn lửa có thể lên đến 3000oC. Vì vậy axetilen được dùng làm nhiên liệu trong đèn xì oxi – axetilen để hàn cắt kim loại.
Câu 4:
Đáp án C
Khi dẫn khí etilen vào dung dịch brom đựng trong ống nghiệm có quan sát thấy màu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm.
Phương trình phản ứng:
Câu 5:
Đáp án B
Trong phân tử benzen có 9 liên kết đơn, 3 liên kết đôi.
Câu 6:
Đáp án C
Nhiên liệu là những chất cháy được, khi cháy tỏa nhiệt và phát sáng.
Câu 7:
Đáp án D
= 0,65 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,65 mol
Vậy thể tích khí CO2 thu được là: = 0,65.22,4 = 14,56 lít.
Câu 8:
Đáp án A
Thành phần chính của khí thiên nhiên và khí dầu mỏ là: Metan
Câu 9:
Đáp án B
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 1,1 mol
⇒ = 1,1.160 = 176 gam.
Câu 10:
Đáp án C
Sự cố tràn dầu do chìm tàu chở dầu là thảm họa môi trường do dầu nhẹ hơn nước, nổi trên mặt nước cản sự hòa tan của khí oxi làm các sinh vật dưới nước bị chết.
Câu 11:
Đáp án A
= 0,25 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có = 0,75 mol
⇒ = 0,75.22,4 = 16,8 lít.
Câu 12:
Đáp án D
Rượu etylic được điều chế từ: Tinh bột, Glucozơ, Etilen.
(C6H10O5)n (tinh bột) + nH2O nC6H12O6 (glucozơ)
C6H12O6 (glucozơ) 2C2H5OH (rượu etylic) + 2CO2
C2H4 + H2O C2H5OH
Câu 13:
Đáp án C
Số phát biểu đúng là (1), (2), (3)
Phát biểu (4) sai vì nhiệt độ sôi của rượu etylic là 78,3oC
Câu 14:
Đáp án D
Ứng dụng của axit axetic là
+ Pha giấm ăn
+ Điều chế dược phẩm, thuốc diệt cỏ, diệt côn trùng, phẩm nhuộm
+ Điều chế tơ sợi nhân tạo
Câu 15:
Đáp án B
nNaOH = = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: (mol)
Khối lượng của CH3COONa là: m = 0,2.82 = 16,4 gam
Câu 16:
Đáp án B
Chất có phản ứng trùng hợp tạo nên PE là: Etilen
Phương trình phản ứng: nCH2=CH2 (-CH2-CH2-)n
Câu 17:
Đáp án D
Dùng quỳ tím để phân biệt hai dung dịch C2H5OH và CH3COOH:
+ Axit axetic làm quỳ tím hóa đỏ
+ Rượu etylic không làm quỳ tím đổi màu
Câu 18:
Đáp án D
Phương trình phản ứng sau:
(C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3
Tổng hệ số các chất trong phương trình phản ứng trên là: 1 + 3 + 3 + 1 = 8
Câu 19:
Đáp án C
Tính chất hóa học đặc trưng của chất béo là tác dụng với nước (thủy phân).
Câu 20:
Đáp án B
Trong công nghiệp để tráng gương soi hay ruột phích nước người ta cho dung dịch AgNO3 trong NH3 tác dụng với glucozơ.
Câu 21:
Đáp án B
Chất hữu cơ A có các tính chất: Chất kết tinh không màu, vị ngọt, dễ tan trong nước. Vậy chất hữu cơ A là: Glucozơ.
Câu 22:
Đáp án A
= 0,1 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,2 mol
Thể tích CO2 thu được ở đktc là: V = 0,2.22,4 = 4,48 lít.
Câu 23
Đáp án D
Trong công nghiệp saccarozơ được sản xuất chủ yếu từ: Cây mía
Câu 24
Đáp án A
= 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,4 mol
Vậy khối lượng C12H22O11 là: m = 0,4.342 = 136,8 gam
Câu 25
Đáp án D
Tinh bột và saccarozơ đều có khả năng tham gia phản ứng thủy phân.
Câu 26
Đáp án C
Số mắt xích là: = 1850
Câu 27:
Đáp án D
Tinh bột và xenlulozơ khác nhau ở cấu trúc phân tử
Câu 28:
Đáp án B
Ta có: Protein A →
= 0,01 mol
Suy ra nalanin = 0,01n = = 2
Vậy n = 200
Câu 29:
Đáp án C
Protein có khối lượng phân tử rất lớn và cấu tạo cực kì phức tạp do nhiều lại amino axit tạo nên
Câu 30
Đáp án C
Số mol etilen là: = 0,2 mol
Khối lượng của C2H4 là: = 0,2.28 = 5,6 gam
Phương trình phản ứng:
500CH2=CH2 (-CH2-CH2-)500
Áp dụng định luật bảo toàn khối lượng ta có: metilen = mpoli etilen = 5,6 gam
Mà H = 80%
Vậy khối lượng polime thu được là: mpolime = 5,6.80% = 4,48 gam
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 2
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
Câu 1: Hợp chất hữu cơ là
A. Hợp chất khó tan trong nước
B. Hợp chất của cacbon và một số nguyên tố khác trừ N, Cl, O
C. Hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại,…
D. Hợp chất có nhiệt độ sôi cao
Câu 2: Thành phần phần trăm về khối lượng của nguyên tố C trong C3H8O là
A. 30%
B. 40%
C. 50%
D. 60%
Câu 3: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. Ion
B. Hiđro
C. Kim loại
D. Cộng hóa trị
Câu 4: Một hợp chất X chứa 2 nguyên tố C, H có tỉ lệ khối lượng là mC : mH = 6 : 1. Hợp chất X có khối lượng mol phân tử là 56. Công thức phân tử của hợp chất X là
A. C5H10
B. C3H6
C. C5H9
D. C4H8
Câu 5: Đốt cháy 4,8 gam metan trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít
B. 4,48 lít
C. 5,60 lít
D. 6,72 lít
Câu 6: Tính chất vật lý của metan là
A. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước
B. Chất lỏng, không màu, tan nhiều trong nước
C. Chất khí, không màu, mùi xốc, nặng hơn không khí, ít tan trong nước
D. Chất khí, màu vàng lục, tan nhiều trong nước
Câu 7: Phản ứng đặc trưng của etilen là
A. Phản ứng cháy
B. Phản ứng thế
C. Phản ứng cộng
D. Phản ứng phân hủy
Câu 8: Tính thể tích dung dịch brom 2M cần để tác dụng với 0,448 lít khí axetilen?
A. 0,01 lít
B. 0,04 lít
C. 0,03 lít
D. 0,02 lít
Câu 9: Phản ứng đặc trưng của benzen là
A. Phản ứng cháy
B. Phản ứng trùng hợp
C. Phản ứng thế với brom (có mặt bột sắt)
D. Phản ứng hóa hợp với brom (có mặt bột sắt)
Câu 10: Cho các phát biểu sau:
(1) Benzen là chất lỏng, không màu, nhẹ hơn nước, không tan trong nước, hòa tan nhiều chất như: dầu ăn, cao su, nến, iot…
(2) Benzen cháy trong không khí tạo ra CO2 và H2O. Tuy nhiên, khi benzen cháy trong không khí còn sinh ra muội than.
(3) Do phân tử có cấu tạo đặc biệt nên phản ứng cộng của benzen xảy ra khó hơn so với etilen và axetilen.
(4) Benzen có ứng dụng là kích thích hoa quả mau chín.
Số phát biểu đúng là
A. 1
B. 2
C. 3
D. 4
Câu 11: Để dập tắt xăng, dầu cháy người ta
A. Phun nước vào ngọn lửa
B. Dùng chăn ướt chùm lên ngọn lửa
C. Phủ cát vào ngon lửa
D. B và C đều đúng
Câu 12: Đốt cháy V lít khí thiên nhiên chứa 96% CH4, 2% N2 và 2%CO2 về thể tích. Toàn bộ sản phẩm cháy được dẫn qua dung dịch Ca(OH)2 dư thấy tạo ra 19,6 gam kết tủa. Giá trị của V là
A. 6,50 lít
B. 8,96 lít
C. 4,48 lít
D. 13,44 lít
Câu 13: Rượu etylic được điều chế từ nguồn nào sau đây?
A. Tinh bột
B. Glucozơ
C. Etilen
D. Cả A, B, C đều đúng
Câu 14: Dầu mỏ ở nước ta có đặc điểm là
A. Nhiều parafin, nhiều lưu huỳnh
B. Nhiều parafin, ít lưu huỳnh
C. Ít parafin, nhiều hợp chất lưu huỳnh
D. Ít parafin, ít lưu huỳnh
Câu 15: Để sử dụng hiệu quả nhiên liệu, tránh gây lãng phí và làm ô nhiễm môi trường cần đảm bảo
A. Cung cấp đủ không khí hoặc oxi cho quá trình cháy như: thổi thêm khí vào lò, xây ống khói cao để hút gió …
B. Tăng diện tích tiếp xúc của nhiên liệu rắn với với không khí hoặc oxi như chẻ nhỏ củi, đập nhỏ than khi đốt cháy…
C. Điều chỉnh lượng nhiên liệu để duy trì sự cháy cần thiết phù hợp với nhu cầu sử dụng
D. Cả A, B, C đều đúng
Câu 16: Công thức cấu tạo của rượu etylic là
A. CH2-CH3-OH
B. CH3-O-CH3
C. CH2-CH2-(OH)2
D. CH3-CH2-OH
Câu 17: Khối lượng C2H5OH cần lấy để tác dụng với 20 gam kim loại Na là
A. 20 gam
B. 30 gam
C. 40 gam
D. 60 gam
Câu 18: Thủy phân hoàn toàn 51,48 g một loại chất béo cần vừa đủ 7,2 g NaOH, sản phẩm thu được gồm 5,52 g glixerol và hỗn hợp muối của các axit béo. Khối lượng hỗn hợp các muối là
A. 52,26 gam
B. 53,16 gam
C. 54,06 gam
D. 55,18 gam
Câu 19: Hòa tan hoàn toàn 4,8 gam Mg vào dung dịch CH3COOH, sau phản ứng thấy thoát ra V lít khí H2 ở đktc. Giá trị của V là
A. 4,48 lít
B. 5,60 lít
C. 3,36 lít
D. 9,80 lít
Câu 20: Axit axetic là
A. Axit yếu
B. Bazơ yếu
C. Bazơ mạnh
D. Axit mạnh
Câu 21: Rượu etylic và axit axetic đều tác dụng được với
A. Na
B. NaCl
C. NaOH
D. Na2CO3
Câu 22: Thủy phân chất béo trong môi trường kiềm thu được
A. Glixerol và muối của một axit béo
B. Glixerol và axit béo
C. Glixerol và axit hữu cơ
D. Glixerol và muối của các axit béo
Câu 23: Trong máu người luôn chứa một lượng glucozơ không đổi có nồng độ
A. 0,2%
B. 0,15%
C. 0,1%
D. 0,05%
Câu 24: Cho 36 gam glucozơ phản ứng với một lượng vừa đủ AgNO3 trong NH3 đun nóng, sau phản ứng thu được m gam khối lượng Ag. Giá trị của m là
A. 43,2 gam
B. 44,6 gam
C. 45,1 gam
D. 42,3 gam
Câu 25: Saccarozơ có công thức phân tử là
A. C12H21O12
B. C12H22O12
C. C6H12O6
D. C12H22O11
Câu 26: Tính chất vật lý của xenlulozơ là
A. Chất rắn màu trắng, tan trong nước
B. Chất lỏng, không tan trong nước ngay cả khi đun nóng
C. Chất rắn màu trắng, không tan trong nước ngay cả khi đun nóng
D. Chất rắn màu xanh, không tan trong nước ngay cả khi đun nóng
Câu 27: Tính chất hóa học của protein là
A. Phản ứng thủy phân
B. Sự phân hủy bởi nhiệt
C. Sự đông tụ
D. Cả A, B, C đều đúng
Câu 28: Chất nào sau đây là polime tổng hợp?
A. Xenlulozơ
B. Tơ tằm
C. Cao su thiên nhiên
D. Polietilen
Câu 29: PVC có công thức là
A. (-CH2-CHCl-)n
B. (-CH2-CH2-)n
C. (-CH2-CH2-CH2-)n
D. (-CH2- CH2-CH2-CH2-)n
Câu 30: Trùng hợp 1,2 tấn etilen với hiệu suất 80% thì khối lượng polietilen thu được là
A. 0,56 tấn
B. 0,75 tấn
C. 0,96 tấn
D. 1,06 tấn
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 2
|
1C |
2D |
3D |
4D |
5D |
6A |
7C |
8D |
9C |
10C |
|
11D |
12C |
13D |
14B |
15D |
16D |
17C |
18B |
19A |
20A |
|
21A |
22D |
23C |
24A |
25D |
26C |
27D |
28D |
29A |
30C |
Đáp án C
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại,...
Câu 2:
Đáp án D
= 60%
Câu 3:
Đáp án D
Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết cộng hóa trị.
Câu 4:
Đáp án D
Gọi công thức phân tử của hợp chất X là: CxHy
Ta có
Suy ra công thức đơn giản của hợp chất X là: CH2
Công thức phân tử của hợp chất X có dạng (CH2)n
MX = 56 = n.(12 + 2), suy ra n = 4
Vậy công thức phân tử của hợp chất X là C4H8
Câu 5:
Đáp án D
= 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,3 mol
Vậy thể tích CO2 thu được là: V = 0,3.22,4 = 6,72 lít.
Câu 6:
Đáp án A
Tính chất vật lý của metan là chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Câu 7:
Đáp án C
Phản ứng đặc trưng của etilen là phản ứng cộng
Phương trình phản ứng: CH2 = CH2 + Br2 → Br – CH2 – CH2 – Br
Câu 8:
Đáp án D
= 0,02 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có = 0,04 mol
Vậy thể tích dung dịch brom cần dùng là: V = = 0,02 lít.
Câu 9:
Đáp án C
Phản ứng đặc trưng của benzen là: phản ứng thế với brom (có mặt bột sắt)
Câu 10:
Đáp án C
Số phát biểu đúng là: (1), (2), (3)
Phát biểu (4) sai vì benzen có ứng dụng là:
+ Benzen là nguyên liệu quan trọng để sản xuất chất dẻo, phẩm nhuộm, dược phẩm, thuốc trừ sâu…
+ Benzen được sử dụng làm dung môi trong công nghiệp và trong phòng thí nghiệm hữu cơ.
Câu 11:
Đáp án D
Để dập tắt xăng, dầu cháy người ta
+ Dùng chăn ướt chùm lên ngọn lửa
+ Phủ cát vào ngon lửa
Vì ngăn không cho xăng, dầu tiếp xúc với không khí.
Câu 12:
Đáp án C
Thể tích khí thiên nhiên là V (lít)
= 0,96V
= 0,02V
Phương trình phản ứng:
CH4 + 2O2 CO2 + 2H2O
Theo phương trình phản ứng ta có:
⇒ = 0,96V
Suy ra thể tích CO2 thu được sau khi đốt: 0,96V + 0,02V = 0,98V
Phương trình phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O
Theo phương trình phản ứng ta có = 0,196 mol
⇒ = 0,196 mol
Vậy V = 4,48 lít
Câu 13:
Đáp án D
Rượu etylic được điều chế từ: Tinh bột, Glucozơ, Etilen.
Câu 14:
Đáp án B
Đặc điểm nổi bật của dầu mỏ nước ta là chứa ít lưu huỳnh, nhiều parafin.
Câu 15:
Đáp án D
Để sử dụng hiệu quả nhiên liệu, tránh gây lãng phí và làm ô nhiễm môi trường cần đảm bảo
+ Cung cấp đủ không khí hoặc oxi cho quá trình cháy như: thổi thêm khí vào lò, xây ống khói cao để hút gió …
+ Tăng diện tích tiếp xúc của nhiên liệu rắn với với không khí hoặc oxi như chẻ nhỏ củi, đập nhỏ than khi đốt cháy…
+ Điều chỉnh lượng nhiên liệu để duy trì sự cháy cần thiết phù hợp với nhu cầu sử dụng
Câu 16:
Đáp án D
Công thức cấu tạo của rượu etylic là CH3-CH2-OH
Câu 17:
Đáp án C
(mol)
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = (mol)
Khối lượng C2H5OH cần dùng là: = 40 gam.
Câu 18:
Đáp án B
Phương trình hóa học
(RCOO)3C3H5 + 3NaOH 3RCOONa + C3H5(OH)3
Áp dụng định luật bảo toàn khối lượng ta có mchất béo + mNaOH = mmuối + mglixerol
Suy ra mmuối = 51,48 + 7,2 - 5,52 = 53,16 gam.
Câu 19:
Đáp án A
Số mol của Mg là: nMg = = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,2 mol
Thể tích khí H2 là: V = 0,2.22,4 = 4,48 lít
Câu 20:
Đáp án A
Axit axetic là axit yếu.
Câu 21:
Đáp án A
Phương trình phản ứng:
2C2H5OH + 2Na → 2C2H5ONa + H2
2CH3COOH + 2Na → 2CH3COONa + H2
Câu 22
Đáp án D
Thủy phân chất béo trong môi trường kiềm thu được: glixerol và muối của các axit béo
Câu 23:
Đáp án C
Trong máu người luôn chứa một lượng glucozơ không đổi có nồng độ là 0,1%
Câu 24:
Đáp án A
Số mol glucozơ là = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có nAg = 0,4 mol
Khối lượng Ag thu được là: m = 0,4.108 = 43,2 gam.
Câu 25:
Đáp án D
Saccarozơ có công thức phân tử là C12H22O11
Câu 26:
Đáp án C
Tính chất vật lý của xenlulozơ là chất rắn màu trắng, không tan trong nước ngay cả khi đun nóng.
Câu 27:
Đáp án D
Tính chất hóa học của protein là
+ Phản ứng thủy phân
+ Sự phân hủy bởi nhiệt
+ Sự đông tụ
Câu 28:
Đáp án D
Polime tổng hợp là: Polietilen.
Câu 29
Đáp án A
PVC có công thức là (-CH2-CHCl-)n
Câu 30:
Đáp án C
Phương trình phản ứng: nCH2=CH2 (-CH2-CH2-)n
Áp dụng định luật bảo toàn khối lượng ta có metilen = mpolietilen = 1,2 tấn
Do hiệu suất là 80%
Vậy khối lượng polietilen thu được là: mpolietilen = 1,2.80% = 0,96 tấn.
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Dãy đồng đẳng của benzen có công thức chung là
A. CnH2n+2
B. CnH2n-2
C. CnH2n-4
D. CnH2n-6
Câu 2: Benzen và etilen có những điểm khác nhau về
A. Cấu tạo phân tử, tính chất vật lý và hóa học
B. Etilen khó tham gia phản ứng cộng hơn benzen
C. Etilen không làm mất màu dung dịch brom còn benzen thì có
D. Cả A, B, C đều đúng
Câu 3: Dẫn 1,1 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 248 gam
B. 352 gam
C. 330 gam
D. 276 gam
Câu 4: Chất khi tác dụng với nước sinh ra khí axetilen là
A. Na2S
B. CaO
C. K2S
D. CaC2
Câu 5: Có thể phân biệt được hai khí SO2 và C2H4 mà chỉ dùng dung dịch
A. K2CO3
B. NaOH
C. NaCl
D. Ca(OH)2
Câu 6: Rượu etylic và axit axetic đều tác dụng được với
A. Na
B. NaCl
C. NaOH
D. Na2CO3
Câu 7: Phương pháp lên men dung dịch rượu etylic loãng dùng để điều chế
A. Etylen
B. Axit axetic
C. Natri axetat
D. Ety axetat
Câu 8: Cho 2,3 gam rượu etylic nguyên chất tác dụng với natri dư. Thể tích khí H2 thoát ra ở đktc là
A. 0,56 lít
B. 0,86 lít
C. 0,64 lít
D. 0,224 lít
Câu 9: Cho 46 gam rượu etylic vào dung dịch axit axetic dư. Tính khối lượng sản phẩm etyl axetat thu được biết rằng hiệu suất phản ứng là 60%.
A. 46 gam
B. 50 gam
C. 52,8 gam
D. 60 gam
Câu 10: Xà phòng hóa chất nào sau đây thu được glixerol?
A. Tristearin
B. Metyl axetat
C. Metyl fomat
D. Benzyl axetat
Câu 11: Trên thế giới, mía là loại cây được trồng với diện tích rất lớn, là nguồn cung cấp nguyên liệu cho sản xuất đường. Chất tạo nên vị ngọt trong đường mía là
A. Xenlulozơ.
B. Glucozơ.
C. Saccarozơ.
D. Tinh bột.
Câu 12: Dầu ăn là
A. Este
B. Este của glixerol
C. Một este của glixerol và axit béo
D. Hỗn hợp nhiều este của glixerol và các axit béo
Câu 13: Chỉ dùng quỳ tím có thể phân biệt được cặp chất nào sau đây?
A. Rượu etylic và axit axetic
B. Rượu etylic và dầu ăn
C. Etilen và dầu ăn
D. Rượu etylic và etilen
Câu 14: Chất tỏa ra năng lượng nhiều nhất, khi oxi hóa thức ăn là
A. Chất đạm
B. Chất bột
C. Chất béo
D. Chất xơ
Câu 15: Trùng hợp m tấn etilen thu được 1,5 tấn polietilen với hiệu suất phản ứng là 80%. Giá trị của m là
A. 1,730 tấn
B. 1,875 tấn
C. 1,920 tấn
D. 2,024 tấn
Câu 16: PVC có công thức là
A. (-CH2-CHCl-)n
B. (-CH2-CH2-)n
C. (-CH2-CH2-CH2-)n
D. (-CH2- CH2-CH2-CH2-)n
Câu 17: Cho các phát biểu sau:
(1) Tơ là những polime thiên nhiên hay tổng hợp có cấu tạo mạch thẳng và có thể kéo dài thành sợi.
(2) Cao su là polime thiên nhiên hay tổng hợp có tính đàn hồi.
(3) Phân tử polime được cấu tạo bởi nhiều mắt xích liên kết với nhau.
(4) Polime được ứng dụng trong đời sống và trong kĩ thuật dưới các dạng khác nhau, phổ biến là chất dẻo, tơ, cao su.
(5) Polime là sản phẩm suy nhất của phản ứng trùng hợp hoặc trùng ngưng.
Số phát biểu đúng là
A. 5
B. 4
C. 3
D. 2
Câu 18: Tính chất vật lý của xenlulozơ là
A. Chất rắn màu trắng, tan trong nước
B. Chất lỏng, không tan trong nước ngay cả khi đun nóng
C. Chất rắn màu trắng, không tan trong nước ngay cả khi đun nóng
D. Chất rắn màu xanh, không tan trong nước ngay cả khi đun nóng
Câu 19: Các chất có thể tham gia phản ứng thủy phân là
A. Glucozơ, saccarozơ
B. Chất béo, axit axetic
C. Saccarozơ, rượu etylic
D. Saccarozơ, chất béo
Câu 20: Thủy phân saccarozơ trong môi trường axit thu được
A. Glucozơ và fructozơ
B. Fructozơ và mantozơ
C. Glucozơvà glicozen
D. Glucozơ và mantozơ
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Bằng phương pháp hóa học hãy nhận biết ba lọ hóa chất mất nhãn chứa nước cất, axit axetic và rượu etylic.
Câu 2: Hãy viết các viết phương trình hoá học và ghi rõ điều kiện (nếu có)
Cacbua canxi → Axetilen → Etilen → Đibrometan
Câu 3: Đốt cháy hoàn toàn 4,6g rượu etylic nguyên chất ở nhiệt độ cao.
a) Viết phương trình phản ứng xảy ra.
b) Tính thể tích khí CO2 thu được (ở đktc) và khối lượng H2O tạo thành.
c) Dẫn sản phẩm thu được đi qua dung dịch nước vôi trong dư. Tính khối lượng kết tủa thu được sau phản ứng.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 3
PHẦN I: TRẮC NGHIỆM
|
1D |
2A |
3B |
4D |
5D |
6A |
7B |
8A |
9C |
10A |
|
11C |
12D |
13A |
14C |
15B |
16A |
17B |
18C |
19D |
20A |
Đáp án D
Dãy đồng đẳng của benzen có công thức chung là CnH2n-6 ()
Câu 2:
Đáp án A
Benzen và etilen có những điểm khác nhau về: cấu tạo phân tử, tính chất vật lý và hóa học.
Câu 3:
Đáp án B
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 2,2 mol
Vậy khối lượng brom tham gia phản ứng là: = 2,2.160 = 352 gam.
Câu 4:
Đáp án D
Chất khi tác dụng với nước sinh ra khí axetilen là: CaC2
Phương trình phản ứng: CaC2 + 2H2O → Ca(OH)2 + C2H2
Câu 5:
Đáp án D
Có thể phân biệt được hai khí SO2 và C2H4 mà chỉ dùng dung dịch Ca(OH)2
+ Khí C2H4 không tác dụng với dung dịch Ca(OH)2
+ Khí SO2 tạo kết tủa với dung dịch Ca(OH)2
Phương trình phản ứng:
Câu 6:
Đáp án A
Phương trình phản ứng:
2C2H5OH + 2Na → 2C2H5ONa + H2
2CH3COOH + 2Na → 2CH3COONa + H2
Câu 7:
Đáp án B
Phương pháp lên men dung dịch rượu etylic loãng dùng để điều chế axit axetic.
Câu 8:
Đáp án A
Số mol của C2H5OH là: = 0,05 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,025 mol
Thể tích khí H2 thoát ra ở đktc là = 0,025.22,4 = 0,56 lít
Câu 9:
Đáp án C
Số mol của C2H5OH là = 1 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 1 mol
Mà H = 60%
Khối lượng etyl axetat thu được là: = 1.88.60% = 52,8 gam
Câu 10:
Đáp án A
Xà phòng hóa tristearin ((C17H35COO)3C3H5) để thu được glixerol
Phương trình phản ứng:
(C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3 (glixerol)
Câu 11:
Đáp án C
Saccarozơ có nhiều nhất trong cây mía nên saccarozơ còn được gọi là đường mía
Câu 12:
Đáp án D
Dầu ăn là hỗn hợp nhiều este của glixerol và các axit béo.
Câu 13:
Đáp án A
Chỉ dùng quỳ tím có thể phân biệt được cặp chất là: Rượu etylic và axit axetic
Trích mẫu thử và đánh số thứ tự
- Lần lượt nhúng quỳ tím vào 2 mẫu thử trên
+ Mẫu làm quỳ tím hóa đỏ là axit axetic
+ Mẫu còn lại không có hiện tượng gì là rượu etylic
Câu 14:
Đáp án C
Chất béo tỏa năng lượng nhiều nhất khi oxi hóa thức ăn.
Câu 15:
Đáp án B
Phương trình phản ứng: nCH2=CH2 (-CH2-CH2-)n
Áp dụng định luật bảo toàn khối lượng ta có metilen = mpolietilen = 1,5 tấn
Do hiệu suất là 80% nên khối lượng của C2H4 ban đầu là:
= = 1,875 tấn.
Câu 16:
Đáp án A
PVC có công thức là (-CH2-CHCl-)n
Câu 17:
Đáp án B
Số phát biểu đúng là (1), (2), (3), (4)
Phát biểu (5) sai vì polime là hợp chất cao phân tử gồm n mắt xích tạo thành.
Câu 18:
Đáp án C
Tính chất vật lý của xenlulozơ là chất rắn màu trắng, không tan trong nước ngay cả khi đun nóng.
Câu 19:
Đáp án D
Các chất có thể tham gia phản ứng thủy phân là: Saccarozơ, chất béo
Câu 20:
Đáp án A
Thủy phân saccarozơ trong môi trường axit thu được: Glucozơ và fructozơ
Phương trình phản ứng:
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Mỗi mũi tên lần lượt tương ứng với một phương trình hóa học.
(1) CaC2 + 2H2O → C2H2 + Ca(OH)2
(2) C2H2 + H2 C2H4
(3) CH2=CH2 + Br2 → CH2Br-CH2Br
Câu 2:
a) C2H5OH + 3O2 2CO2 + 3H2O
b) = = 0,1 mol
Theo phương trình:
= 2.0,1 = 0,2 mol
⇒ = 4,48 lít
= 3.0,1 = 0,3 mol
⇒ = 0,3.18 = 5,4 gam
c) Dẫn sản phẩm qua nước vôi trong dư
⇒ = 0,2 mol
⇒ = 0,2.100 = 20 gam
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 4
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Khi dẫn khí etilen vào dung dịch brom đựng trong ống nghiệm có quan sát thấy
A. Màu của dung dịch brom không thay đổi
B. Màu của dung dịch brom nhạt dần, có khí thoát ra
C. Màu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm
D. Màu của dung dịch brom nhạt dần, có chất kết tủa
Câu 2: Phương pháp hiện đại để điều chế axetilen hiện nay là
A. Nhiệt phân metan ở nhiệt độ cao
B. Nhiệt phân canxi cacbua ở nhiệt độ cao
C. Nhiệt phân benzen ở nhiệt độ cao
D. Nhiệt phân etilen ở nhiệt độ cao
Câu 3: Trong phân tử benzen có
A. 9 liên kết đơn, 6 liên kết đôi
B. 9 liên kết đơn, 3 liên kết đôi
C. 12 liên kết đơn, 3 liên kết đôi
D. 6 liên kết đơn, 3 liên kết đôi
Câu 4: Phản ứng đặc trưng của benzen là
A. Phản ứng cháy
B. Phản ứng trùng hợp
C. Phản ứng thế với brom (có mặt bột sắt)
D. Phản ứng hóa hợp với brom (có mặt bột sắt)
Câu 5: Ứng dụng chính của khí thiên nhiên là
A. Làm nhiên liệu
B. Làm nguyên liệu hóa học
C. Làm vật liệu xây dựng
D. Làm phụ gia thực phẩm
Câu 6: Đốt cháy hoàn toàn 3,36 gam một hiđrocacbon X có M = 84 đvC cho ta 10,56 gam CO2. Số nguyên tử C trong phân tử X là
A. 5
B. 6
C. 7
D. 8
Câu 7: Nhiên liệu rắn gồm
A. Than mỏ, gỗ
B. Xăng, dầu hỏa
C. Khí mỏ dầu, khí than
D. Cồn, khí thiên nhiên
Câu 8: Phân biệt metan và etilen dùng dung dịch nào sau đây?
A. KOH
B. NaCl
C. NaCl
D. Br2
Câu 9: Trong phân tử rượu etylic, nhóm nào gây nên tính chất đặc trưng của nó?
A. Nhóm –CH3
B. Nhóm CH3-CH2-
C. Nhóm –OH
D. Cả phân tử
Câu 10: Cho 18,4 gam rượu etylic nguyên chất tác dụng với kali dư. Thể tích khí H2 thoát ra ở đktc là
A. 2,24 lít
B. 4,48 lít
C. 3,36 lít
D. 5,60 lít
Câu 11: Chất nào sau đây làm đổi màu quỳ tím?
A. CH3OH
B. CH2=CH2
C. CH3CH2OH
D. CH3COOH
Câu 12: Để phân biệt hai dung dịch C2H5OH và CH3COOH người ta dùng
A. CaO khan
B. Dung dịch NaOH
C. Na
D. Qùy tím
Câu 13: Chất nào sau đây không phải chất béo?
A. (CH3COO)3C3H5
B. (C17H33COO)3C3H5
C. (C17H35COO)3C3H5
D. (C15H31COO)3C3H5
Câu 14: Đun nóng 8,9 gam chất béo (C17H35COO)3C3H5 với dung dịch NaOH, sau phản ứng thu được m gam glixerol. Giá trị của m là
A. 0,46 gam
B. 0,84 gam
C. 0,92 gam
D. 1,02 gam
Câu 15: Glucozơ có nhiều nhất trong
A. Củ cải
B. Mật ong
C. Quả nho chín
D. Thân cây mía
Câu 16: Tính chất vật lý của saccarozơ là
A. Chất rắn kết tinh không màu, vị ngọt, dễ tan trong nước, đặc biệt tan nhiều trong nước nóng
B. Chất rắn không màu, vị ngọt, không tan trong nước
C. Chất rắn kết tinh không màu, không vị, không tan trong nước
D. Chất lỏng, không màu, không vị, dễ tan trong nước, đặc biệt tan nhiều trong nước nóng
Câu 17: Nhỏ vài giọt dung dịch iot vào ống nghiệm đựng hồ tinh bột thấy xuất hiện màu
A. Xanh
B. Tím
C. Vàng
D. Đỏ
Câu 18: Trứng là loại thực phẩm chứa nhiều
A. Chất béo
B. Chất đường
C. Chất bột
D. Protein
Câu 19: Mắt xích trong phân tử protein là
A. Etilen
B. Amino axit
C. Glucozơ
D. Xenlulozơ
Câu 20: Dẫn 0,55 mol khí axetilen qua bình đựng dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 124 gam
B. 176 gam
C. 165 gam
D. 138 gam
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Viết các phương trình hóa học hoàn thành sơ đồ sau:
glucozơ ® rượu etylic® axit axetic ®etyl axetat ® canxi axetat
Câu 2: Cho 10,6g hỗn hợp gồm rượu etylic và axit axetic tác dụng vừa đủ với 200 ml dung dịch NaOH 0,5M. Tính phần trăm khối lượng mỗi chất trong hỗn hợp đầu.
Câu 3: Cho 56,25g glucozơ C6H12O6 lên men thành rượu etylic. Lượng CO2 thoát ra được hấp thụ hết bằng dung dịch Ca(OH)2 thấy tạo ra 50g kết tủa.
a) Tính lượng rượu thu được.
b) Tính hiệu suất lên men rượu.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 4
PHẦN I: TRẮC NGHIỆM
|
1C |
2A |
3B |
4C |
5A |
6B |
7A |
8D |
9C |
10B |
|
11D |
12D |
13A |
14C |
15C |
16A |
17A |
18D |
19B |
20B |
Đáp án C
Khi dẫn khí etilen vào dung dịch brom đựng trong ống nghiệm có quan sát thấy màu của dung dịch brom nhạt dần, có chất lỏng không tan chìm xuống đáy ống nghiệm.
Phương trình phản ứng:
Câu 2:
Đáp án A
Phương pháp hiện đại để điều chế axetilen hiện nay là nhiệt phân metan ở nhiệt độ cao
Phương trình phản ứng:
Câu 3:
Đáp án B
Trong phân tử benzen có 9 liên kết đơn, 3 liên kết đôi.
Câu 4:
Đáp án C
Phản ứng đặc trưng của benzen là: phản ứng thế với brom (có mặt bột sắt)
Câu 5:
Đáp án A
Ứng dụng chính của khí thiên nhiên là làm nhiên liệu.
Câu 6:
Đáp án B
Ta có = 0,04 mol
= 0,24 mol = nC
Gọi a là số nguyên tử C trong phân tử X ta có: a = = 6 nguyên tử C
Câu 7:
Đáp án A
Nhiên liệu rắn gồm than mỏ, gỗ
Câu 8:
Đáp án D
Khí etilen làm mất màu dung dịch brom (ngay ở điều kiện thường), còn khí metan thì không.
Phương trình phản ứng: C2H4 + Br2 → C2H4Br2
Câu 9:
Đáp án C
Trong phân tử rượu etylic, nhóm gây nên tính chất đặc trưng của nó là: nhóm –OH
Câu 10:
Đáp án B
Số mol của C2H5OH là: = 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 0,2 mol
Thể tích khí H2 thoát ra ở đktc là: = 0,2.22,4 = 4,48 lít.
Câu 11:
Đáp án D
Chất làm đổi màu quỳ tím là: CH3COOH vì CH3COOH có tính axit làm quỳ tím hóa đỏ.
Câu 12:
Đáp án D
Dùng quỳ tím để phân biệt hai dung dịch C2H5OH và CH3COOH
+ Axit axetic làm quỳ tím hóa đỏ
+ Rượu etylic không làm quỳ tím đổi màu
Câu 13:
Đáp án A
Chất không phải chất béo là(CH3COO)3C3H5
Câu 14:
Đáp án C
Số mol của (C17H35COO)3C3H5 là: = 0,01 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có = 0,01 mol
⇒ = 0,01.92 = 0,92 gam.
Câu 15:
Đáp án C
Glucozơ có nhiều nhất trong quả nho chín.
Câu 16:
Đáp án A
Tính chất vật lý của saccarozơ là: chất rắn kết tinh không màu, vị ngọt, dễ tan trong nước, đặc biệt tan nhiều trong nước nóng.
Câu 17:
Đáp án A
Nhỏ vài giọt dung dịch iot vào ống nghiệm đựng hồ tinh bột thấy xuất hiện màu xanh.
Câu 18:
Đáp án D
Trứng là loại thực phẩm chứa nhiều protein
Câu 19:
Đáp án B
Mắt xích trong phân tử protein là amino axit
Câu 20:
Đáp án B
Phương trình phản ứng:
Theo phương trình phản ứng ta có: = 1,1 mol
⇒ = 1,1.160 = 176 gam.
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Mỗi mũi tên lần lượt tương ứng với một phương trình hóa học.
(1) C6H12O6 2C2H5OH + 2CO2
(2) C2H5OH + O2 CH3COOH + H2O
(3) CH3COOH + C2H5OH CH3COOC2H5 + H2O
(4) CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Câu 2:
a) C6H12O6 2C2H5OH + 2CO2
= 0,625 mol
=
Theo phương trình: phản ứng = = 0,5 mol
⇒ H% = = 80%
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 5
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Hợp chất nào sau đây không phải là hợp chất hữu cơ:
A. CaO.
B. CH4.
C. C2H4.
D. C2H4O2.
Câu 2: Số ml rượu etylic nguyên chất có trong 600 ml rượu etylic 30o là:
A. 180.
B. 30.
C. 600.
D. 420.
Câu 3: Chất hữu cơ nào sau đây tác dụng được với NaHCO3 giải phóng khí CO2?
A. CH4
B. CH3COOH.
C. CH2 = CH2.
D. C2H5OH.
Câu 4: Công thức cấu tạo của rựu etylic và axit axetic đều có nhóm:
A. CH3-.
B. -OH.
C. -CH2- .
D. Cả A, B.
Câu 5: Cho V lít khí C2H4 (đktc) tác dụng vừa đủ với 200 ml dung dịch Br2 0,5M. Giá trị của V là:
A. 0,1.
B. 2,42.
C. 2,24.
D. 4,48.
Câu 6: Để phân biệt hợp chất vô cơ và hợp chất hữu cơ người ta thường dùng:
A. phản ứng tác dụng với Na.
B. phản ứng tác dụng với NaHCO3.
C. phản ứng tác dụng với NaOH.
D. phản ứng đốt cháy.
Câu 7: Công thức cấu tạo nào sau đây là của rượu etylic:
A. CH2 = CH2.
B. CH4.
C. C2H5OH.
D. CH3COOH.
Câu 8: Đốt cháy 1 mol hợp chất hữu cơ A, thu được 2 mol CO2. Vậy A không thể là chất nào sau đây:
A. CH4.
B. C2H2.
C. C2H6O.
D. C2H4.
Câu 9: Thành phần chính trong khí thiên nhiên là:
A. Khí metan
B. Khí hiđro
C. Khí cacbonic
D. Khí etilen
Câu 10: Cho các sơ đồ phản ứng sau:
X + H2O Y + Z
Y + O2 T +H2O
T + Ba(OH)2 → BaCO3 +H2O
X, Y, Z, T lần lượt là:
A. Al4C3, CO2, Ca(OH)2, CH4.
B. Al4C3, CH4, Al(OH)3, CO2
C. Al4C3, CH4, Ca(OH)2, CO2
D. Al4C3, C2H4, Ca(OH)2, CO2.
Câu 11: Khối lượng metan cần dùng để điều chế 50,5 gam metyl clorua là:
A. 8 gam
B. 8,5 gam
C. 16 gam
D. 16,5 gam
Câu 12: Cho 7,4 gam axit C2H5COOH tác dụng với 4,8 gam rượu CH3OH. Khối lượng este thu được (với hiệu suất phản ứng 65%) là:
A. 8,8 gam
B. 5,72 gam
C. 13,54 gam
D. 8,58 gam
Câu 13: Cho các chất sau: CH3OH, C2H5COOH, CH3COOC2H5, (C17H35COO)3C3H5. Số chất tác dụng được với NaOH là:
A. 1
B. 2
C. 3
D. 4
Câu 14: Dãy gồm các chất đều phản ứng được với dung dịch axit axetic là:
A. Cu, KOH, Al2O3, C2H5OH
B. Fe, CaO, Na2CO3, Al(OH)3
C. Mg, Na2SO4, Cu(OH)2, CH3OH.
D. CuO, HCl, NaOH, C2H5OH
Câu 15: Benzen không thực hiện phản ứng cộng với:
A. Dung dịch brom
B. Khí hiđro
C. Khí clo
D. Cả B và C
Câu 16: Cho 4,6 gam rượu etylic tác dụng hoàn toàn với natri, thể tích khí hiđro thu được ở đktc là:
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Câu 17: Cho nhôm tác dụng vừa đủ với 200ml dung dịch axit axetic nồng độ 1,5M. Thể tích khí hiđro thu được ở đktc là:
A. 1,12 lít
B. 3,36 lít
C. 4,48 lít
D. 6,72 lít
Câu 18: Dãy chất đều tan trong nước ở nhiệt độ thường là
A. saccarozơ và tinh bột.
B. glucozơ và xenlulozơ.
C. glucozơ và saccarozơ.
D. saccarozơ và xenlulozơ.
Câu 19: Dãy các chất đều có phản ứng thủy phân là
A. tinh bột, xenlulozơ, PVC, glucozơ.
B. tinh bột, xenlulozơ, saccarozơ, chất béo.
C. tinh bột, xenlulozơ, saccarozơ, glucozơ.
D. tinh bột, xenlulozơ, saccarozơ, PE.
Câu 20: Chọn phát biểu đúng là
A. polime là chất dễ bay hơi.
B. polime là những chất dễ tan trong nước.
C. polime chỉ được tạo ra bởi con người và không có trong tự nhiên.
D. polime là những chất rắn, không bay hơi, thường không tan trong nước.
II. TỰ LUẬN (3 điểm)
Câu 1 (1 điểm): Bằng phương pháp hóa học, hãy phân biệt 3 chất khí không màu đựng trong 3 lọ mất nhãn riêng biệt gồm: metan, etilen, hiđro. Viết phương trình hóa học xảy ra (nếu có).
Câu 2 (1 điểm): Viết phương trình hóa học hoàn thành sơ đồ sau:
a) C6H12O6 C2H5OHC2H4PE
b) C2H5OH CH3COOH CH3COOC2H5CH3COONa
Câu 3 (1 điểm): Đốt cháy hoàn toàn 4,6 gam rượu etylic
a) Tính thể tích không khí cần dùng (ở đktc) cho phản ứng trên, biết khí oxi chiếm 20% thể tích không khí.
b) Tính thể tích rượu 8o thu được khi pha lượng rượu trên với nước, biết khối lượng riêng của rượu etylic là 0,8 (g/ml).
c) Tính khối lượng axit axetic thu được khi lên men lượng rượu trên, biết hiệu suất của phản ứng lên men giấm đạt 60 %.
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 6
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, F = 19, Si = 28, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Dãy nào gồm các chất là hiđrocacbon?
A. C2H4; CH4; C2H5Cl.
C. C2H4; CH4; C3H7Cl;
B. C3H6; C4H10; C2H4.
D. C3H6; C2H5Cl; C3H7Cl.
Câu 2: Công thức cấu tạo nào sau đây sai?
A. CH2 = CH – CH3
B. CH3 – O – H
C. CH3 - CH3
D. Cl = CH2
Câu 3: Thể tích khí C2H4 (đkc) cần dùng để tác dụng với 300 ml dung dịch Br2 0,5M là:
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 1,12 lít
Câu 4: Trong khí tự nhiên, khí dầu mỏ, khí biogas có thành phần chính là khí:
A. CH4.
B. CO2.
C. C2H4.
D. C2H2
Câu 5: Tính chất vật lí của metan là:
A. Chất khí, không màu, không mùi, ít tan trong nước.
B. Chất khí, màu trắng, không mùi, ít tan trong nước.
C. Chất khí, không màu, không mùi, tan vô hạn trong nước.
D. Chất khí, không màu, mùi hắc, ít tan trong nước.
Câu 6: Axetilen có công thức phân tử là:
A. CH4.
B. C2H4.
C. C2H2.
D. C3H6.
Câu 7: Dung dịch iot dùng để nhận biết các dung dịch nào sau đây?
A. Rượu etylic
B. Glucozơ
C. Saccarozơ
D. Hồ tinh bột
Câu 8: Nhận xét nào sau đây đúng?
A. Polime là những chất dễ bay hơi.
B. Polime dễ tan trong nước
C. Polime chỉ được tạo ra từ con người không có trong tự nhiên
D. Polime là những chất rắn, không bay hơi, thường không tan trong nước
Câu 9: AgNO3 dùng để nhận biết dung dịch.
A. C6H12O6
B. C2H5OH.
C. (-C6H10O5-)n
D. CH3COOH
Câu 10: Chất béo tác dụng với kiềm thu được glixerol và
A. một muối của axit béo
B. hai muối của axit béo
C. ba muối của axit béo
D. một hỗn hợp muối của các axit béo
Câu 11: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H2, C2H5ONa
B. H2, NaOH
C. NaOH, H2O
D. CH3CH2ONa, NaOH
Câu 12. Phản ứng của etilen với dung dịch brom tạo thành đibrometan là?
A. Phản ứng thế
B. Phản ứng cộng
C. Phản ứng trùng hợp
D. Phản ứng phân hủy
Câu 13: Dãy chất gồm các công thức của rượu:
A. C3H7OH, C2H5OH, NaOH
B. C3H7OH, HCHO, CnH2n+1OH.
C. C3H7OH, C2H5OH, CnH2n+1OH.
D. CH3OCH3, C2H5OH, CnH2n+1OH.
Câu 14: Thành phần chính trong khí thiên nhiên là:
A. Khí metan
B. Khí hiđro
C. Khí cacbonic
D. Khí etilen
Câu 15: Khối lượng metan cần dùng để điều chế 50,5 gam metyl clorua là:
A. 8 gam
B. 8,5 gam
C. 16 gam
D. 16,5 gam
Câu 16: Cho các chất sau: CH3OH, C2H5COOH, CH3COOC2H5, (C17H35COO)3C3H5. Số chất tác dụng được với NaOH là:
A. 1
B. 2
C. 3
D. 4
Câu 17: Số ml rượu etylic nguyên chất có trong 250 ml rượu 40o là:
A. 75 ml
B. 80 ml
C. 100 ml
D. 125 ml
Câu 18: Dãy gồm các chất đều phản ứng được với dung dịch axit axetic là:
A. HCl, KOH, Al2O3, C2H5OH
B. Fe, CaO, Na2CO3, Al(OH)3
C. HCl, Na2SO4, Cu(OH)2, CH3OH.
D. CuO, HCl, NaOH, C2H5OH
Câu 19: Chất nào sau đây là sản phẩm của phản ứng xà phòng hóa:
A. (RCOO)3C3H5
B. RCOONa
C. (RCOO)3Fe
D. C2H5COOC15H31
Câu 20: Bệnh nhân khi truyền dung dịch đường vào tĩnh mạch, đó là loại đường nào?
A. Sacarozơ.
B. Frutozơ.
C. Glucozơ
D. Mantozơ.
II. PHẦN TỰ LUẬN (3 ĐIỂM)
Câu 1 (1 điểm): Chỉ dùng H2O và 1 hóa chất hãy phân biệt các lọ dung dịch đựng riêng biệt sau: Rượu etylic, axit axetic, etyl axetat
Câu 2 (2 điểm): Đốt cháy V lít etilen, thu được 9 g hơi nước. Hãy tính thể tích etilen và thể tích không khí cần dùng. Biết rằng oxi chiếm 20% thể tích không khí, các thể tích khí đo ở điều kiện tiêu chuẩn.
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 7
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần tự luận
Câu 1: (2 điểm) Nhỏ 10ml dung dịch AgNO3 1M trong NH3 vào ống nghiệm đựng dung dịch glucozo dư, sau khi kết thúc phản ứng, người ta thu được một lượng Ag cân nặng 0,864g. Tính hiệu suất phản ứng (Ag=108)
Câu 2: (2 điểm) Viết phương trình hóa học của H2N – CH2 – COOH lần lượt với NaOH, C2H5OH.
Câu 3: (2 điểm) Hai phân tử X và Y có công thức cấu tạo lần lượt là:
HO – CH2 – COOH và H2N – CH2 – COOH. Viết các phương trình hóa học với Na
Câu 4: (2 điểm) Hãy điền Đ (nếu đúng) S (nếu sai) vào bảng sau:
| STT | Đ hay S | |
| 1 | Glucozo tác dụng được với AgNO3 trong NH3 | |
| 2 | Saccarozo tác dụng được với H2O trong axit | |
| 3 | Xenlulozo không tác dụng với natri | |
| 4 | Tinh bột tác dụng với iot cho màu xanh | |
| 5 | Axit axetic tác dụng được với rượu etylic trong axit | |
| 6 | Amino axit bị thủy phân trong môi trường axit hay kiềm | |
| 7 | Rượu etylic tác dụng với natri | |
| 8 | Benzen không tác dụng với nước |
Câu 5: (2 điểm) Trộn 50ml axit axetic (D = 1,03 g/cm3) với 50ml nước cất (D = 1 g/cm3). Tính nồng độ % của axit axetic trong dung dịch đó.
Đáp án và hướng dẫn giải
Câu 1:
nAgNO3 ban đầu = 0,01 mol.
nAg tạo ra = 0,864/108 = 0,008 mol
Hiệu suất phản ứng =
Câu 2:
Viết phương trình hóa học:
H2N – CH2 – COOH + NaOH → H2N – CH2 – COONa + H2O
H2N – CH2 – COOH + C2H5OH ⇋ H2N – CH2 – COOC2H5 + H2O
Câu 3:
HO – CH2 – COOH + 2Na → NaO – CH2 – COONa + H2
2H2N – CH2 – COOH + 2Na → 2H2N – CH2 – COONa + H2
Câu 4: Chỉ có 6 sai (S).
Câu 5:
Khối lượng axit axetic = 50 x 1,03 = 51,5 gam
Khối lượng nước = 50 gam
Khối lượng dung dịch axit sau khi trộn = 50 + 51,5 = 101,5 gam.
Nồng độ % của axit axetic là:
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 8
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học của khí SO2 với dung dịch KOH.
Câu 2: (2 điểm) Tính thể tích dung dịch CH3COOH 1,25M cần để trung hòa 60ml dung dịch NaOH 0,75M.
Câu 3: (2 điểm) Cho một dây nhôm vào dung dịch Cu(NO3)2. Sau một thời gian lấy dây nhôm ra khỏi dung dịch. Nhận xét hiện tượng.
Câu 4: (2 điểm) Cho 0,1 lít dung dịch glucozo 0,1M tác dụng vừa đủ với dung dịch AgNO3 trong NH3. Tính khối lượng Ag thu được (cho Ag = 108).
Câu 5: (2 điểm) Khi đốt cùng số mol các chất: rượu etylic, axit axetic và glucozo cần các thể tích khí oxi (đktc) lần lượt là V1, V2, V3.
Xác định thứ tự tăng dần của V1, V2, V3.
Đáp án và hướng dẫn giải
Câu 1:
SO2 + KOH → KHSO3
SO2 + 2KOH → K2SO3+ H2O
Câu 2:
CH3 – COOH + NaOH → CH3–COONa + H2O
nNaOH = 0,06 x 0,75 = 0,045 mol = nCH3COOH
Thể tích dung dịch CH3–COOH cần dùng = 0,045/1,25 = 0,036 (lít) hay 36ml.
Câu 3:
2Al + 3CuSO4 (dd màu xanh) → 3Cu + Al2(SO4)3
- Dây nhôm nhuốm màu đỏ.
- Màu xanh của dung dịch phai dần.
Câu 4:
C6H12O6 + Ag2O NH3→ C6H12O7 + 2 Ag
nAg = 2 x 0,1 x 0,1 = 0,02 mol => mAg = 0,02 x 108 = 2,16 gam
Câu 5:
C2H5OH + 3O2 to→ 2CO2 + 3H2O
CH3 – COOH + 2O2 to→ 2CO2 + 2H2O
C6H12O6 + 6O2 to→ 6CO2 + 6H2O
Từ các phản ứng suy ra: V2 < V1 < V3.
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 9
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần tự luận
Câu 1: (2 điểm) Viết các phương trình hóa học (điều kiện thích hợp) của cacbon lần lượt tác dụng với các chất sau: CuO, Fe2O3, O2.
Câu 2: (2 điểm) Cho các dung dịch sau: axit sunfuric loãng, axit axetic, rượu etylic.
Bằng phương pháp hóa học nhận biết từng chất.
Câu 3: (2 điểm) Một chất béo có công thức: C15H31COO-CH(CH2-OOC17H35)2 bị thủy phân trong dung dịch NaOH. Hãy viết phương trình hóa học.
Câu 4: (2,5 điểm) Sục khí CO2 vào dung dịch NaOH dư. Viết phương trình hóa học.
Sau phản ứng trong dung dịch sẽ tồn tại những chất gì?
Câu 5: (2,5 điểm) Tính nồng độ % của dung dịch rượu etylic 70° (biết DC2H5OH = 0,8 g/ml, DH2O = 1 g/ml, H=1, C=12, O=16).
Đáp án và hướng dẫn giải
Câu 1:
2CuO + C to→ 2Cu + CO2
2Fe2O3 + 3C to→ 4Fe + 3CO2
O2 + C to→ CO2
Câu 2: Có thể dùng BaCO3:
- Đánh số thứ tự từng lọ, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Cho vào mỗi ống nghiệm một ít BaCO3.
- Ống nghiệm nào BaCO3 tan dần, có khí thoát ra là ống nghiệm chứa axit axetic.
- Ống nghiệm nào vừa có khí thoát ra vừa có kết tủa trắng là ống nghiệm chứa H2SO4.
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
BaCO3 + 2CH3COOH → (CH3COO)2Ba + CO2↑ + H2O
- Ống nghiệm nào không thấy hiện tượng gì là ống nghiệm chứa rượu etylic.
Câu 3:
C15H31COO–CH(CH2–OOCC17H35)2 + 3NaOH to→ C3H5(OH)3 + C15H31COONa + 2C17H35COONa
Câu 4:
CO2 + 2NaOH → Na2CO3+ H2O.
Trong dung dịch sau phản ứng có: Na2CO3, NaOH (dư).
Câu 5:
Trong 100ml dung dịch rượu etylic 70⁰ có 70ml rượu etylic và 30ml nước.
Khối lượng rượu etylic = 70 x 0,8 = 56 gam, khối lượng nước = 30 gam.
Khối lượng dung dịch = 56 + 30 = 86 gam.
Nồng độ % dung dịch rượu etylic
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 10
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Phần tự luận
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án và hướng dẫn giải
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 11
A – TRẮC NGHIỆM(4 điểm): Khoanh tròn vào đầu chữ cái chỉ câu trả lời đúng nhất.
Câu 1: Thủy phân chất béo trong môi trường axit thu được:
A. glixerol và một loại axit béo.
B. glixerol và một số loại axit béo.
C. glixerol và một muối của axit béo.
D. glixerol và xà phòng.
Câu 2: Chọn phương pháp tốt nhất làm sạch vết dầu ăn dính trên quần áo.
A. Giặt bằng giấm.
B. Giặt bằng nước.
C. Giặt bằng xà phòng
D. Giặt bằng dung dịch axit sunfuric loãng.
Câu 3: Khí đất đèn có công thức phân tử là?
A. CH4
B. C2H4
C. C2H2
D. CaC2
Câu 4: Có ba lọ không nhãn đựng : rượu etylic, axit axetic, dầu ăn. Có thể phân biệt bằng cách nào sau đây ?
A. Dùng quỳ tím và nước.
B. Khí cacbon đioxit và nước.
C. Kim loại natri và nước.
D. Phenolphtalein và nước.
Câu 5: Dãy các hợp chất nào sau đây là hợp chất hữu cơ ?
A. CH4, C2H6, CO2.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO.
D. C2H2, C2H6O, CaCO3.
Câu 6:Dãy các chất nào sau đây đều là hiđrocacbon ?
A. C2H6, C4H10, C2H4.
B. CH4, C2H2, C3H7Cl.
C. C2H4, CH4, C2H5Cl
D. C2H6O, C3H8, C2H2.
Câu 7: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi
C. hai liên kết đôi.
D. một liên kết ba.
Câu 8: Số thứ tự chu kỳ trong bảng hệ thống tuần hoàn cho biết:
A.Số thứ tự của nguyên tố
B. Số electron lớp ngoài cùng
C. Số hiệu nguyên tử
D. Số lớp electron.
B – TỰ LUẬN ( 6 điểm)
Câu 9: Cho K, NaOH, K2O, CaCO3 lần lượt vào các dung dịch C2H5OH và CH3COOH. Có những phản ứng nào xảy ra, viết phương trình phản ứng nếu có.
Câu 10: Có 3 chất khí không màu là CH4 , C2H2 , CO2 đựng trong 3 lọ riêng biệt . Hãy nêu cách nhận biết 3 lọ khí trên bằng phương pháp hóa học.
Câu 11: Đốt cháy hết 32g khí CH4 trong không khí.
a, Tính thể tích CO2 sinh ra ở đktc
b, Tính khối lượng không khí cần dùng để đốt cháy hết lượng CH4 trên biết rằng khí O2 chiếm 20% thể tích không khí? Biết khối lượng riêng không khí là 1,3g/ml
Câu 12: Hoàn thành chuỗi chuyển đổi sau bằng các PTHH.
C →CO2 →CaCO3 →CO2 →NaHCO3
Đáp án
I. TRẮC NGHIỆM (4 điểm) Mỗi câu trả lời đúng được 0,5 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
C |
C |
A |
B |
A |
D |
D |
II. TỰ LUẬN (6 điểm)
|
Câu |
Nội dung |
Điểm |
|
Câu 9 (2,5đ) |
CH3COOH + NaOH →CH3COONa + H2O 2CH3COOH + CaCO3→ (CH3COO)2Ca + H2O + CO2 2CH3COOH + K2O →2CH3COOK + H2O 2C2H5OH + 2K →2C2H5OK + H2 2CH3COOH + 2K →2CH3COOK + H2 |
Mỗi câu xác định và viết PTHH đúng được 0,5 điểm |
|
Câu 10 (1,5 đ) |
Đốt cháy mẫu thử nhận ra được CO2, Còn lại cho lần lượt lội qua dung dịch Brom nhận ra C2H2 làm mất mầu, còn lại là CH4 |
Mỗi ý đúng 0,5 điểm |
|
Câu 11 (1 đ) |
a/ PTHH: CH4 + 2O2→ 2H2O + CO2 b/ 1mol 2mol 1mol 2mol x y - nCO2 = 2mol => VCO2 = 2.22,4 = 44,8lit - nO2 = 2nCH4 = 4mol V.O2 = 89,6lit Vậy V.không khí = 89,6.5 = 448lit m.KK = 448.000 x 1,3 = 582.400g |
(0,5 đ)
(0,5 đ)
|
|
Câu 12 (1 đ) |
Mỗi PTHH đúng được 0,5 điểm C + O2→CO2 CO2 + CaO →CaCO3 CaCO3 →CO2 + CaO CO2 + NaOH →NaHCO3 |
Mỗi câu đúng được 0,25 điểm |
|
Tổng |
|
6đ |
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 12
Phần 1: Trắc nghiệm (4 điểm)
Chọn và khoanh tròn vào chữ cái đứng trước phương án trả lời đúng
Câu 1. Etilen thuộc nhóm
A. Hidrocacbon
B. Dẫn xuất hidrocacbon
C. Chất rắn
D. Chất lỏng
Câu 2. Phát biểu nào sau đúng khi nói về metan?
A. Khí metan có nhiều trong thành phần khí quyển trái đất.
B. Trong cấu tạo phân tử metan có chứa liên kết đôi.
C. Metan cháy tạo thành khí CO2 và H2O.
D. Metan là nguồn nguyên liệu để tổng hợp nhựa PE trong công nghiệp.
Câu 3. Số công thức cấu tạo mạch hở của C4H8 là:
A. 1
B. 2
C. 3
D. 4
Câu 4. Gluxit nào sau đây có phản ứng tráng gương?
A. Tinh bột.
B. Glucozơ.
C. Xenlulozơ.
D. Saccarozo.
Câu 5. Ancol etylic tác dụng được với
A. Na
B. Al
C. Fe
D. Cu
Câu 6. Hidrocacbon A là chất có tác dụng kích thích trái cây mau chín. A là chất nào trong các chất dưới đây?
A. Etilen
B. Bezen
C. Metan
D. Axetilen
Câu 7. Glucozơ có tính chất nào dưới đây?
A. Làm đổi màu quỳ tím.
B. Tác dụng với dung dịch axit.
C. Phản ứng thủy phân.
D. Phản ứng với dung dịch AgNO3 trong NH3.
Câu 8. Nhận xét nào dưới đây là đúng khi nói về polime?
A. Đa số các polime dễ hòa tan trong các dung môi thông thường.
B. Các polime có phân tử khối rất lớn.
C. Các polime dễ bay hơi.
D. Đa số các polime không có nhiệt độ nóng chảy xác định.
Câu 9. Thể tích oxi (đktc) cần thiết đốt cháy 4,6 gam ancol etylic là:
A. 6,72 lít
B. 7,84 lít
C. 8.69 lít
D. 11,2 lít
Câu 10. Thủy phân protein trong dung dịch axit sinh ra sản phẩm là:
A. Ancol etylic.
B. Axit axetic.
C. Grixerol.
D. Amino axit.
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm) Viết phương trình hóa học thực hiện sơ đồ chuyển đối hóa học sau:
Glucozơ Rượu etylic
Axit axetic
Natri axetat
Metan
Câu 2. (1,5 điểm) Nhận biết các chất dưới đây bằng phương pháp hóa học:
Acol etylic, axit axetic, glucozơ
Câu 3. (1,5 điểm) Đốt cháy hoàn toàn 4,8 gam một hợp chất hữu cơ A sau phản ứng thu được 6,6 gam CO2 và 5,4 gam H2O. Biết rằng khi hóa hơi ở điều kiện tiêu chuẩn 2,24 lít khí A nặng 3,2 gam.
a) Xác định công thức phân tử của hợp chất hữu cơ A.
b) Biết rằng A có phản ứng với Na. Tính thể tích khí hidro (đktc) thoát ra khi cho lượng chất A ở trên phản ứng hoàn toàn với Na dư.
(Na = 23, O = 16, C = 16, H = 1)
Đáp án
Phần 1. Trắc nghiệm (4 điểm)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | C | C | B | A | A | D | B | A | D |
Phần 2. Tự luận (6 điểm)
Câu 1. (2 điểm)
(1) C6H12O6 2C2H5OH + CO2
(2) C2H5OH + O2 CH3COOH + H2O
(3) CH3COOH + NaOH CH3COONa + H2O
(4) CH3COONa + NaOH CH4 + Na2CO3
Câu 2.(1,5 điểm)
- Nhúng quỳ tím vào các chất trên, chất làm đổi màu quỳ tím thành đỏ là axit axetic. Các chất còn lại không làm đổi màu quỳ tím.
- Nhỏ dung dịch AgNO3/NH3 vào các chất còn lại, chất nào xảy ra phản ứng tráng gương là glucozơ.
C6H12O6 + Ag2O C6H12O7 + 2Ag ↓
- Ancol etylic không phản ứng với AgNO3/NH3
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 13
Phần: Trắc nghiệm (4 điểm)
Câu 1: Dãy các chất làm mất màu dung dịch nước brom là
A. C2H2, C6H6, CH4
B. C2H2, CH4, C2H4
C. C2H2, C2H4
D. C2H2, H2, CH4
Câu 2: Dẫn 0,56 lít khí etilen (đktc) vào 200ml dung dịch Br2 0,2M.
Hiện tượng quan sát được là
A. màu dung dịch Br2 không đổi
B. màu da cam của dung dịch brom nhạt hơn so với ban đầu
C. màu da cam của dung dịch brom đậm hơn so với ban đầu
D. màu da cam của dung dịch brom chuyển thành không màu
Câu 3: Cặp chất nào sau đây tồn tại được trong cùng một dung dịch?
A. K2CO3 và HCl
B. NaNO3 và KHCO3
C. K2CO3 và Ca(OH)2
D. KHCO3 và NaOH
Câu 4: Cho axetilen vào bình dung dịch brom dư. Khối lượng bình tăng lên a gam, a là khối lượng của
A. dung dịch brom
B. khối lượng brom
C. axetilen
D. brom và khí axetilen
Câu 5: Dãy các chất phản ứng với dung dịch NaOH là
A. CH3COOH, (C6H10O5)n
B. CH3COOC2H5, C2H5OH
C. CH3COOH, C6H12O6
D. CH3COOH, CH3COOC2H5
Câu 6: Cho natri tác dụng với rượu etylic, chất tạo thành là
A. H2, CH3CH2ONa
B. H2, NaOH
C. NaOH, H2O
D. CH3CH2ONa, NaOH
Câu 7: Một loại rượu etylic có độ rượu 15°, thể tích C2H5OH chứa trong 1 lít rượu đó là
A. 850 ml
B. 150 ml
C. 300 ml
D. 450 ml
Câu 8: Chỉ dùng dung dịch iot và dung dịch AgNO3 trong NH3 có thể phân biệt được các chất trong mỗi dãy của dãy nào sau đây?
A. axit axetic, glucozo, saccarozo
B. xenlulozo, rượu etylic, saccarozo
C. hồ tinh bột, rượu etylic, glucozo
D. benzene, rượu etylic, glucozo
Phần tự luận (6 điểm)
Câu 9: (2 điểm) Hãy viết phương trình hóa học và ghi rõ điều kiện của các phản ứng sau:
1. Trùng hợp etilen.
2. Axit axetic tác dụng với magie.
3. Oxi hóa rượu etylic thành axit axetic.
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác
Câu 10: (2 điểm) Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau: FeS2 → SO2 → SO3 → H2SO4 → CH3COOH
Câu 11: (2 điểm) Cho 2,24 lít (đktc) hỗn hợp khí axetilen và metan vào dung dịch brom, dung dịch brom bị nhạt màu. Sau phản ứng khối lượng dung dịch tăng 1,3g.
1. Tính khối lượng brom tham gia phản ứng.
2. Xác định thành phần % về thể tích của mỗi khí trong hỗn hợp.
(cho O=16, C=12, H=1).
Đáp án
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | C | B | C | C | D | A | B | C |
Câu 1: C
Phân tử của chúng có liên kết ba và liên kết đôi.
Câu 2: B
nC2H4 = 0, 025 mol ; nBr2 = 0,04 lớn hơn số mol C2H4.
Nên còn màu da cam của dung dịch brom chỉ nhạt đi, không mất màu hẳn.
Câu 3: C
NaNO3 không tác dụng với KHCO3.
Câu 4: C
Dung dịch brom dư đã tác dụng và giữ hết axetilen.
Câu 5: D
C2H5OH, ( C6H10O5 )n không phản ứng với dung dịch NaOH.
Câu 6:A
2C2H5OH + 2Na → 2CH3CH2ONa + H2
Câu 7: B
Thể tích C2H5OH = 1000.0,15 = 150 ml.
Câu 8: C
Dùng dung dịch iot nhận ra được hồ tinh bột. dung dịch AgNO3 trong NH3 có thể phân biệt được rượu etylic và glucozo.
Câu 9:
1. Trùng hợp etilen: nCH2=CH2 to, xt, p→ (-CH2-CH2-)n
2. Axit axetic tác dụng với magie: 2CH3COOH + Mg → (CH3COO)2Mg + H2
3. Oxi hóa rượu etylic thành axit axetic:
C2H5OH + O2 men giấm→ CH3COOH + H2O
4. Đun nóng hỗn hợp rượu etylic và axit axetic có axit sunfuric đặc làm xúc tác.
CH3COOH + C2H5OH to, xt⇋ CH3COOC2H5 + H2O
Câu 10:
Viết các phương trình hóa học (ghi rõ điều kiện) biểu diễn những chuyển hóa sau:
4FeS2 + 11O2 to→ 8SO2 + 2Fe2O3
2SO2 + O2 to, xt⇋ 2SO3
SO3 + H2O → H2SO4
H2SO4+ 2CH3COONa → 2CH3COOH + Na2SO4
Câu 11:
Dung dịch brom (dư) nên khối lượng dung dịch tăng bằng khối lượng C2H2 bị giữ lại tức bằng 1,3 gam.
C2H2 + 2Br2 → C2H2Br4
nC2H2 = 1,3/26 = 0,05 mol. Suy ra nBr2 = 0,05 x 2 = 0,1 mol.
Khối lượng brom tham gia phản ứng: 0,1 x 189 = 18 (gam).
Thành phần % về thể tích của C2H2 là 50%.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 14
Câu 1: (1,5 điểm) Viết 3 phương trình phản ứng điều chế glucozo.
Câu 2: (1,5 điểm) Để xác minh đường gluocozo (thường có trong nước tiểu của người bệnh đái đường) người ta chọn thuốc thử nào? Viết phương trình hóa học để minh họa.
Câu 3: (2 điểm) Khi đốt cháy cùng số mol các khí: CH4, C2H4, C3H4, C4H4. Tính tỉ lệ theo thể tích của khí oxi cần dùng để đốt cháy mỗi chất (đo cùng điều kiện).
Câu 4: (2,5 điểm) Xà phòng hóa hoàn toàn 964,2g một loại chất béo thuộc dạng (RCOO)3C3H5, cần vừa đủa 130g NaOH. Tính khối lượng muối của axit hữu cơ thu được (cho H=1, C=12, O=16, Na=23).
Câu 5: (2,5 điểm) Nhúng một thanh sắt vào dung dịch CuSO4 sau một thời gian lấy thanh sắt ra khổi dung dịch cân lại thấy nặng thêm 0,8g. Khối lượng dung dịch giảm so với ban đầu là bao nhiêu gam (Cu=64, Fe=56)?
Đáp án
Câu 1:
Từ saccarozo: C12H22O11 + H2O H2SO4→ 2C6H12O6
Từ tinh bột: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Từ xenlulozo: (C6H10O5)n + nH2O H2SO4→ nC6H12O6
Câu 2:
Dung dịch AgNO3 trong NH3
Ag2O + C6H12O6 NH3→ C6H12O7 + 2Ag
Câu 3:
CH4 + 2O2 to→ CO2 + 2H2O
C2H4 + 3O2 to→ 2CO2 + 2H2O
C3H4 + 4O2 to→ 3CO2 + 2H2O
C4H4 + 5O2 to→ 4CO2 + 2H2O
Tỉ lệ thể tích oxi cần dùng lần lượt: 2:3:4:5.
Câu 4:
(RCOO)3C3H5 + 3NaOH to→ C3H5(OH)3 + 3RCOONa
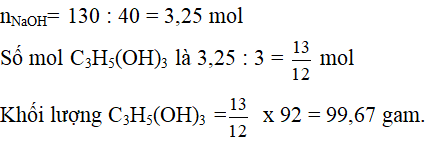
Dùng định luật bảo toàn khối lượng:
Khối lượng chất béo + khối lượng NaOH = Khối lượng C3H5(OH)3 + khối lượng muối của axit hữu cơ.
=> Khối lượng muối = 964,2 + 130 – 99,67 = 994,5 gam.
Câu 5:
Fe + CuSO4 → Cu + FeSO4
Theo phương trình cứ 56 gam Fe tan vào dung dịch thì có 64 gam Cu tách ra khỏi dung dịch. Thanh Fe tăng khối lượng nên khối lượng dung dịch phải giảm đi đúng bằng khối lượng thanh Fe tăng lên.
Vậy khối lượng thanh sắt tăng 0,8 gam → khối lượng dung dịch giảm so với ban đầu 0,8 gam.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Học kì 2
Năm học ...
Môn: Hóa học 9
Thời gian làm bài: 45 phút
Đề thi Học kì 2 Hoá học lớp 9 có đáp án đề số 15
A – TRẮC NGHIỆM(4 điểm): Khoanh tròn vào đầu chữ cái chỉ câu trả lời đúng nhất.
Câu 1: Thủy phân chất béo trong môi trường axit thu được:
A. glixerol và một loại axit béo.
B. glixerol và một số loại axit béo.
C. glixerol và một muối của axit béo.
D. glixerol và xà phòng.
Câu 2: Chọn phương pháp tốt nhất làm sạch vết dầu ăn dính trên quần áo.
A. Giặt bằng giấm.
B. Giặt bằng nước.
C. Giặt bằng xà phòng
D. Giặt bằng dung dịch axit sunfuric loãng.
Câu 3: Khí đất đèn có công thức phân tử là?
A. CH4
B. C2H4
C. C2H2
D. CaC2
Câu 4: Có ba lọ không nhãn đựng : rượu etylic, axit axetic, dầu ăn. Có thể phân biệt bằng cách nào sau đây ?
A. Dùng quỳ tím và nước.
B. Khí cacbon đioxit và nước.
C. Kim loại natri và nước.
D. Phenolphtalein và nước.
Câu 5: Dãy các hợp chất nào sau đây là hợp chất hữu cơ ?
A. CH4, C2H6, CO2.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO.
D. C2H2, C2H6O, CaCO3.
Câu 6:Dãy các chất nào sau đây đều là hiđrocacbon ?
A. C2H6, C4H10, C2H4.
B. CH4, C2H2, C3H7Cl.
C. C2H4, CH4, C2H5Cl
D. C2H6O, C3H8, C2H2.
Câu 7: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi
C. hai liên kết đôi.
D. một liên kết ba.
Câu 8: Số thứ tự chu kỳ trong bảng hệ thống tuần hoàn cho biết:
A.Số thứ tự của nguyên tố
B. Số electron lớp ngoài cùng
C. Số hiệu nguyên tử
D. Số lớp electron.
B – TỰ LUẬN (6 điểm)
Câu 9: Cho K, NaOH, K2O, CaCO3 lần lượt vào các dung dịch C2H5OH và CH3COOH. Có những phản ứng nào xảy ra, viết phương trình phản ứng nếu có.
Câu 10: Có 3 chất khí không màu là CH4 , C2H2 , CO2 đựng trong 3 lọ riêng biệt . Hãy nêu cách nhận biết 3 lọ khí trên bằng phương pháp hóa học.
Câu 11: Đốt cháy hết 32g khí CH4 trong không khí.
a, Tính thể tích CO2 sinh ra ở đktc
b, Tính khối lượng không khí cần dùng để đốt cháy hết lượng CH4 trên biết rằng khí O2 chiếm 20% thể tích không khí? Biết khối lượng riêng không khí là 1,3g/ml
Câu 12: Hoàn thành chuỗi chuyển đổi sau bằng các PTHH.
Đáp án
I. Trắc nghiệm (4 điểm) Mỗi câu trả lời đúng được 0,5 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
C |
C |
A |
B |
A |
D |
D |
II. Tự luận (6 điểm)
|
Câu |
Nội dung |
Điểm |
|
Câu 9 (2,5đ) |
CH3COOH + NaOH →CH3COONa + H2O 2CH3COOH + CaCO3→ (CH3COO)2Ca + H2O + CO2 2CH3COOH + K2O →2CH3COOK + H2O 2C2H5OH + 2K →2C2H5OK + H2 2CH3COOH + 2K →2CH3COOK + H2 |
Mỗi câu xác định và viết PTHH đúng được 0,5 điểm |
|
Câu 10 (1,5 đ) |
Đốt cháy mẫu thử nhận ra được CO2, Còn lại cho lần lượt lội qua dung dịch Brom nhận ra C2H2 làm mất mầu, còn lại là CH4 |
Mỗi ý đúng 0,5 điểm |
|
Câu 11 (1 đ) |
a/ PTHH: CH4 + 2O2→ 2H2O + CO2 b/ 1mol 2mol 1mol 2mol x y - nCO2 = 2mol => VCO2 = 2.22,4 = 44,8lit - nO2 = 2nCH4 = 4mol V.O2 = 89,6lit Vậy V.không khí = 89,6.5 = 448lit m.KK = 448.000 x 1,3 = 582.400g |
(0,5 đ)
(0,5 đ)
|
|
Câu 12 (1 đ) |
Mỗi PTHH đúng được 0,5 điểm C + O2→CO2 CO2 + CaO →CaCO3 CaCO3 →CO2 + CaO CO2 + NaOH →NaHCO3 |
Mỗi câu đúng được 0,25 điểm |
|
Tổng |
|
6đ |
Để xem trọn bộ Đề thi Hóa học 9 có đáp án, Thầy/ cô vui lòng Tải xuống!
Xem thêm các bộ đề thi lớp 9 chọn lọc, hay khác:
Đề thi Học kì 2 Sinh học lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Ngữ văn lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Địa Lí lớp 9 năm 2022 - 2023 có đáp án
Đề thi Học kì 2 Vật lí lớp 9 năm 2022 - 2023 có đáp án
Đề thi học kì 2 Lịch sử lớp 9 năm 2022 - 2023 có đáp án
Xem thêm các chương trình khác:
- Góp ý sgk lớp 9 tất cả các môn năm 2024 - 2025 (3 bộ sách)
- Đề thi vào 10 môn Toán | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Toán mới nhất
- Đề thi vào 10 môn Địa lí
- Đề thi vào 10 môn Văn | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Ngữ Văn mới nhất
- Đề thi vào 10 môn Tiếng Anh | Tuyển tập đề thi thử, đề chính thức vào lớp 10 môn Tiếng Anh mới nhất