Tại sao ở điều kiện thường (25 độ C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi
Lời giải Bài 3.8 trang 17 SBT Hóa học 11 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 11.
Giải SBT Hóa học 11 Bài 3: Đơn chất nitrogen
Bài 3.8 trang 17 SBT Hóa học 11: Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
– Năng lượng liên kết ba N≡N là 941 kJ/mol.
– Năng lượng liên kết ba P≡P là 490 kJ/mol.
– Năng lượng liên kết đơn N-N là 160 kJ/mol.
– Năng lượng liên kết đơn P-P là 209 kJ/mol.
Lời giải:
+ Xét 4 nguyên tử P tạo thành:
- Phân tử P4 gồm 4 nguyên tử P liên kết với nhau bằng 6 liên kết đơn P-P.
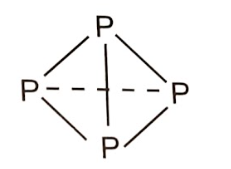
Năng lượng được giải phóng khi tạo một phân tử P4: 6 × 209 = 1254 (kJ).
- Phân tử P2 gồm 2 phân tử P≡P. Năng lượng được giải phóng khi tạo hai phân tử P2: 2 × 490 = 980 (kJ).
→ Phân tử P4 bền hơn P2 nên ở điều kiện thường, phosphorus trắng tồn tại ở dạng phân tử P4.
+ Xét 4 nguyên tử N tạo thành:
- Phân tử N4 gồm 4 nguyên tử N liên kết với nhau bằng 6 liên kết đơn N-N. Năng lượng được giải phóng khi tạo một phân tử N4: 6×160 = 960 (kJ).
- Phân tử N2 gồm 2 phân tử N≡N. Năng lượng được giải phóng khi tạo hai phân tử N2: 2 × 941 = 1882 (kJ).
=> Phân tử N2 bền hơn N4 ở điều kiện thường.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 3.1 trang 16 SBT Hóa học 11: Ở trạng thái tự nhiên, nitrogen...
Bài 3.2 trang 16 SBT Hóa học 11: Cấu hình electron nguyên tử của nitrogen là...
Bài 3.3 trang 16 SBT Hóa học 11: Tính chất nào sau đây của nitrogen không đúng?...
Bài 3.4 trang 16 SBT Hóa học 11: Nitrogen trong không khí có vai trò nào sau đây?...
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 6: Sulfur và sulfur dioxide
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 11 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 11 - Chân trời sáng tạo
- Giải SBT Ngữ văn 11 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 11 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Chân trời sáng tạo
- Soạn văn 11 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 11 – Chân trời sáng tạo
- Lý thuyết Toán 11 - Chân trời sáng tạo
- Giải sbt Toán 11 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 11 – Friends Global
- Giải sbt Tiếng Anh 11 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh 11 Friends Global đầy đủ nhất
- Bài tập Tiếng Anh 11 Friends Global theo Unit có đáp án
- Giải sgk Vật lí 11 – Chân trời sáng tạo
- Lý thuyết Vật lí 11 – Chân trời sáng tạo
- Giải sbt Vật lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 11 – Chân trời sáng tạo
- Giải sgk Sinh học 11 – Chân trời sáng tạo
- Lý thuyết Sinh học 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 11 – Chân trời sáng tạo
- Giải sbt Sinh học 11 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Chân trời sáng tạo
- Lý thuyết Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sgk Lịch sử 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 11 – Chân trời sáng tạo
- Lý thuyết Lịch sử 11 - Chân trời sáng tạo
- Giải sbt Lịch sử 11 – Chân trời sáng tạo
- Giải sgk Địa lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 11 – Chân trời sáng tạo
- Lý thuyết Địa lí 11 - Chân trời sáng tạo
- Giải sbt Địa lí 11 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 11 – Chân trời sáng tạo
