Sách bài tập Hóa 11 Bài 7 (Chân trời sáng tạo): Sulfuric acid và muối sulfate
Với giải sách bài tập Hóa 11 Bài 7: Sulfuric acid và muối sulfate sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập trong SBT Hóa 11 Bài 7.
Giải SBT Hóa 11 Bài 7: Sulfuric acid và muối sulfate
Bài 7.1 trang 28 SBT Hóa học 11: Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
C. Na.
D. Cu.
Lời giải:
Cu đứng sau H trong dãy hoạt động hoá học, do đó Cu không tác dụng với dung dịch H2SO4 loãng.
→ Chọn D.
B. Zn, Pt, Au, Mg.
C. Al, Fe, Zn, Mg.
D. Al, Fe, Au, Mg.
Lời giải:
Các kim loại không tác dụng với dung dịch H2SO4 đặc, nguội: Al, Fe, Au, Pt.
→ Chọn A.
C. Tính acid mạnh.
D. Tính khử mạnh.
Lời giải:
Dung dịch sulfuric acid đặc khác dung dịch sulfuric acid loãng ở tính oxi hóa mạnh và tính háo nước.
→ Chọn B.
Bài 7.4 trang 28 SBT Hóa học 11: Cách pha loãng dung dịch H2SO4 đặc nào sau đây đúng?
A. Rót nhanh acid vào nước và khuấy đều.
B. Rót nhanh nước vào acid và khuấy đều.
C. Rót từ từ nước vào acid và khuấy đều.
D. Rót từ từ acid vào nước và khuấy đều.
Lời giải:
Cách pha dung dịch H2SO4 đặc: đổ từ từ sulfuric acid đặc vào nước rồi khuấy đều.
→ Chọn D.
A. dung dịch H2SO4 đặc bị thụ động hoá trong thép.
B. dung dịch H2SO4 đặc không phản ứng với sắt ở nhiệt độ thường.
C. dung dịch H2SO4 đặc không phản ứng với kim loại ở nhiệt độ thường.
D. thép có chứa các chất phụ trợ không phản ứng với dung dịch H2SO4 đặc.
Lời giải:
Thành phần chính của thép là Fe. Ở nhiệt độ thường Fe bị thụ động bởi dung dịch H2SO4 đặc, nguội. Do đó, sắt không tác dụng với dung dịch sulfuric acid đặc nên người ta thường dùng các bình bằng thép để đựng và chuyên chở dung dịch H2SO4 đặc.
→ Chọn B.
A. 40%.
B. 60%.
C. 25%.
D. 75%.
Lời giải:
Sơ đồ phản ứng:
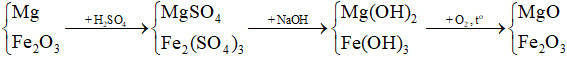
Ta thấy khối lượng ban đầu (Mg và Fe2O3) và khối lượng chất rắn không đổi (MgO, Fe2O3) chênh lệch nhau ở khối lượng của nguyên tố oxygen.
Bảo toàn nguyên tố O, ta có: nMg = nO = 0,5 (mol)
Lời giải:
Khối lượng bình đựng dung dịch H2SO4 đặc để trong không khí ẩm lâu ngày tăng lên do H2SO4 đặc hút nước trong không khí ẩm.
Lời giải:
Khi bị bỏng acid, cần nhanh chóng bỏ quần áo bị dính acid, rửa ngay bằng nước sạch khoảng 20 phút. Sau đó, cần nhanh chóng chuyển người bị bỏng đến cơ sở y tế gần nhất để được theo dõi và điều trị.
Lời giải:
Trong công đoạn sản xuất SO3 từ SO2 để thực hiện cần có điều kiện phản ứng là nhiệt độ 450 – 500 oC, xúc tác vanadium (V) oxide (V2O5).
Với xúc tác là các ion kim loại trong khói bụi, SO2 bị oxi hóa và hòa tan trong nước mưa tạo thành sulfuric acid
![]()
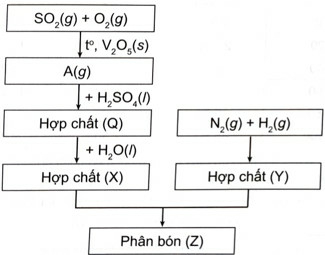
Lời giải:
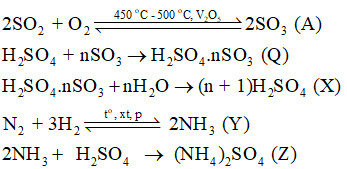
Lời giải:
Đánh số thứ tự cho từng dung dịch, trích mẫu thử sang ống nghiệm đánh số tương ứng.
- Cho lần lượt từng mẫu thử tác dụng với dung dịch H2SO4:
+ Mẫu thử xuất hiện bọt khí là Na2CO3:
+ Mẫu thử không có hiện tượng là MgSO4, KNO3, NaOH, HCl.
- Cho lần lượt từng mẫu thử không hiện tượng ở trên tác dụng với dung dịch Ba(NO3)2:
+ Mẫu thử xuất hiện kết tủa trắng là MgSO4:
+ Mẫu thử không có hiện tượng là KNO3, NaOH, HCl.
- Nhúng quỳ tím vào nhóm mẫu thử không hiện tượng (KNO3, NaOH, HCl):
+ Mẫu thử không hiện tượng là KNO3.
+ Mẫu thử làm quỳ tím hóa xanh là NaOH.
+ Mẫu thử làm quỳ tím hóa đỏ là HCl.
Lời giải:
- Xét cốc (A):
Ta có:
=> H2SO4 dư, Na2CO3 hết. CO2 tính theo Na2CO3.
- Xét cốc (B):
Ta có:
+) Trường hợp (1): CaCO3 hết, HCl dư.
→ loại trường hợp CaCO3 hết, HCl dư.
+) Trường hợp (2): CaCO3 dư, HCl hết.
Đặt
b) Sau khi cân đã thăng bằng, lấy một nửa lượng dung dịch có trong cốc (A) cho vào cốc (B). Sau phản ứng, phải thêm bao nhiêu gam nước vào cốc (A) để cân trở lại thăng bằng?
Lời giải:
a)
Xét cốc (A):
Xét cốc (B):
Ta có:
=> H2SO4 hết, K2CO3 dư. CO2 tính theo H2SO4.
Ta thấy m(A) < m(B), để cân trở lại thăng bằng, ta cần thêm nước vào cốc (A).
b) – Xét cốc (A):
Ta có:
=> AgNO3 hết, HCl dư. AgCl tính theo AgNO3.
=> Khối lượng của cốc (A) sau khi lấy một nửa lượng dung dịch có trong cốc (A):
- Xét cốc (B):
Khi trộn một nửa dung dịch (A) phản ứng với dung dịch trong cốc (B), sẽ xảy ra phản ứng:
Ta thấy:
dư, H+ hết
tính theo H+
=> Khối lượng nước phải thêm vào cốc (A) để cân trở lại thăng bằng:
a) Vẽ đồ thị biểu diễn độ tan của ba muối theo nhiệt độ.
|
Nhiệt độ của nước (oC) |
Độ tan (gam/100 gam nước) |
||
|
Na2CO3 |
NH4Cl |
K2SO4 |
|
|
0 |
7,1 |
29,70 |
7,33 |
|
20 |
21,40 |
37,56 |
11,11 |
|
40 |
48,50 |
46,00 |
14,97 |
|
60 |
46,50 |
53,30 |
18,20 |
|
80 |
45,80 |
65,60 |
21,29 |
|
100 |
45,50 |
77,30 |
24,10 |
b) Độ tan của các chất rắn trong nước thường tăng theo nhiệt độ. Có nhận xét gì về độ tan của ba chất? Chất có độ tan lớn là ở nhiệt độ nào?
c) Chất nào có độ tan lớn nhất ở 30 °C và 90 °C?
Lời giải:
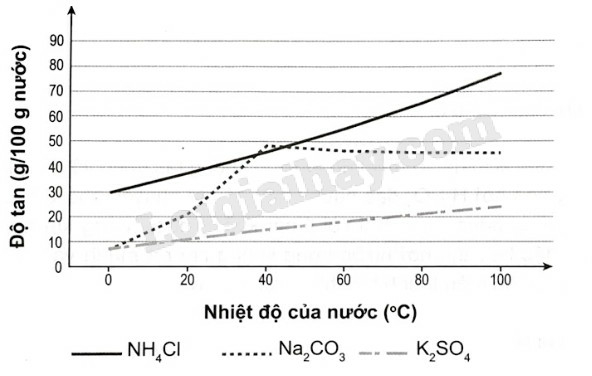
b) Độ tan của các muối tăng theo nhiệt độ. Trong đó, độ tan của NH4Cl tăng nhanh, độ tan của K2SO4 tăng chậm khi nhiệt độ tăng.
Độ tan của muối Na2CO3 tăng khi nhiệt độ tăng đến khoảng 40 °C. Sau đó độ tan của Na2CO3 lại bị giảm khi nhiệt độ tăng từ 40 °C đến 100 °C.
Chất có độ tan lớn nhất là NH4Cl, ở nhiệt độ 100 °C có độ tan là 77,30 g/100 g H2O.
c) Chất có độ tan lớn nhất: ở 30 °C là NH4Cl, ở 90 °C là NH4Cl.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 5: Một số hợp chất với oxygen của nitrogen
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 11 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 11 - Chân trời sáng tạo
- Giải SBT Ngữ văn 11 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 11 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Chân trời sáng tạo
- Soạn văn 11 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 11 – Chân trời sáng tạo
- Lý thuyết Toán 11 - Chân trời sáng tạo
- Giải sbt Toán 11 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 11 – Friends Global
- Giải sbt Tiếng Anh 11 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh 11 Friends Global đầy đủ nhất
- Bài tập Tiếng Anh 11 Friends Global theo Unit có đáp án
- Giải sgk Vật lí 11 – Chân trời sáng tạo
- Lý thuyết Vật lí 11 – Chân trời sáng tạo
- Giải sbt Vật lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 11 – Chân trời sáng tạo
- Giải sgk Sinh học 11 – Chân trời sáng tạo
- Lý thuyết Sinh học 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 11 – Chân trời sáng tạo
- Giải sbt Sinh học 11 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Chân trời sáng tạo
- Lý thuyết Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sgk Lịch sử 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 11 – Chân trời sáng tạo
- Lý thuyết Lịch sử 11 - Chân trời sáng tạo
- Giải sbt Lịch sử 11 – Chân trời sáng tạo
- Giải sgk Địa lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 11 – Chân trời sáng tạo
- Lý thuyết Địa lí 11 - Chân trời sáng tạo
- Giải sbt Địa lí 11 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 11 – Chân trời sáng tạo
