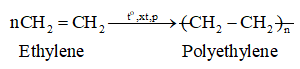Sách bài tập KHTN 9 Bài 24 (Kết nối tri thức): Alkene
Với giải sách bài tập Khoa học tự nhiên 9 Bài 24: Alkene sách Kết nối tri thức hay nhất, ngắn gọn sẽ giúp học sinh dễ dàng làm bài tập trong SBT KHTN 9 Bài 24.
Giải SBT KHTN 9 Bài 24: Alkene
Bài 24.1 trang 71 Sách bài tập KHTN 9: CTCT nào sau đây biểu diễn chất thuộc loại alkene?
A. CH2 = CH – CH3.
B. CH≡C−CH3.
C. CH3 – CH2 – CH3.
D. CH2 = CH – CH = CH2.
Lời giải:
Đáp án đúng là: A
Alkene là những hydrocarbon mạch hở, trong phân tử có một liên kết đôi
Ví dụ: CH2 = CH – CH3,….
Bài 24.2 trang 71 Sách bài tập KHTN 9: Phát biểu nào sau đây đúng?
A. Chất có CTPT dạng CnH2n là alkene.
B. Alkene là hydrocarbon mạch hở có một liên kết C=C.
C. Alkene không làm mất màu dung dịch KMnO4.
D. Alkene tác dụng với Br2 trong dung dịch theo tỉ lệ mol 1 :2.
Lời giải:
Đáp án đúng là: B
Alkene là hydrocarbon mạch hở có một liên kết C=C.
A sai vì alkene có CTPT dạng CnH2n, ngoài ra có xicloalkane cũng có CTPT dạng như vậy.
C sai vì alkene làm mất màu dung dịch KMnO4.
D sai vì Alkene tác dụng với Br2 trong dung dịch theo tỉ lệ mol 1 : 1.
Bài 24.3 trang 71 Sách bài tập KHTN 9: Khi đốt cháy hoàn toàn một lượng alkene, các sản phẩm cháy có mối liên hệ với nhau như thế nào?
A. Số mol CO2 lớn hơn số mol H2O.
B. Số mol CO2 nhỏ hơn số mol H2O.
C. Số mol CO2 bằng số mol H2O.
D. Không có mối liên hệ giữa số mol hai sản phẩm.
Lời giải:
Đáp án đúng là: C
Khi đốt cháy hoàn toàn một lượng alkene, các sản phẩm cháy có mối liên hệ với nhau là: số mol CO2 bằng số mol H2O.
2CnH2n + 3nO2 → 2nCO2 + 2nH2O
Bài 24.4 trang 71 Sách bài tập KHTN 9: Ethylene không có phản ứng nào sau đây?
A. Tác dụng với NaOH.
B. Tác dụng với H2 (xúc tác Ni, đun nóng).
C. Làm nhạt màu dung dịch Br2.
D. Cháy trong không khí.
Lời giải:
Đáp án đúng là: A
Ethylene có phản ứng: Tác dụng với H2 (xúc tác Ni, đun nóng), làm nhạt màu dung dịch Br2, cháy trong không khí.
C2H4 + H2 Ni, to→C2H6
C2H4 + Br2 → BrCH2 – CH2Br
C2H4 + 3O2 to→ 2CO2 + 2H2O
Bài 24.5 trang 71 Sách bài tập KHTN 9: Đốt cháy hoàn toàn 1 mol alkene X, thu được CO2 và H2O với tổng khối lượng 310 g. CTPT của X là
A. C2H4.
B. C4H8.
C. C5H10.
D. C3H6.
Lời giải:
Đáp án đúng là: C
PTHH: CnH2n+3n2O2→t°
Số mol: 1 n n
1 mol alkene tạo ra n mol CO2 và n mol H2O.
44 . n + 18 . n = 310 → n = 5.
Alkene là C5H10.
Bài 24.6 trang 71 Sách bài tập KHTN 9: Viết PTHH dưới dạng phân tử minh hoạ tính chất hoá học của alkene C4H8.
Lời giải:
Phản ứng cháy:
Phản ứng cộng bromine: C4H8 + Br2 → C4H8Br2
Phản ứng trùng hợp: nC4H8
Bài 24.7 trang 71 Sách bài tập KHTN 9: Có hai bình giống nhau, một bình chứa khí methane, một bình chứa khí ethylene. Hãy nêu cách nhận biết mỗi bình bằng phương pháp hoá học.
Lời giải:
Cho mỗi khí đi qua mỗi bình đựng dung dịch bromine. Khí nào làm dung dịch mất màu thì là ethylene.
C2H4 + Br2 → BrCH2 – CH2Br
Bài 24.8 trang 71 Sách bài tập KHTN 9: Một hỗn hợp khí Y gồm methane và ethylene, biết Y có tỉ khối so với hydrogen bằng 10. Đốt cháy hoàn toàn 6 g Y, hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư, thu được m gam kết tủa.
a) Xác định thành phần hỗn hợp Y.
b) Tính giá trị của m.
Lời giải:
a) Gọi số mol CH4 và C2H4 lần lượt là a và b.
Khối lượng hỗn hợp Y: 16 . a + 28 . b = 6 (1)
Khối lượng mol trung bình của Y: 10 . 2 = 20 (g/mol).
Số mol hỗn hợp Y: (2)
Từ (1) và (2), ta được a = 0,2 mol; b = 0,1 mol.
b)
Số mol: 0,2 → 0,2 0,4
Số mol: 0,1 → 0,2 0,2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Số mol: 0,4 → 0,4
m = 100 . 0,4 = 40 (g).
Lý thuyết KHTN 9 Bài 24: Alkene
I. Khái niệm alkene
- Alkene là những hydrocarbon mạch hở, trong phân tử có một liên kết đôi
Ví dụ: CH3 – CH = CH2, CH3 – CH = CH – CH3,….
- Công thức chung của các alkene có dạng CnH2n (với , n là số nguyên, dương).
II. Ethylene
1. Tính chất vật lí
Ethylene là chất khí ở điều kiện thường, không màu, hầu như không tan trong nước, tan ít trong các dung môi hữu cơ như ethylic alcohol.
2. Cấu tạo phân tử
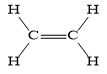
- Công thức phân tử của ethylene là C2H4.
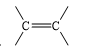
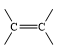
- Công thức cấu tạo của ethylene là
Phân tử ethylene có liên kết đôi 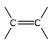
3. Tính chất hoá học
a) Phản ứng cháy
Phản ứng đốt cháy các alkene tạo ra sản phẩm chủ yếu là khí carbon dioxide và hơi nước. Phản ứng toả ra nhiều nhiệt.
b) Phản ứng cộng
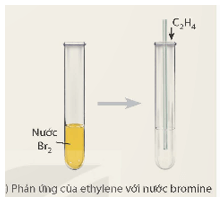
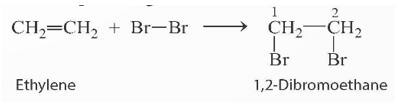
- Trong phản ứng của ethylene với nước bromine, phân tử ethylene đã làm mất màu nước bromine, liên kết kém bền trong liên kết đôi bị phá vỡ.
- Phản ứng:
Viết gọn lại là: C2H4 + Br2 → C2H4Br2
Phản ứng này được gọi là phản ứng cộng.
c) Phản ứng trùng hợp
- Ở điều kiện thích hợp, các phân tử ethylene cộng hợp liên tiếp với nhau, liên kết kém bền trong liên kết đôi của phân tử ethylene bị phá vỡ, tạo thành chất có khối lượng phân tử lớn.
Phản ứng này được gọi là phản ứng trùng hợp.
- Polyethylene (nhựa PE) là chất rắn, không tan trong nước, không độc, được dùng để sản xuất túi đựng, màng bọc, chai, bình chứa,… Tuy nhiên, nhựa PE rất khó phân huỷ sinh học, có thể tồn tạo bền trong môi trường hàng trăm năm, vì vậy cần giảm việc thải các sản phẩm làm từ nhựa PE ra ngoài môi trường.
4. Ứng dụng
Ethylene là nguyên liệu quan trọng cho ngành công nghiệp sản xuất hoá chất và tổng hợp polymer:
- Tổng hợp acetic acid;
- Tổng hợp ethyl alcohol;
- Sản xuất dung môi;
- Kích thích quả mau chín;
- Sản xuất polyethylene (PE); poly(vinyl chloride) (PVC).
Xem thêm các chương trình khác:
- Soạn văn 9 Kết nối tri thức (hay nhất)
- Văn mẫu 9 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 9 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 9 - Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 9 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn 9 – Kết nối tri thức
- Soạn văn 9 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 9 – Kết nối tri thức
- Lý thuyết Toán 9 – Kết nối tri thức
- Giải sbt Toán 9 – Kết nối tri thức
- Bài tập Tiếng Anh 9 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 9 - Global success
- Trọn bộ Từ vựng Tiếng Anh 9 Global success đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 9 Global success đầy đủ nhất
- Giải sbt Tiếng Anh 9 – Global Success
- Giải sgk Lịch sử 9 – Kết nối tri thức
- Giải sbt Lịch sử 9 – Kết nối tri thức
- Giải sgk Địa lí 9 – Kết nối tri thức
- Giải sbt Địa lí 9 – Kết nối tri thức
- Giải sgk Tin học 9 – Kết nối tri thức
- Giải sbt Tin học 9 – Kết nối tri thức
- Giải sgk Công nghệ 9 – Kết nối tri thức
- Giải sgk Giáo dục công dân 9 – Kết nối tri thức
- Giải sbt Giáo dục công dân 9 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 9 – Kết nối tri thức