Lý thuyết Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học - Chân trời sáng tạo
Tóm tắt lý thuyết Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học ngắn gọn, chi tiết sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Khoa học tự nhiên 7.
Lý thuyết Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
I. Hóa trị
1. Định nghĩa
- Hóa trị của một nguyên tố trong hợp chất là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
- Hóa trị được biểu thị bằng các chữ số La Mã (I; II …)
2. Cách xác định
- Để xác định hóa trị của nguyên tố trong hợp chất cộng hóa trị, người ta dựa vào hóa trị của nguyên tố đã biết làm đơn vị, chẳng hạn hóa trị của H là I; hóa trị của O là II.
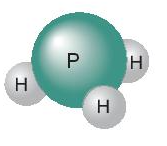
Ví dụ 1: Trong phân tử phosphine (PH3) một nguyên tử P có khả năng liên kết với 3 nguyên tử H, mỗi nguyên tử H có hóa trị I ⇒ P có hóa trị III
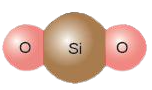
Ví dụ 2: Trong phân tử silicon dioxide (SiO2), 1 nguyên tử Si có khả năng liên kết với 2 nguyên tử O, mỗi nguyên tử O hóa trị II ⇒ Si có hóa trị IV.
II. Quy tắc hóa trị
- Quy tắc hóa trị: Trong phân tử hợp chất hai nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
- Ví dụ: Trong phân tử aluminium chlorine (AlCl3), hóa trị và số nguyên tử tham gia liên kết của Al và Cl như sau:
|
Nguyên tố |
Al |
Cl |
|
Hóa trị |
III |
I |
|
Số nguyên tử |
1 |
3 |
|
Tích hóa trị và số nguyên tử |
III × 1 = I × 3 |
|
III. Công thức hóa học
Phân tử của chất được tạo thành từ nguyên tử của một hay nhiều nguyên tố và được biểu diễn bằng công thức hóa học.
1. Viết công thức hóa học của đơn chất
- Công thức hóa học của đơn chất được kí hiệu bằng kí hiệu nguyên tố hóa học kèm với chỉ số (chỉ số nguyên tử của mỗi nguyên tố trong một phân tử) ghi ở bên dưới.
- Một số đơn chất phi kim thể khí (ở điều kiện thường) có công thức hóa học chung là Ax.
Ví dụ: Phân tử khí oxygen được tạo thành từ hai nguyên tử oxygen liên kết với nhau, công thức phân tử của khí oxygen là O2.
- Đối với đơn chất kim loại, hạt hợp thành là nguyên tử nên kí hiệu hóa học của nguyên tố kim loại được coi là công thức hóa học của đơn chất kim loại.
Ví dụ: Kim loại iron có công thức hóa học là Fe.
- Một số đơn chất phi kim ở thể rắn, quy ước công thức hóa học là kí hiệu nguyên tố.
Ví dụ: Công thức hóa học của đơn chất phosphorus là P.
Chú ý:
- Nếu chỉ số trong công thức hóa học bằng 1 thì quy ước không ghi.
- Trong hợp chất gồm oxygen và nguyên tố khác, nguyên tố oxygen thường ghi ở cuối công thức hóa học.
2. Viết công thức hóa học của hợp chất
- Công thức hóa học của hợp chất gồm kí hiệu hóa học của những nguyên tố tạo thành kèm chỉ số ở bên dưới mỗi kí hiệu.
- Công thức chung của phân tử có dạng: AxBy
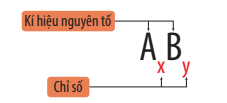
Ví dụ: Phân tử carbon dioxide gồm 1 nguyên tử carbon và 2 nguyên tử oxygen, công thức hóa học của phân tử carbon dioxide là CO2.
- Công thức hóa học cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố có trong phân tử đó. Từ đó, có thể tính được khối lượng phân tử.
Chú ý: Cách viết công thức hóa học hợp chất
- Hợp chất tạo bởi oxygen và nguyên tố khác, công thức hóa học có dạng AxOy.
- Nếu A là kim loại và B là phi kim, công thức hóa học có dạng AxBy.
- Hợp chất tạo bởi hydrogen và nguyên tố A:
+ Nếu A thuộc các nhóm IA đến VA, công thức hóa học có dạng AHx.
+ Nếu A thuộc các nhóm VIA đến VIIA, công thức hóa học có dạng HxA.
IV. Tính phần trăm nguyên tố trong hợp chất
- Phần trăm (%) nguyên tố trong hợp chất được tính bằng tỉ số giữa khối lượng của nguyên tố đó trong một phân tử hợp chất và khối lượng phân tử (KLPT) của hợp chất.
- Khối lượng của nguyên tố trong một phân tử hợp chất được tính bằng tích của khối lượng nguyên tử (KLNT) và số nguyên tử của nguyên tố đó.
- Tổng quát:
+ Với hợp chất AxBy, ta có:
+ Tổng tất cả các phần trăm nguyên tố trong một phân tử luôn bằng 100%.
- Ví dụ: Đối với hợp chất MgCl2
%Mg = = = 25,26%
%O = 100% - 25,26% = 74,74%
V. Xác định công thức hóa học
1. Xác định công thức hóa học khi biết phần trăm nguyên tố và khối lượng phân tử
- Các bước xác định:
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát);
Bước 2: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất;
Bước 3: Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm.
- Ví dụ: Thạch nhũ trong hang động có thành phần chính là hợp chất (T). Phân tử (T) có cấu tạo từ nguyên tố calcium, carbon và oxygen với các tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử (T) là 100 amu. Hãy xác định công thức hóa học của (T).
Hướng dẫn giải:
Đặt công thức hóa học của hợp chất (T) là: CaxCyOz
%Ca = = 40%
⇒ x = 1
%C = = 12%
⇒ y = 1
%O = = 48%
⇒ z = 3
Vậy công thức hóa học của hợp chất là CaCO3
2. Xác định công thức hóa học dựa vào quy tắc hóa trị
- Các bước xác định:
+ Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát)
+ Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử.
+ Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm.
- Ví dụ: Hợp chất tạo bởi oxygen và phosphorus có dạng:
Theo quy tắc hóa trị ta có: x × V = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 5
Vậy công thức hóa học của hợp chất là P2O5
Chú ý:
- Quy tắc hóa trị thường đúng với đa số hợp chất vô cơ. Tuy nhiên, quy tắc này không đúng với đa số hợp chất hữu cơ (C2H4; C6H6 …) và một số hợp chất vô cơ (H2O2; Na2O2 …)
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên 7 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 8: Tốc độ chuyển động
Lý thuyết Bài 9. Đồ thị quãng đường – thời gian
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Chân trời sáng tạo
- Giải sbt Toán 7 – Chân trời sáng tạo
- Lý thuyết Toán 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (ngắn nhất) – Chân trời sáng tạo
- Văn mẫu lớp 7 – Chân trời sáng tạo
- Giải sgk Lịch sử 7 – Chân trời sáng tạo
- Lý thuyết Lịch Sử 7 – Chân trời sáng tạo
- Giải sbt Lịch sử 7 – Chân trời sáng tạo
- Giải sgk Địa lí 7 – Chân trời sáng tạo
- Lý thuyết Địa Lí 7 – Chân trời sáng tạo
- Giải sbt Địa lí 7 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 7 Friend plus – Chân trời sáng tạo
- Giải sbt Tiếng Anh 7 Friend plus– Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 7 Friends plus đầy đủ nhất
- Bài tập Tiếng Anh 7 Friends plus theo Unit có đáp án
- Giải sgk Giáo dục công dân 7 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sgk Công nghệ 7 – Chân trời sáng tạo
- Lý thuyết Công nghệ 7 – Chân trời sáng tạo
- Giải sbt Công nghệ 7 – Chân trời sáng tạo
- Giải sgk Tin học 7 – Chân trời sáng tạo
- Lý thuyết Tin học 7 – Chân trời sáng tạo
- Giải sbt Tin học 7 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 7 – Chân trời sáng tạo
- Giải sgk Âm nhạc 7 – Chân trời sáng tạo
