Lý thuyết Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học - Chân trời sáng tạo
Tóm tắt lý thuyết Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học ngắn gọn, chi tiết sách Chân trời sáng tạo sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Khoa học tự nhiên 7.
Lý thuyết Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
I. Vỏ nguyên tử khí hiếm
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hóa học kém.
Nhóm khí hiếm gồm: helium (He); neon (Ne); argon (Ar); krypton (Kr); xenon (Xe), …
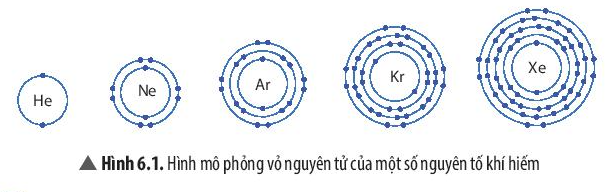 - Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng có 2 electron.
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng có 2 electron.
Chú ý:
Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng nhường hoặc nhận hoặc góp chung electron.
+ Nguyên tử của các nguyên tố kim loại thường có khuynh hướng nhường electron ở lớp ngoài cùng.
+ Nguyên tử của các nguyên tố phi kim thường có khuynh hướng nhận thêm hoặc góp chung electron để có lớp electron ngoài cùng bền vững.
II. Liên kết ion
1. Sự tạo thành ion dương
- Các nguyên tử của nguyên tố kim loại thường có xu hướng nhường electron ở lớp ngoài cùng để có lớp electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử kim loại khi nhường electron sẽ tạo thành ion dương tương ứng.
Ví dụ: Nguyên tử magnesium nhường 2 electron lớp ngoài cùng tạo thành ion magnesium. Ion magnesium là ion dương, có 8 electron lớp ngoài cùng, cấu hình electron giống với khí hiếm Ne.
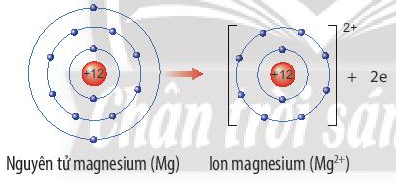
Hay viết gọn: Mg → Mg2+ + 2e
2. Sự tạo thành ion âm
- Các nguyên tử của nguyên tố phi kim (Cl, O, N …) có số electron lớp ngoài cùng là 7, 6, 5, … nên khi kết hợp với các nguyên tử kim loại, nguyên tử phi kim có xu hướng nhận electron từ nguyên tử kim loại để có lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm gần nhất trong bảng tuần hoàn.
- Nguyên tử phi kim khi nhận electron sẽ tạo thành ion âm tương ứng.
Ví dụ: Nguyên tử oxygen nhận thêm 2 electron vào lớp ngoài cùng tạo thành ion oxygen. Ion oxygen có 8 electron lớp ngoài cùng, cấu hình electron giống với nguyên tử khí hiếm Ne.
 Hay viết gọn: O + 2e → O2-
Hay viết gọn: O + 2e → O2-
3. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên tử kim loại nhường electron tạo thành ion dương, đồng thời nguyên tử phi kim nhận electron tạo thành ion âm.
- Ion âm và ion dương mang điện tích trái dấu, hút nhau, tạo thành liên kết ion.
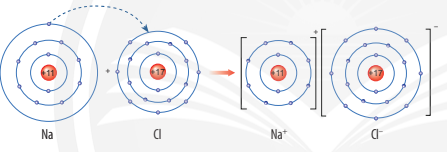
Ví dụ 1: Sơ đồ tạo thành liên kết ion trong phân tử NaCl (sodium chloride).
Nguyên tử sodium nhường 1 electron tạo thành ion sodium (điện tích dương), nguyên tử chlorine nhận 1 electron tạo thành ion chlorine (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử sodium chlorine.
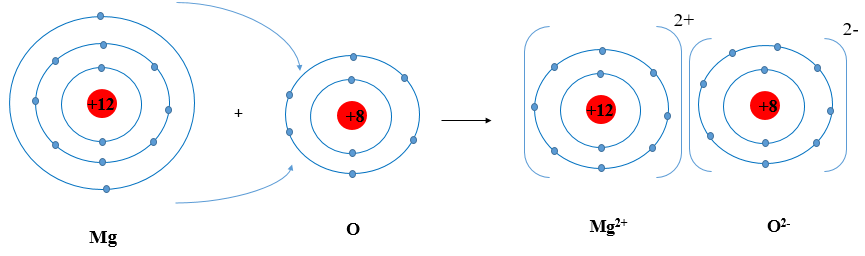
 Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
Nguyên tử magnesium nhường 2 electron tạo thành ion magnesium (điện tích dương), nguyên tử oxygen nhận 2 electron tạo thành ion oxygen (điện tích âm), hai ion trên trái dấu nên hút nhau tạo thành phân tử magnesium oxide
Kết luận:
- Liên kết ion là liên kết giữa ion dương và ion âm.
- Các ion dương và ion âm đơn nguyên tử có lớp electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
III. Liên kết cộng hóa trị
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dùng chung electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên tố phi kim với phi kim.
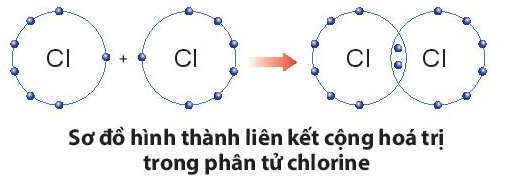
Ví dụ 1: Quá trình tạo thành liên kết cộng hóa trị trong phân tử chlorine:
+ Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
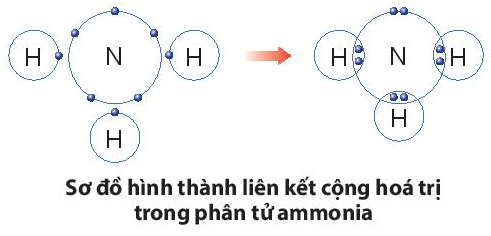
 Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
+ Nitrogen thuộc nhóm VA, có 5 electron lớp ngoài cùng, nguyên tử nitrogen sẽ góp chung 3 electron.
+ Hydrogen thuộc nhóm IA, có 1 electron lớp ngoài cùng, mỗi nguyên tử hydrogen sẽ góp chung 1 electron, theo sơ đồ sau:
IV. Chất ion, chất cộng hóa trị
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
Ví dụ một số hợp chất ion:

- Chất được tạo thành nhờ liên kết cộng hóa trị được gọi là chất cộng hóa trị.
Ví dụ một số hợp chất cộng hóa trị:

- Ở điều kiện thường, chất ion thường ở thể rắn, chất cộng hóa trị ở thể rắn, thể lỏng hoặc thể khí.
V. Một số tính chất của chất ion và chất cộng hóa trị
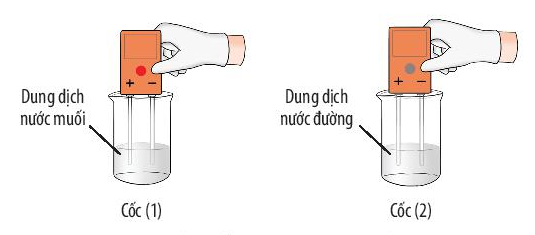
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong nước tạo dung dịch dẫn được điện.
- Chất cộng hóa trị thường dễ bay hơi, kém bền với nhiệt; một số chất tan được trong nước thành dung dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện.
- Ví dụ 1: Dung dịch nước muối dẫn điện còn dung dịch nước đường thì không dẫn điện.
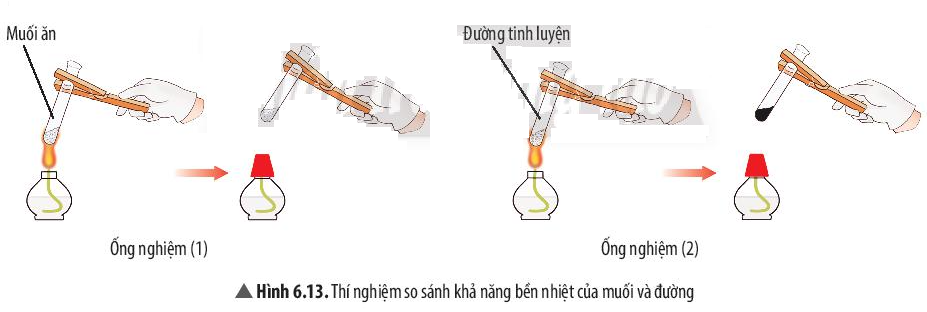
 Ví dụ 2: Đường nóng chảy và biến đổi thành chất khác có màu đen. Muối ăn không bị nóng chảy.
Ví dụ 2: Đường nóng chảy và biến đổi thành chất khác có màu đen. Muối ăn không bị nóng chảy.
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên 7 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 7: Hóa trị và công thức hóa học
Lý thuyết Bài 8: Tốc độ chuyển động
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Chân trời sáng tạo
- Giải sbt Toán 7 – Chân trời sáng tạo
- Lý thuyết Toán 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Chân trời sáng tạo
- Soạn văn lớp 7 (ngắn nhất) – Chân trời sáng tạo
- Văn mẫu lớp 7 – Chân trời sáng tạo
- Giải sgk Lịch sử 7 – Chân trời sáng tạo
- Lý thuyết Lịch Sử 7 – Chân trời sáng tạo
- Giải sbt Lịch sử 7 – Chân trời sáng tạo
- Giải sgk Địa lí 7 – Chân trời sáng tạo
- Lý thuyết Địa Lí 7 – Chân trời sáng tạo
- Giải sbt Địa lí 7 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 7 Friend plus – Chân trời sáng tạo
- Giải sbt Tiếng Anh 7 Friend plus– Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 7 Friends plus đầy đủ nhất
- Bài tập Tiếng Anh 7 Friends plus theo Unit có đáp án
- Giải sgk Giáo dục công dân 7 – Chân trời sáng tạo
- Lý thuyết Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sbt Giáo dục công dân 7 – Chân trời sáng tạo
- Giải sgk Công nghệ 7 – Chân trời sáng tạo
- Lý thuyết Công nghệ 7 – Chân trời sáng tạo
- Giải sbt Công nghệ 7 – Chân trời sáng tạo
- Giải sgk Tin học 7 – Chân trời sáng tạo
- Lý thuyết Tin học 7 – Chân trời sáng tạo
- Giải sbt Tin học 7 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 7 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 7 – Chân trời sáng tạo
- Giải sgk Âm nhạc 7 – Chân trời sáng tạo
