Lý thuyết Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học - Cánh diều
Tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học ngắn gọn, chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Khoa học tự nhiên 7.
Lý thuyết Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được xếp theo nguyên tắc sau:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
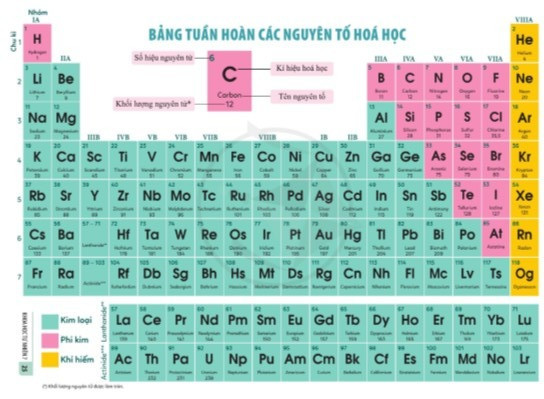
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
1. Ô nguyên tố
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
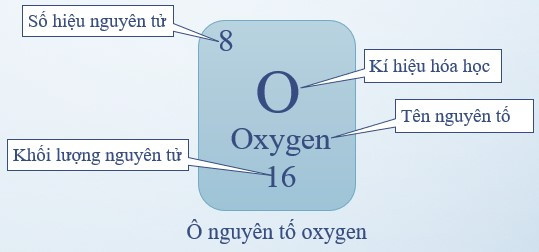
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (kí hiệu là Z): bằng số đơn vị điện tích hạt nhân (bằng số proton và bằng số electron) và là số thứ tự của nguyên tố
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
Ví dụ: Ô nguyên tố oxygen
2. Chu kì
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự của chu kì = số lớp electron của nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ chu kì 1 đến chu kì 7.
- Trong một chu kì, khi đi từ trái qua phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1).
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7).
+ Kết thúc chu kì là một khí hiếm.
- Ví dụ: Trong chu kì 4:
+ Mở đầu chu kì là nguyên tố potassium (K) – là một kim loại điển hình
+ Cuối chu kì là nguyên tố bromine (Br) – là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố krypton (Kr) – là một khí hiếm
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột gồm:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B: gọi kà nhóm các nguyên tố kim loại chuyển tiếp (trong phạm vi chương trình chỉ nghiên cứu 8 nhóm A).
- Nhóm A được đánh số bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
- Số thứ tự của nhóm A = số electron lớp ngoài cùng.
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H); đều có 1 electron ở lớp ngoài cùng.
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts); đều có 7 electron ở lớp ngoài cùng.
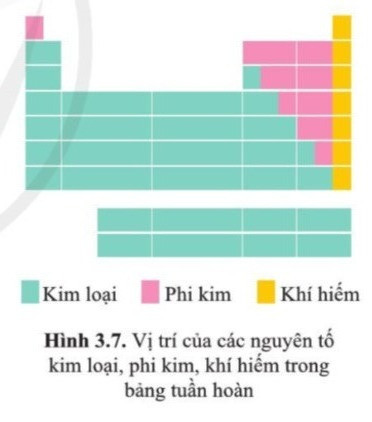
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
IV. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn cho biết:
- Các thông tin của một nguyên tố hóa học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hóa học, khối lượng nguyên tử.
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm). Từ đó nhận ra được các nguyên tố kim loại, phi kim hay khí hiếm:
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố nhóm VIIIA là khí hiếm.
Ví dụ: Bảng tuần hoàn cho biết nguyên tố bromine (Br) ở ô số 35, chu kì 4, nhóm VIIA, là nguyên tố phi kim.
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên 7 sách Cánh diều hay, chi tiết khác:
Lý thuyết Bài 4: Phân tử, đơn chất, hợp chất
Lý thuyết Bài 5: Giới thiệu về liên kết hóa học
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Cánh Diều
- Giải sbt Toán 7 – Cánh Diều
- Lý thuyết Toán 7 – Cánh Diều
- Giải VBT Toán 7 – Cánh diều
- Soạn văn lớp 7 (hay nhất)– Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Giải sbt Ngữ văn lớp 7 – Cánh Diều
- Văn mẫu lớp 7 – Cánh Diều
- Soạn văn lớp 7 (ngắn nhất) – Cánh Diều
- Giải VBT Ngữ văn lớp 7 – Cánh diều
- Giải sgk Tiếng Anh 7 - Explore English
- Giải sgk Tiếng Anh 7 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 7 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 i-learn Smart World
- Bài tập Tiếng Anh 7 iLearn Smart World theo Unit có đáp án
- Giải sbt Tiếng Anh 7 - ilearn Smart World
- Giải sgk Lịch sử 7 – Cánh Diều
- Lý thuyết Lịch Sử 7 – Cánh Diều
- Giải sbt Lịch sử 7 – Cánh Diều
- Giải VBT Lịch sử 7 – Cánh diều
- Giải sgk Địa lí 7 – Cánh Diều
- Lý thuyết Địa Lí 7 – Cánh Diều
- Giải sbt Địa lí 7 – Cánh Diều
- Giải VBT Địa lí 7 – Cánh diều
- Giải sgk Tin học 7 – Cánh Diều
- Lý thuyết Tin học 7 – Cánh Diều
- Giải sbt Tin học 7 – Cánh Diều
- Giải sgk Giáo dục công dân 7 – Cánh Diều
- Lý thuyết Giáo dục công dân 7 – Cánh Diều
- Giải sbt Giáo dục công dân 7 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sgk Công nghệ 7 – Cánh Diều
- Lý thuyết Công nghệ 7 – Cánh Diều
- Giải sbt Công nghệ 7 – Cánh Diều
- Giải sgk Giáo dục thể chất 7 – Cánh Diều
- Giải sgk Âm nhạc 7 – Cánh Diều
