Lý thuyết Khoa học tự nhiên 7 Bài 1: Nguyên tử - Cánh diều
Tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Bài 1: Nguyên tử ngắn gọn, chi tiết sách Cánh diều sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Khoa học tự nhiên 7.
Lý thuyết Khoa học tự nhiên 7 Bài 1: Nguyên tử
I. Nguyên tử là gì?
Nguyên tử là những hạt cực kì nhỏ bé, không mang điện, cấu tạo nên chất.
Ví dụ:
- Kim cương, than chì đều được cấu tạo từ các nguyên tử carbon.

- Nước được tạo nên từ các nguyên tử hydrogen và oxygen.

II. Cấu tạo nguyên tử
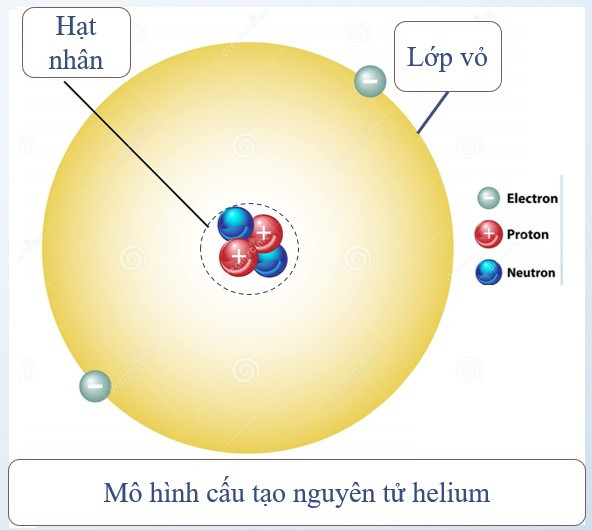
Nguyên tử được coi như một quả cầu, gồm hạt nhân nguyên tử và vỏ nguyên tử.
1. Vỏ nguyên tử
- Vỏ nguyên tử được tạo bởi một hay nhiểu electron chuyển động xung quanh hạt nhân.
- Electron: kí hiệu: e; mỗi hạt electron mang điện tích -1.
2. Hạt nhân nguyên tử
- Vị trí: nằm ở tâm của nguyên tử.
- Kích thước: rất nhỏ so với nguyên tử.
- Thành phần: gồm proton và neutron.
+ Proton: kí hiệu: p; mỗi proton mang điện tích +1.
+ Neutron: kí hiệu: n; không mang điện.
- Điện tích hạt nhân nguyên tử = tổng điện tích các proton.
- Số đơn vị điện tích hạt nhân = số proton.
Ví dụ: Nguyên tử helium gồm hạt nhân có 2 proton, 2 neutron và vỏ nguyên tử có 2 electron.
Điện tích hạt nhân = tổng điện tích các proton = 2.(+1) = +2
Số đơn vị điện tích hạt nhân = số proton = 2
Chú ý:
Số proton = số electron ⇒ Nguyên tử trung hòa về điện
III. Sự chuyển động của electron trong nguyên tử
- Mô hình nguyên tử của Rơ-dơ-pho – Bo:
+ Electron chuyển động trên những quỹ đạo xác định xung quanh hạt nhân.
+ Electron phân bố trên các lớp electron theo chiều từ gần hạt nhân ra ngoài.
+ Số electron tối đa trên mỗi lớp được xác định, như lớp thứ nhất có tối đa 2 electron, lớp thứ hai có tối đa 8 electron,…
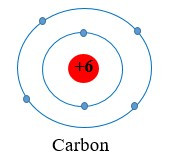
Ví dụ 1: Nguyên tử carbon có 6 electron, được phân bố thành hai lớp:
+ Lớp thứ nhất (lớp gần hạt nhân nhất) có 2 electron.
+ Lớp thứ hai có 4 electron.
Ta nói carbon có 4 electron ở lớp ngoài cùng.
Mở rộng: Trong số các nguyên tử đã biết hiện nay, nguyên tử có kích thước lớn nhất là francium, có chứa 7 lớp electron. Nguyên tử helium có kích thước nhỏ nhất với 1 lớp electron.
IV. Khối lượng của nguyên tử
- Nguyên tử có khối lượng rất nhỏ. Một gam của bất kì chất nào cũng chứa tới hàng tỉ tỉ nguyên tử.
- Đơn vị đo khối lượng nguyên tử: amu (atomic mass unit)
1 amu = 1,6605. 10-24 g.
- Khối lượng của một nguyên tử = khối lượng của proton + khối lượng của neutron + khối lượng của electron.
Tuy nhiên, do khối lượng của electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu).
Nên có thể coi khối lượng của một nguyên tử bằng khối lượng hạt nhân (hay bằng tổng khối lượng của proton và neutron).
Ví dụ:
- Nguyên tử sulfur có 16 proton và 16 neutron, nên khối lượng của một nguyên tử sulfur là: 16.1 + 16.1 = 32 (amu)
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên 7 sách Cánh diều hay, chi tiết khác:
Lý thuyết Bài 2: Nguyên tố hóa học
Lý thuyết Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Lý thuyết Bài 4: Phân tử, đơn chất, hợp chất
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Cánh Diều
- Giải sbt Toán 7 – Cánh Diều
- Lý thuyết Toán 7 – Cánh Diều
- Giải VBT Toán 7 – Cánh diều
- Soạn văn lớp 7 (hay nhất)– Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Giải sbt Ngữ văn lớp 7 – Cánh Diều
- Văn mẫu lớp 7 – Cánh Diều
- Soạn văn lớp 7 (ngắn nhất) – Cánh Diều
- Giải VBT Ngữ văn lớp 7 – Cánh diều
- Giải sgk Tiếng Anh 7 - Explore English
- Giải sgk Tiếng Anh 7 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 7 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 i-learn Smart World
- Bài tập Tiếng Anh 7 iLearn Smart World theo Unit có đáp án
- Giải sbt Tiếng Anh 7 - ilearn Smart World
- Giải sgk Lịch sử 7 – Cánh Diều
- Lý thuyết Lịch Sử 7 – Cánh Diều
- Giải sbt Lịch sử 7 – Cánh Diều
- Giải VBT Lịch sử 7 – Cánh diều
- Giải sgk Địa lí 7 – Cánh Diều
- Lý thuyết Địa Lí 7 – Cánh Diều
- Giải sbt Địa lí 7 – Cánh Diều
- Giải VBT Địa lí 7 – Cánh diều
- Giải sgk Tin học 7 – Cánh Diều
- Lý thuyết Tin học 7 – Cánh Diều
- Giải sbt Tin học 7 – Cánh Diều
- Giải sgk Giáo dục công dân 7 – Cánh Diều
- Lý thuyết Giáo dục công dân 7 – Cánh Diều
- Giải sbt Giáo dục công dân 7 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sgk Công nghệ 7 – Cánh Diều
- Lý thuyết Công nghệ 7 – Cánh Diều
- Giải sbt Công nghệ 7 – Cánh Diều
- Giải sgk Giáo dục thể chất 7 – Cánh Diều
- Giải sgk Âm nhạc 7 – Cánh Diều
