Lý thuyết Liên kết ion – Hóa 10 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa học lớp 10 Bài 9: Liên kết ion ngắn gọn, chi tiết sách Chân trời sáng tạo với cuộc sống sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 9: Liên kết ion
Bài giảng Hóa học 10 Bài 9: Liên kết ion
A. Lý thuyết Liên kết ion
I. Ion và sự hình thành liên kết ion
1. Sự tạo thành ion
- Khi nhường electron, nguyên tử trở thành ion dương (cation)
Ví dụ:
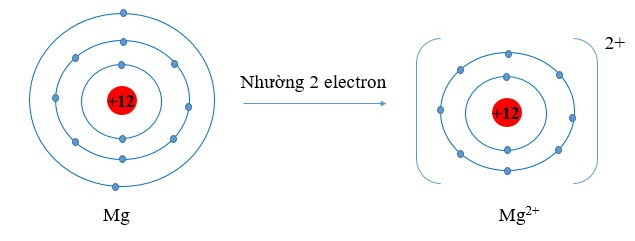
Viết gọn: Mg → Mg2+ + 2e
- Khi nhận electron, nguyên tử trở thành ion âm (anion)
Ví dụ:
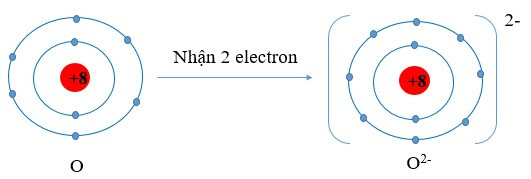
Viết gọn: O + 2e → O2-
Chú ý: Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tưr nhường hoặc nhận.
2. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
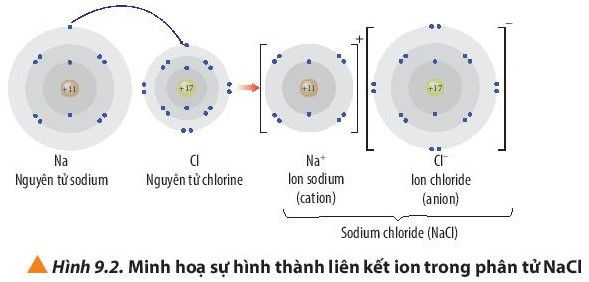
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
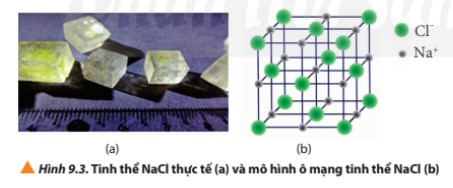
II. Tinh thể ion
- Tinh thể ion là hợp chất ion ở dạng rắn. Chúng gồm các ion liên kết với nhau bằng lực hút tĩnh điện tạo thành một mạng tinh thể.
- Ô mạng tinh thể là đơn vị nhỏ nhất của mạng tinh thể, hiển thị cấu trúc không gian ba chiều của toàn bộ tinh thể.
- Tinh thể của một chất có thể xem là một ô mạng lặp đi lặp lại trong không gian ba chiều.
- Do các hợp chất ion có cấu trúc tinh thể nên trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
Ví dụ: NaCl là hợp chất ion phổ biến. Trong điều kiện thường, hợp chất này tồn tại dưới dạng tinh thể rắn, cứng, dễ tan trong nước và có nhiệt độ nóng chảy cao.
B. Trắc nghiệm Liên kết ion
Câu 1. Liên kết ion thường được hình thành khi
A. kim loại điển hình tác dụng với phi kim điển hình
B. 2 phi kim điển hình tác dụng với nhau
C. kim loại điển hình tác dụng với khí hiếm
D. phi kim điển hình tác dụng với khí hiếm
Đáp án đúng là: A
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
Câu 2. Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa
A. cation K2+ và anion Cl2−
B. cation K+ và anion Cl−
C. cation Cl+ và anion K−
D. cation Cl2+ và anion K2−
Đáp án đúng là: B
K (Z = 19): [Ar]4s1⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để trở thành caction K+
Cl (Z = 17): [Ne]3s23p5⇒ có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để trở thành anion Cl−
Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa cation K+ và anion Cl−.
Câu 3. Phát biểu nào sau đây là đúng?
A. Liên kết ion chỉ có trong đơn chất
B. Liên kết ion chỉ có trong hợp chất
C. Liên kết ion có cả trong đơn chất và hợp chất
D. Cả A, B, và C đều sai.
Đáp án đúng là: B
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa ion dương (hình thành từ kim loại) và ion âm (hình thành từ phi kim).
⇒ Phân tử chứa liên kết ion được hình thành từ kim loại và phi kim điển hình.
⇒ Liên kết ion chỉ có trong hợp chất.
Câu 4. Quá trình hình thành liên kết ion trong phân tử MgO là
A. Mg ⟶ Mg2+ + 2e; O + 2e ⟶ O2−; Mg2+ + O2−⟶ MgO
B. Mg ⟶ Mg+ + 1e; O + 1e ⟶ O−; Mg+ + O−⟶ MgO
C. O ⟶ O2+ + 2e; Mg + 2e ⟶ Mg2−; O2+ + Mg2−⟶ MgO
D. O ⟶ O+ + 1e; Mg + 1e ⟶ Mg−; O+ + Mg−⟶ MgO
Đáp án đúng là: A
Mg (Z = 12): [Ne]3s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
O (Z = 8): [He]2s22p4 có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
Mg⟶Mg2+ + 2e
[Ne]3s2 [Ne]
O+ 2e ⟶ O2−
[He]2s22p4 [Ne]
Mg2+ + O2−⟶ MgO
Câu 5. Khẳng định đúng là
A. Khi nhường electron, nguyên tử trở thành ion dương (cation)
B. Khi nhận electron, nguyên tử trở thành ion âm (anion)
C. Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận
D. Cả A, B và C đều đúng.
Đáp án đúng là: D
Khi nhường electron, nguyên tử trở thành ion dương (cation)
Khi nhận electron, nguyên tử trở thành ion âm (anion)
Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận.
Câu 6. Quá trình hình thành liên kết ion trong phân tử CaCl2 là
A. Ca ⟶ Ca2+ + 2e; Cl + 2e ⟶ Cl2−; Ca2+ + Cl2−⟶ CaCl2
B. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + Cl−⟶ CaCl2
C. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + 2Cl−⟶ CaCl2
D. Ca ⟶ Ca+ + 1e; Cl + 2e ⟶ Cl2−; Ca+ + Cl2−⟶ CaCl2
Đáp án đúng là: C
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
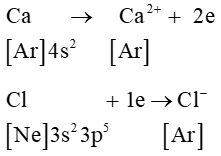
Ca2+ + 2Cl−⟶ CaCl2
Câu 7. Ion Al3+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Đáp án đúng là: B
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
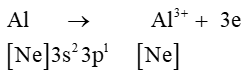
Câu 8. Cho các ion sau: Ca2+, F-, Al3+ và P3−. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Đáp án đúng là: B
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của Ca2+ là: [Ar]
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của F− là: [Ne]
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của Al3+ là: [Ne]
P (Z = 15): [Ne]3s23p3 có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của P3− là: [Ar]
Vậy có 2 ion có cấu hình electron của khí hiếm neon.
Câu 9. So sánh nào dưới đây là đúng?
A. Bán kính nguyên tử Ca bằng bán kính ion Ca2+
B. Bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
C. Bán kính nguyên tử Ca nhỏ hơn bán kính ion Ca2+
D. Bán kính nguyên tử Ca lớn hơn hoặc bằng bán kính ion Ca2+
Đáp án đúng là: B
Nguyên tử Ca (Z = 20): [Ar]4s2 có 4 lớp electron.
Ca ⟶ Ca2+ + 2e
Ion Ca2+ (Z = 20): [Ar] có 3 lớp electron.
Do đó bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
Câu 10. Hợp chất nào dưới đây là hợp chất ion?
A. NaCl
B. N2
C. H2O
D. CO2
Đáp án đúng là: A
Hợp chất ion là hợp chất được hình thành từ kim loại điển hình với phi kim điển hình.
Na là kim loại điển hình, Cl là phi kim điển hình ⇒ NaCl là hợp chất ion.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 10: Liên kết cộng hóa trị
Lý thuyết Bài 11: Liên kết hydrogen và tương tác van der waals
Lý thuyết Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Lý thuyết Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
