Lý thuyết Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học – Hóa 10 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa học lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học ngắn gọn, chi tiết sách Chân trời sáng tạo với cuộc sống sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài giảng Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
A. Lý thuyết Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
I. Ảnh hưởng của nồng độ
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
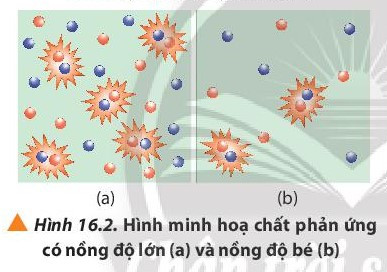
Chú ý: Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng, gọi là va chạm hiệu quả.
Ví dụ: Phản ứng hóa học: Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Nồng độ Na2S2O3 giảm ⇒ Các hạt phân tử Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
II. Ảnh hưởng của nhiệt độ
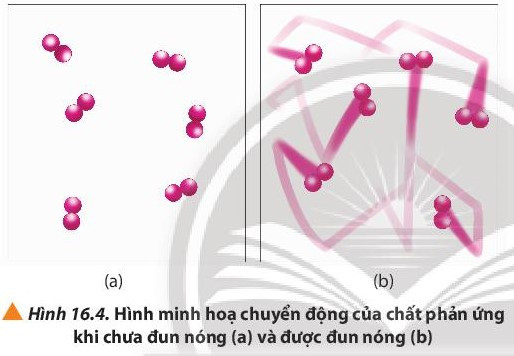
- Khi tăng nhiệt độ, tốc độ phản ứng tăng.
- Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ; các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
- Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức:
Trong đó:
+ là tốc độ phản ứng ở hai nhiệt độ t1 và t2;
+ γ là hệ số nhiệt độ Van’t Hoff.
Chú ý: Quy tắc Van’t Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
III. Ảnh hưởng của áp suất
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
- Giải thích: Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.

IV. Ảnh hưởng của bề mặt tiếp xúc
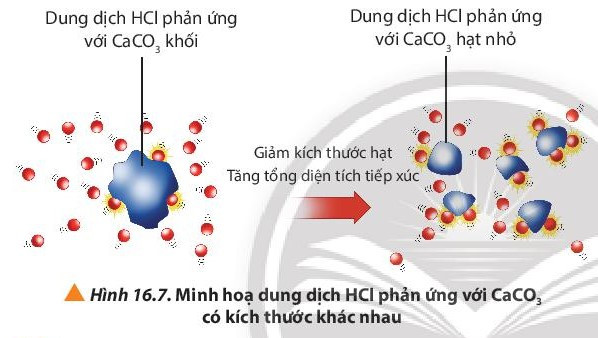
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Khi tăng diện tích tiếp xúc của chất phản ứng, số va chạm hiệu quả tăng dẫn đến tốc độ phản ứng tăng.
- Ví dụ: Thực hiện các thí nghiệm sau:
+ Thí nghiệm 1: Cho 2 gam CaCO3 dạng khối tác dụng với 20 ml HCl 1M;
+ Thí nghiệm 2: Cho 2 gam CaCO3 dạng bột tác dụng với 20 ml HCl 1M.
Khi HCl phản ứng với CaCO3 dạng bột, diện tích tiếp xúc giữa các phân tử HCl và CaCO3 tăng lên
⇒ Số va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.
⇒ Ở thí nghiệm 2 phản ứng diễn ra nhanh hơn.
V. Ảnh hưởng của chất xúc tác
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
- Chất xúc tác được ghi trên mũi tên trong phương trình hóa học.
Ví dụ 1: Phương trình hóa học của phản ứng:
2H2O2 (aq) 2H2O (l) + O2 (g)
Trong phản ứng trên MnO2 là chất xúc tác.
Ví dụ 2: Enzyme amylase có trong nước bọt là chất xúc tác đẩy nhanh quá trình tiêu hóa tinh bột.
VI. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
- Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.
Ví dụ:
+ Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ Tăng tốc độ phản ứng cháy
+ Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.

B. Trắc nghiệm Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Câu 1. Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức
A. =
B. =
C. =
D. =
Đáp án đúng là: A
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức: =
Trong đó, và là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; γ là hệ số nhiệt độ Van’t Hoff.
Câu 2. Kết luận nào sau đây sai?
A. Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng;
B. Khi tăng nhiệt độ, tốc độ phản ứng tăng;
C. Đối với tất cả các phản ứng, tốc độ phản ứng tăng khi áp suất tăng;
D. Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
Đáp án đúng là: C
Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi áp suất tăng.
Do đó kết luận C sai.
Câu 3. Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là
A. chất xúc tác;
B. chất ban đầu;
C. chất sản phẩm;
D. Cả A, B và C đều sai.
Đáp án đúng là: A
Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là chất xúc tác.
Câu 4. Tốc độ phản ứng phụ thuộc vào các yếu tố
A. nồng độ, áp suất
B. nhiệt độ
C. chất xúc tác, diện tích bề mặt
D. Cả A, B và C
Đáp án đúng là: D
Tốc độ phản ứng phụ thuộc vào các yếu tố: nồng độ, áp suất, nhiệt độ, chất xúc tác, diện tích bề mặt.
Câu 5. Khi đốt than trong lò, đậy nắp lò sẽ giữ than cháy được lâu hơn.
Yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng trong ví dụ trên là
A. nhiệt độ;
B. nồng độ;
C. chất xúc tác;
D. diện tích bề mặt tiếp xúc.
Đáp án đúng là: B
Yếu tố nồng độ.
Đậy nắp lò sẽ làm giàm nồng độ oxygen tham gia phản ứng đốt cháy than, do đó tốc độ phản ứng giảm nên than cháy được lâu hơn.
Câu 6. Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?
A. Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn;
B. Quạt gió vào bếp than để thanh cháy nhanh hơn;
C. Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh;
D. Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể.
Đáp án đúng là: C
Thanh củi được chẻ nhỏ hơn thì sẽ cháy nhanh hơn ⇒ tăng diện tích bề mặt của củi ⇒ Yếu tố diện tích tiếp xúc.
Quạt gió vào bếp than để than cháy nhanh hơn ⇒ tăng nồng độ oxygen cho phản ứng cháy ⇒ Yếu tố nồng độ.
Thức ăn lâu bị ôi thiu hơn khi để trong tủ lạnh ⇒ giảm nhiệt độ để các phản ứng phân hủy diễn ra chậm hơn ⇒ Yếu tố nhiệt độ.
Các enzyme làm thúc đẩy các phản ứng sinh hóa trong cơ thể ⇒ enzyme là chất xúc tác sinh học. ⇒ Yếu tố xúc tác.
Câu 7. Cho phản ứng: 2CO (g) + O2 (g) ⟶ 2CO2 (g)
Với hệ số nhiệt độ Van’t Hoff . Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A. tăng gấp 2 lần;
B. tăng gấp 8 lần;
C. giảm 4 lần;
D. tăng gấp 6 lần.
Đáp án đúng là: B
Ta có: = ⇒ = = 23 = 8
⇒ Tốc độ phản ứng tăng gấp 8 lần.
Câu 8. Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.
Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
A. Nồng độ;
B. Nhiệt độ;
C. Diện tích bề mặt tiếp xúc;
D. Chất xúc tác.
Đáp án đúng là: A
Khi cho tàn đóm vào bình oxygen nguyên ⇒ nồng độ oxygen tăng cao (vì oxygen nguyên chất có nồng độ cao hơn oxygen trong không khí) ⇒ nồng độ oxi tăng làm cho tốc độ phản ứng tăng ⇒ tàn đóm đỏ bùng cháy.
Câu 9. Người ta vận dụng yếu tố nào để tăng tốc độ phản ứng trong trường hợp sau: Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
A. Nồng độ;
B. Nhiệt độ;
C. Áp suất;
D. Chất xúc tác.
Đáp án đúng là: B
Nung ở nhiệt độ cao để tốc độ phản ứng sản xuất xi măng xảy ra nhanh ⇒ vận dụng yếu tố nhiệt độ để tăng tốc độ phản ứng.
Câu 10. Phản ứng trong thí nghiệm nào dưới đây có tốc độ lớn nhất?
A. a gam Zn (hạt) + dung dịch HCl 0,2M ở 30°C;
B. a gam Zn (bột) + dung dịch HCl 0,2M ở 30°C;
C. a gam Zn (hạt) + dung dịch HCl 0,2M ở 40°C;
D. a gam Zn (bột) + dung dịch HCl 0,2M ở 40°C.
Đáp án đúng là: D
Zn (s) + 2HCl (aq) ⟶ ZnCl2 (aq) + H2 (g)
Cùng 1 lượng Zn thì Zn dạng bột sẽ có diện tích tiếp xúc bề mặt lớn hơn nên tốc độ phản ứng sẽ nhanh hơn.
Nhiệt độ càng cao thì tốc độ phản ứng càng nhanh, do đó ở nhiệt độ 40°C tốc độ phản ứng cao hơn ở 30°C.
Vậy thí nghiệm a gam Zn (bột) + dd HCl 0,2M ở 40°C sẽ có tốc độ phản ứng lớn nhất.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Lý thuyết Bài 18: Hydrogen halide và một số phản ứng của ion halide
Lý thuyết Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
