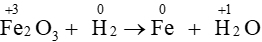Lý thuyết Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống – Hóa 10 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa học lớp 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống ngắn gọn, chi tiết sách Chân trời sáng tạo với cuộc sống sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài giảng Hóa học 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
A. Lý thuyết Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
I. Số oxi hóa
1. Tìm hiểu về số oxi hóa
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Ví dụ: Giả định nếu cặp electron chung trong hợp chất cộng hóa trị HCl lệch hẳn về phía nguyên tử Cl khi đó có thể coi Cl nhận 1 electron và H nhường 1 electron.
⇒ Cl mang điện tích -1 và H mang điện tích +1.
⇒ Ta nói số oxi hóa của Cl là -1, của H là +1.
- Cách biểu diễn số oxi hóa: Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
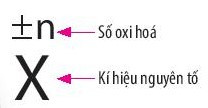
Ví dụ: +1H−1Cl; +2Mg−2O...
2. Xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Quy tắc xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
- Quy tắc 1: Số oxi hóa của nguyên tử trong các đơn chất bằng 0.
Ví dụ:
- Quy tắc 2: Trong một phân tử, tổng số oxi hóa của các nguyên tử bằng 0.
Ví dụ: Tổng số oxi hóa của các nguyên tử trong phân tử NH3 là: (-3) × 1 + 3 × (+1) = 0.
- Quy tắc 3: Trong các ion, số oxi hóa của nguyên tử (đối với ion đơn nguyên tử) hay tổng số oxi hóa các nguyên tử (đối với các ion đa nguyên tử) bằng điện tích của ion đó.
Ví dụ: Số oxi hóa của nguyên tử Na trong ion Na+ là +1.
Trong ion HSO4- tổng số oxi hóa của các nguyên tử: 1.(+1) + 1.(+6) + 4.(-2) = -1
- Quy tắc 4: Trong đa số các hợp chất, số oxi hóa của hydrogen là +1, trừ các hydride kim loại như NaH, CaH2 …. Số oxi hóa của oxygen bằng -2, trừ OF2 và các peroxide; superoxide (như H2O2; Na2O2; KO2 …). Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1; kim loại kiềm thổ (nhóm IIA) có số oxi hóa +2. Nhôm có số oxi hóa +3. Số oxi hóa của các nguyên tử nguyên tố fluorine trong các hợp chất bằng -1.
|
Xác định số oxi hóa |
Số oxi hóa |
|
Đơn chất |
0 |
|
Phân tử |
Tổng số oxi hóa của các nguyên tử bằng 0 |
|
Ion đơn nguyên tử |
Bằng điện tích của ion |
|
Ion đa nguyên tử |
Tổng số oxi hóa các nguyên tử bằng điện tích ion |
|
Ion fluorine |
-1 |
|
Oxygen trong hợp chất (trừ OF2 và các peroxide, superoxide) |
-2 |
|
Hydrogen trong hợp chất (trừ các hydride) |
+1 |
II. Phản ứng oxi hóa – khử
- Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay phản ứng có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử.
- Chất khử (hay chất bị oxi hóa) là chất nhường electron hay chất có số oxi hóa tăng lên sau phản ứng.
- Chất oxi hóa (hay chất bị khử) là chất nhận electron hay chất có số oxi hóa giảm xuống sau phản ứng.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron.
- Quá trình khử (sự khử) là quá trình nhận electron.
- Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời sự oxi hóa và sự khử.
Ví dụ: Xét phương trình hóa học:
+ ion S2- nhường electron (số oxi hóa tăng) nên là chất khử.
+ Br nhận electron nên là chất oxi hóa.
+ Quá trình nhường electron là quá trình oxi hóa:
+ Quá trình nhận electron là quá trình khử:
Chú ý:
+ Chất oxi hóa mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa cao (như ) hoặc đơn chất của các nguyên tố có độ âm điện lớn (như F2, O2, Cl2, Br2, …)
+ Chất khử mạnh thường là các hợp chất chứa nguyên tử của các nguyên tố có số oxi hóa thấp (như ) hoặc đơn chất kim loại (như kim loại kiềm, kiềm thổ, …)
+ Chất chứa nguyên tử của nguyên tố có số oxi hóa trung gian (như thì tùy thuộc vào điều kiện phản ứng (tác nhân và môi trường) mà thể hiện tính khử hoặc tính oxi hóa hoặc cả hai (vừa tính oxi hóa, vừa tính khử hay tự oxi hóa – khử).
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
- Có nhiều phương pháp lập phương trình hóa học của phản ứng oxi hóa – khử. Phương pháp thông dụng hiện nay là thăng bằng electron.
- Nguyên tắc:
Tổng số electron chất khử nhường = Tổng số electron chất oxi hóa nhận.
- Các bước lập phương trình hóa học của phản ứng oxi hóa - khử theo phương pháp thăng bằng electron:
+ Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử.
+ Bước 2: Viết quá trình oxi hóa, quá trình khử.
+ Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron do chất khử nhường bằng tổng số electron chất oxi hóa nhận.
+ Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử các nguyên tố còn lại.
Ví dụ:
Lập phương trình hóa học của phản ứng KMnO4 + HCl → KCl + MnCl2 + Cl↑ + H2O theo phương pháp thăng bằng electron.
Bước 1:
Chất khử: HCl
Chất oxi hóa: KMnO4
Bước 2:
Quá trình oxi hóa:
Quá trình khử:
Bước 3:
Bước 4: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
IV. Ý nghĩa của phản ứng oxi hóa – khử
- Một số phản ứng oxi hóa – khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng, dầu trong các động cơ đốt trong; các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy …

- Một số phản ứng oxi hóa – khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng; sản xuất các hóa chất cơ bản; sản xuất phân bón; thuốc bảo vệ thực vật; dược phẩm …

B. Trắc nghiệm Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Câu 1. Cho nguyên tố X có số oxi hóa có giá trị là -2. Cách biểu diễn đúng là
A. ;
B. ;
C.
D. .
Đáp án đúng là: D
Cách biểu diễn số oxi hóa:
+ Số oxi hóa được đặt ở phía trên kí hiệu nguyên tố.
+ Dấu điện tích được đặt ở phía trước, số ở phía sau.
Do đó, nguyên tố X có số oxi hóa có giá trị là âm 2 được biểu diễn là:
Câu 2. Số oxi hóa của các nguyên tử trong H2, Fe2+, Cl- lần lượt là
A. 0; −2; +1;
B. +2; −2; +1;
C. 0; +2; −1;
D. +1; +2; −1.
Đáp án đúng là: C
Ta có: số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0. Do đó số oxi hóa của H trong H2 là 0.
Trong ion, số oxi hóa của nguyên tử bằng điện tích của ion. Do đó:
Fe2+ có điện tích là 2+ nên Fe có số oxi hóa là +2.
Cl− có điện tích là 1− nên Cl có số oxi hóa là −1.
Câu 3. Phát biểu nào sau đây sai khi nói về số oxi hóa trong hợp chất?
A. Số oxi hóa của H là +1 (trừ một số hydride kim loại NaH, CaH2, …);
B. Số oxi hóa của O luôn là –2;
C. Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, …) luôn là +1, của kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, …) luôn là +2;
D. Số oxi hóa của Al luôn là +3, của F luôn là –1.
Đáp án đúng là: B
Trong hợp chất, số oxi hóa của O thường là –2 (trừ một số trường hợp như OF2, H2O2, …)
Vậy phát biểu B là sai.
Câu 4. Số oxi hóa của một nguyên tử trong phân tử được định nghĩa là
A. điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn;
B. hóa trị của nguyên tử nguyên tố đó;
C. điện tích thực của nguyên tử nguyên tố đó;
D. độ âm điện của nguyên tử nguyên tố đó.
Đáp án đúng là: A
Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
Câu 5. Số oxi hóa của Mn trong các phân tử MnO2, KMnO4, K2MnO4 lần lượt là
A. +2, +4, +3;
B. −4, +7, +6;
C. +4, +7, +6;
D. +2, +5, +6.
Đáp án đúng là: C
Gọi số oxi hóa của nguyên tử Mn là x, theo quy tắc 1 và 2 về xác định số oxi hóa, ta có:
Trong phân tử MnO2: ⇒ x = +4
Trong phân tử KMnO4: ⇒ x = +7
Trong phân tử K2MnO4: ⇒ x = +6.
Câu 6. Số oxi hóa của nguyên tử N trong các ion NH4+, NO3−, NO2− lần lượt là
A. −3, +5, +3
B. −3, +3, + 5
C. +5, −2, +3
D. +5, +3, +2
Đáp án đúng là: A
Gọi số oxi hóa của nguyên tử N là x, theo quy tắc 1 và 2 về xác định số oxi hóa, ta có:
Trong ion NH4+: ⇒ x = −3
Trong ion NO3−: ⇒ x = +5
Trong ion NO2−: ⇒ x = +3
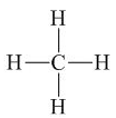
Câu 7. Cho phân tử CH4 công thức cấu tạo dưới đây. Số oxi hóa của C là
A. −4;
B. −2;
C. +4;
D. +2.
Đáp án đúng là: A
Trong mỗi liên kết C−H, H góp 1 electron, khi giả định CH4 là hợp chất ion thì electron này chuyển sang C.
Vì có 4 liên kết C −H nên số oxi hóa của C là −4.
Câu 8. Phát biểu sai là
A. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử;
B. Phản ứng oxi hóa – khử có thể chỉ có quá trình oxi hóa hoặc quá trình khử;
C. Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron;
D. Quá trình khử (sự khử) là quá trình nhận electron.
Đáp án đúng là: B
Phản ứng oxi hóa – khử có thể chỉ có quá trình oxi hóa hoặc quá trình khử là phát biểu sai vì phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử.
Câu 9. Chất khử là chất
A. nhận electron, có số oxi hóa tăng, bị oxi hóa
B. nhận electron, có số oxi hóa giảm, bị khử
C. nhường electron, có số oxi hóa tăng, bị oxi hóa
D. nhường electron, có số oxi hóa giảm, bị khử
Đáp án đúng là: C
Chất khử là chất nhường electron, có số oxi hóa tăng, bị oxi hóa.
Chất oxi hóa là chất nhận electron, có số oxi hóa giảm, bị khử.
Câu 10. Phản ứng nào dưới đây là phản ứng oxi hóa – khử?
A. SO3 + H2O ⟶H2SO4
B. CaCO3CaO + CO2 ↑
C. H2SO4 + Ba(OH)2 ⟶ BaSO4 ↓ + 2H2O
D. Mg + 2HCl ⟶ MgCl2 + H2 ↑
Đáp án đúng là: D
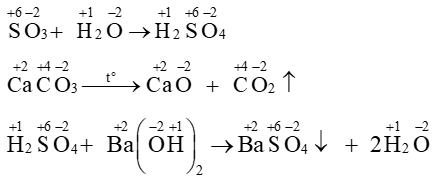
Trong phản ứng không có nguyên tố nào thay đổi số oxi hóa ⇒ không phải phản ứng oxi hóa – khử.
Mg có số oxi hóa tăng từ 0 lên +2; H có số oxi hóa giảm từ +1 về 0. ⇒ Trong phản ứng có 2 nguyên tố thay đổi số oxi hóa. ⇒ Đây là phản ứng oxi hóa – khử.
Câu 11. Cho phản ứng: Fe + CuSO4 ⟶ Cu + FeSO4.
Khẳng định đúng là
A. Chất khử là Cu2+, chất oxi hóa là Fe;
B. Chất khử là Fe, chất oxi hóa là Cu2+;
C. Chất khử là Cu, chất oxi hóa là Fe2+;
D. Chất khử là Fe2+, chất oxi hóa là Cu.
Đáp án đúng là: B
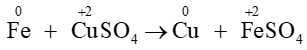
Cu2+ (CuSO4) có số oxi hóa giảm sau phản ứng ⇒ Cu2+ đã nhận electron ⇒ Chất oxi hóa là Cu2+
Fe có số oxi hóa tăng sau phản ứng ⇒ Fe đã nhường electron ⇒ Chất khử là Fe.
Câu 12. Cho phản ứng: 3Cu + 8H+ + 2NO3−⟶3Cu2+ + 2NO + 4H2O
Quá trình khử là
A. ;
B. ;
C. ⟶+ 3e;
D. ⟶+ 2e.
Đáp án đúng là: A
Quá trình khử là quá trình chất oxi hóa nhận electron.
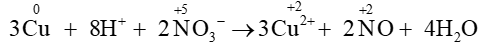
Vậy quá trình khử trong phản ứng: 3Cu + 8H+ + 2NO3−⟶3Cu2+ + 2NO + 4H2O là
+ 3e ⟶
Câu 13. Cho phản ứng: 4P + 5O2⟶ 2P2O5
Quá trình oxi hóa là
A. ⟶+ 5e;
B. + 5e ⟶;
C. + 2e ⟶;
D. ⟶+ 2e.
Đáp án đúng là: A
Quá trình oxi hóa là quá trình chất khử nhường electron.
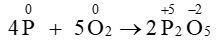
Vậy quá trình oxi hóa của phản ứng 4P + 5O2⟶ 2P2O5 là
⟶+ 5e
Câu 14. Hệ số cân bằng của H2 trong phản ứng Fe2O3 + H2⟶ Fe + H2O là
A. 1;
B. 2;
C. 3;
D. 4.
Đáp án đúng là: C
Sự thay đổi số oxi hóa của các nguyên tố:
Quá trình oxi hóa và quá trình khử:
Áp dụng nguyên tắc: tổng số electron nhường bằng tổng số electron nhận
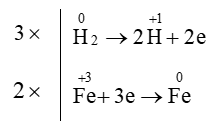
⇒Fe2O3 + 3H2⟶ 2Fe + 3H2O
Câu 15. Xác định hệ số cân bằng của HCl trong phản ứng dưới đây:
K2Cr2O7 + HCl ⟶ Cl2 + KCl + CrCl3 + H2O
A. 5;
B. 10;
C. 14;
D. 16.
Đáp án đúng là: C
Sự thay đổi số oxi hóa của các nguyên tố:
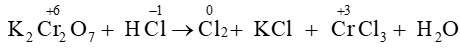
Quá trình oxi hóa và quá trình khử:
Áp dụng nguyên tắc: tổng số electron nhường bằng tổng số electron nhận
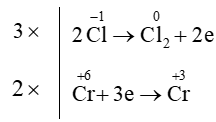
⇒ K2Cr2O7 + 14HCl ⟶3Cl2 + 2KCl + 2CrCl3 + 7H2O.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Lý thuyết Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo