Lý thuyết Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học – Hóa 10 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa học lớp 10 Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học ngắn gọn, chi tiết sách Chân trời sáng tạo với cuộc sống sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Bài giảng Hóa học 10 Bài 7: Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
A. Lý thuyết Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
I. Định luật tuần hoàn
- Sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố cũng như hợp chất của chúng.
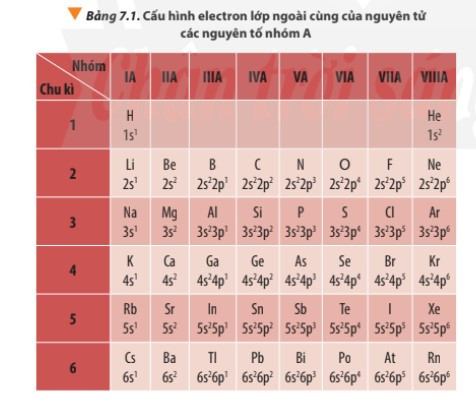
- Định luật tuần hoàn: Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
II. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
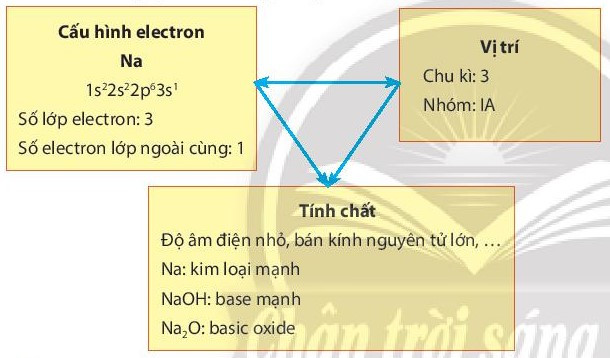
- Khi biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại. Từ đó có thể suy ra những tính chất hóa học cơ bản của nó.
Ví dụ: Mối quan hệ giữa vị trí, cấu hình electron và tính chất của sodium:
B. Trắc nghiệm Định luật tuần hoàn – ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Câu 1. Nguyên tử nguyên tố X có cấu hình e là [Ar] 3d6 4s2. Vị trí của X trong bảng tuần hoàn là:
A. Chu kỳ 3, nhóm VIIIA
B. Chu kỳ 4, nhóm IIB
C. Chu kỳ 4, nhóm IIA
D. Chu kỳ 4, nhóm VIIIB
Đáp án đúng là: D
X có cấu hình electron: [Ar] 3d6 4s2
X có 4 lớp electron ⇒ X ở chu kì 4;
X là nguyên tố d, có 8 electron hóa trị (electron lớp ngoài cùng và phân lớp sát lớp ngoài cùng chưa bão hòa) ⇒ X ở nhóm VIIIB.
Câu 2. Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần
A. khối lượng nguyên tử
B. bán kính nguyên tử
C. số hiệu nguyên tử
D. độ âm điện của nguyên tử.
Đáp án đúng là: C
Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần số hiệu nguyên tử.
Câu 3. Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân của nguyên tử Ca có 20 proton.
D. Nguyên tố Ca là một phi kim
Đáp án đúng là: D
Nguyên tố Ca có số hiệu nguyên tử là 20 ⇒ số electron = số proton = Z = 20 ⇒ A, C đúng.
Z = 20 ⇒ Cấu hình electron nguyên tử là: [Ar]4s2 ⇒ có 4 lớp electron và lớp ngoài cùng có 2 electron ⇒ B đúng.
Có 2 electron lớp ngoài cùng ⇒ nguyên tố kim loại. ⇒ D sai.
Câu 4. Phát biểu đúng về định luật tuần hoàn là
A. Tính chất của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
B. Tính chất của các nguyên tố và đơn chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
C. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của số lớp electron.
D. Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Đáp án đúng là: D
Phát biểu đúng về định luật tuần hoàn là:
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Câu 5. Nguyên tử nguyên tố G có cấu hình electron là [Ne] 3s2 3p4. Vị trí của G trong bảng tuần hoàn là:
A. ô thứ 16, chu kì 3, nhóm VIA;
B. ô thứ 26, chu kì 3, nhóm IVB;
C. ô thứ 16, chu kì 2, nhóm IVA;
D. ô thứ 26, chu kì 3, nhóm VIA.
Đáp án đúng là: A
G có cấu hình electron: [Ne] 3s2 3p4 ⇒ Z = 16
G có Z = 16 ⇒ G ở ô thứ 16;
G có 3 lớp electron ⇒ G ở chu kì 3;
G là nguyên tố p, có 6 electron lớp ngoài cùng ⇒ G ở nhóm VIA
Câu 6. Nguyên tố Y ở chu kì 3, nhóm IA trong bảng tuần hoàn. Tính chất hóa học cơ bản của Y là:
A. kim loại
B. khí hiếm
C. phi kim
D. base
Đáp án đúng là: A
Y ở chu kì 3, nhóm IA trong BTH ⇒ Y là kim loại mạnh.
Câu 7. Y thuộc chu kì 4, nhóm IIA. Công thức oxide và hydroxide cao nhất của Y lần lượt là
A. YO, YOH
B. Y2O, YOH
C. Y2O5, Y(OH)2
D. YO, Y(OH)2
Đáp án đúng là: D
Hóa trị cao nhất của các nguyên tố thuộc nhóm IA đến VIIA (trừ F) = số thứ tự của nhóm.
Y thuộc chu kì 4, nhóm IIA ⇒ Y là kim loại và hóa trị cao nhất của Y là II
Công thức oxide cao nhất là: YO
Công thức hydroxide cao nhất là Y(OH)2
Câu 8. Nguyên tố potassium thuộc ô 19 trong bảng tuần hoàn. Cấu tạo nguyên tử này là
A. Có 19 electron, 4 lớp electron và lớp ngoài cùng có 1 electron
B. Có 20 electron, 4 lớp lớp electron và lớp ngoài cùng có 2 electron
C. Có 19 electron, 3 lớp electron và lớp ngoài cùng có 9 electron
D. Có 19 electron, 1 lớp electron và lớp ngoài cùng có 4 electron
Đáp án đúng là: A
Nguyên tố potassium thuộc ô 19 trong bảng tuần hoàn
⇒ số hiệu nguyên tử Z = số thứ tự của ô nguyên tố = 19.
Z = 19 ⇒ có 19 electron.
Do đó cấu hình electron là: [Ar]4s1
⇒ Có 4 lớp electron và lớp ngoài cùng có 1 electron.
Vậy khẳng định A là khẳng định đúng.
Câu 9. Nguyên tử nguyên tố sulfur (S) có 16 proton. Công thức oxide cao nhất và tính chất của oxide đó là
A. SO2, tính acid oxide
B. SO3, tính acid oxide
C. SO2, tính basic oxide
D. SO3, tính basic oxide
Đáp án đúng là: B
Nguyên tử nguyên tố sulfur (S) có 16 proton ⇒ Z = 16
Cấu hình electron của S: [Ne]3s23p4 ⇒ chu kì 3, nhóm VIA
Hóa trị cao nhất của S = số thứ tự nhóm A = VI ⇒ Công thức oxide cao nhất là: SO3
S có 6 electron lớp ngoài cùng ⇒ S là nguyên tố phi kim ⇒ Oxide có tính acid oxide.
Câu 10. Nguyên tố chlorine ở chu kì 3, nhóm VIIA trong bảng tuần hoàn. Cấu hình electron nguyên tử của chlorine là
A. [Ne]3s23p3
B. [Ar]4s1
C. [Ne]3s23p5
D. [Ne]3s23p7
Đáp án đúng là: C
Nguyên tố chlorine ở chu kì 3 ⇒ có 3 lớp electron và lớp ngoài cùng là lớp thứ 3.
Nhóm VIIA ⇒ nguyên tố p và có 7 electron lớp ngoài cùng ⇒ Cấu hình electron lớp ngoài cùng là: 3s23p5.
⇒ Cấu hình electron: [Ne]3s23p5
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 8: Quy tắc octet
Lý thuyết Bài 10: Liên kết cộng hóa trị
Lý thuyết Bài 11: Liên kết hydrogen và tương tác van der waals
Lý thuyết Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
