Lý thuyết Tính chất vật lí và hóa học các đơn chất nhóm VIIA – Hóa 10 Chân trời sáng tạo
Tóm tắt lý thuyết Hóa học lớp 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA ngắn gọn, chi tiết sách Chân trời sáng tạo với cuộc sống sẽ giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt Hóa học 10.
Lý thuyết Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài giảng Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
A. Lý thuyết Tính chất vật lí và hóa học các đơn chất nhóm VIIA
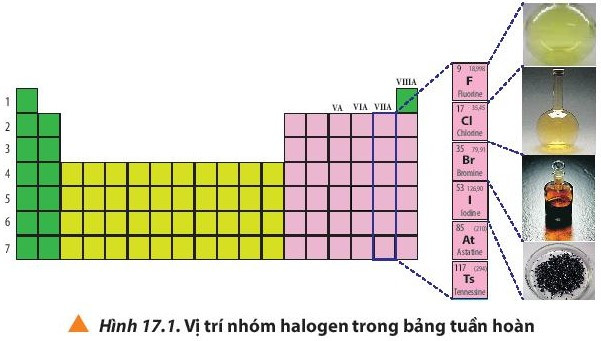
I. Vị trí của nhóm halogen trong bảng tuần hoàn
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
- Trong đó astatine (At) và tennessine (Ts) là các nguyên tố phóng xạ.
II. Trạng thái tự nhiên của các halogen
- Halogen trong tự nhiên không tồn tại ở dạng đơn chất, chủ yếu tồn tại dưới dạng muối của các ion halide (F-, Cl-, Br-, I-).
|
Nguyên tố |
Một số dạng tồn tại trong tự nhiên |
|
Fluoride |
Fluorite (CaF2); fluorapatite (Ca5(PO4)3F) và cryolite (Na3AlF6). |
|
Chloride |
Nước biển, trong quặng halite (NaCl, thường gọi là muối mỏ), sylvite (KCl). |
|
Bromide |
Quặng bromargyrite (AgBr), nước biển, mỏ muối. |
|
Iodide |
Iodargyrite (AgI), nước biển, mỏ muối. |

III. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen. Đặc điểm cấu tạo phân tử halogen
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron: phân lớp s có 2 electron, phân lớp p có 5 electron.
- Để đạt cấu hình electron bền vững giống khí hiếm, hai nguyên tử halogen góp chung một cặp electron để hình thành phân tử.
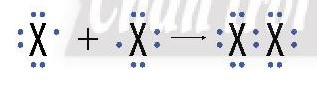
+ Với X là kí hiệu các nguyên tố halogen.
+ Công thức cấu tạo của phân tử halogen: X – X.
Kết luận: Đơn chất halogen tồn tại ở dạng phân tử X2, liên kết trong phân tử là liên kết cộng hóa trị không phân cực.
IV. Tính chất vật lý của các halogen
- Các halogen ít tan trong nước, tan nhiều trong dung môi hữu cơ không phân cực như hexane (C6H14), carbon tetrachloride (CCl4), …
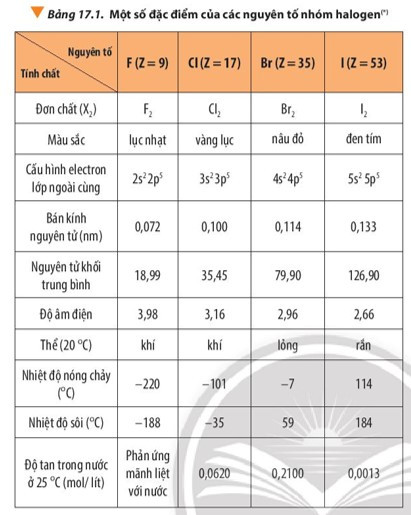
- Từ fluorine đến iodine:
+ Trạng thái tập hợp của đơn chất ở 20oC thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn.
+ Màu sắc đậm dần: fluorine có màu lục nhạt, chlorine có màu vàng lục, bromine có màu nâu đỏ, iodine có màu đen tím.
+ Nhiệt độ nóng chảy và nhiệt độ sôi tăng dần.
- Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi tăng.
V. Tính chất hóa học của các halogen
- Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng.
Sơ đồ tổng quát: X + 1e → X-
- Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
1. Tác dụng với kim loại
- Các halogen phản ứng với kim loại thể hiện các mức độ khác nhau:
+ Fluorine tác dụng được với tất các các kim loại, ví dụ:
2Ag + F2 → 2AgF
+ Chlorine tác dụng với hầu hết các kim loại trừ Au, Pt. Ví dụ:
2Fe + 3Cl2 → 2FeCl3
+ Bromine phản ứng với nhiều kim loại, nhưng khả năng phản ứng yếu so với fluorine và chlorine. Ví dụ:
2Na + Br2 → 2NaBr
+ Iodine phản ứng với kim loại yếu hơn so với bromine, chlorine và fluorine. Ví dụ:
2Al + 3I2 2AlI3

2. Tác dụng với hydrogen
- Khi tác dụng với hydrogen, fluorine phản ứng nổ mạnh ngay cả trong bóng tối, nhiệt độ rất thấp (-252oC)
H2 + F2 → 2HF
- Chlorine phản ứng trong điều kiện chiếu sáng hoặc đun nóng
H2 + Cl2 2HCl
- Bromine phản ứng khi đun nóng 200 – 400oC
H2 + Br2 2HBr
- Iodine phản ứng khó khăn hơn, cần đun nóng 350 – 500oC, chất xúc tác Pt và phản ứng xảy ra thuận nghịch.
H2 + I2 2HI

Mở rộng:
+ Fluorine phản ứng mạnh với nước, bốc cháy trong hơi nước nóng.
2F2 + 2H2O → 4HF + O2↑
+ Chlorine và bromine tác dụng chậm với nước tạo thành hydrohalic acid và hypohalous acid, khả năng phản ứng của bromine khó khăn hơn.
Cl2 + H2O ⇄ HCl + HClO
Br2 + H2O ⇄ HBr + HBrO
+ Iodine phản ứng rất chậm với nước tạo iodic acid
3I2 + 3H2O ⇄ 5HI + HIO3
3. Tác dụng với dung dịch kiềm
- Halogen tác dụng với dung dịch kiềm, sản phẩm tạo thành phụ thuộc vào nhiệt độ phản ứng.
- Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O
Chú ý:
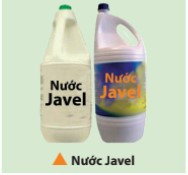
+ Hỗn hợp dung dịch NaCl và NaClO được gọi là nước Javel, có tính oxi hóa mạnh nên được dùng làm chất tẩy màu và sát trùng.
+ Phản ứng của chlorine với dung dịch kiềm được dùng để sản xuất các chất tẩy rửa, sát trùng, tẩy trắng trong ngành dệt, da, bột giấy, …
4. Tác dụng với dung dịch muối halide
- Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Ví dụ:
Cl2 + 2NaBr → 2NaCl + Br2
Br2 + 2NaI → 2NaBr + I2
5. Tính tẩy màu của khí chlorine ẩm
Cl2 + H2O ⇄ HCl + HClO
- Phản ứng giữa chlorine và nước là thuận nghịch nên tạo ra dung dịch gồm nước, hydrochloric acid (HCl); hypoclorous acid (HClO) cùng chlorine.
- Hypoclorous acid (HClO) có tính oxi hóa mạnh có thể phá hủy các hợp chất màu nên khí chlorine ẩm có tính tẩy màu.
- Tính tẩy màu của khí chlorine ẩm được ứng dụng:
+ Tẩy trắng sợi, vải, giấy.
+ Sản xuất chất tẩy rửa.
+ Tiệt trùng nước sinh hoạt, nước trong các bể bơi.
VI. Ứng dụng của các halogen
- Fluorine: Được dùng trong sản xuất các chất dẻo ma sát thấp, như teflon phủ trên chảo chống dính… Một số hợp chất khác của fluorine như cryolite dùng cho sản xuất nhôm; sodium fluorine sử dụng như một loại thuốc trừ sâu, chống gián; một số muối fluorine khác được thêm vào thuốc đánh răng, tạo men răng, …

- Chlorine: Là chất oxi hóa mạnh, được sử dụng làm chất tẩy trắng và khử trùng nước. Một lượng lớn chlorine được dùng để sản xuất các dung môi như carbon tetrachloride (CCl4), chloroform (CHCl3) …

- Bromine: Được dùng để điều chế thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in; silver bromide (AgBr) là chất nhạy với ánh sáng, dùng để tráng phim ảnh, phụ gia chống ăn mòn cho xăng, …

- Iodine: Là nguyên tố vi lượng cần thiết cho dinh dưỡng của con người, thiếu iodine có thể gây nên tác hại cho sức khỏe như gây bệnh bướu cổ, thiểu năng trí tuệ, hỗn hợp ethanol và iodine là chất sát trùng phổ biến. Các hợp chất iodine được sử dụng làm chất xúc tác, dược phẩm và thuốc nhuộm.
B. Trắc nghiệm Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Câu 1. Vị trí của nhóm halogen trong bảng tuần hoàn là
A. nhóm VIIB;
B. nhóm IA;
C. nhóm VIIIA;
D. nhóm VIIA.
Đáp án đúng là: D
Vị trí của nhóm halogen trong bảng tuần hoàn là nhóm VIIA.
Câu 2. Các khoáng chất fluorite, fluorapatite, cryolite đều chứa nguyên tố
A. F;
B. Cl;
C. Br;
D. I.
Đáp án đúng là: A
Quặng fluorite (CaF2); quặng cryolite (Na3AlF6); quặng fluorapatite (Ca5F(PO4)3).
Do đó các khoáng chất này đều chứa nguyên tố F.
Câu 3. Nguyên tố halogen có hàm lượng nhiều nhất trong tự nhiên là
A. fluorine (F);
B. chlorine (Cl);
C. iodine (I)
D. bromine (Br).
Đáp án đúng là: B
Nguyên tố chlorine (Cl) có nhiều trong nước biển mà 71% bề mặt Trái Đất được bao phủ bởi biển và đại dương nên trong các nguyên tố halogen thì chlorine có hàm lượng nhiều nhất trong tự nhiên.
Câu 4. Các nguyên tố nhóm VIIA gồm
A. fluorine, chlorine, bromine, iodine và hai nguyên tố phóng xạ astatine, tennessine;
B. sulfur, chlorine, bromine, indium và hai nguyên tố phóng xạ astatine, tennessine;
C. fluorine, chlorine, boron, iodine và hai nguyên tố phóng xạ astatine, tennessine;
D. fluorine, calcium, boron, iodine và hai nguyên tố phóng xạ astatine, tennessine.
Đáp án đúng là: A
Các nguyên tố nhóm VIIA gồm: fluorine (F), chlorine (Cl), bromine (Br), iodine (I) và hai nguyên tố phóng xạ astatine (At), tennessine (Ts).
Câu 5. Phát biểu đúng là
A. Trong tự nhiên, halogen chỉ tồn tại ở dạng đơn chất;
B. Trong tự nhiên, halogen tồn tại ở chủ yếu ở dạng đơn chất;
C. Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất. Hợp chất chủ yếu của halogen là muối halide;
D. Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất là muối halide.
Đáp án đúng là: C
Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất. Hợp chất chủ yếu của halogen là muối halide.
Câu 6. Nhận định sai về đặc điểm lớp electron ngoài cùng của nguyên tử các nguyên tố halogen là
A. đều có 5 electron ở lớp ngoài cùng;
B. phân lớp s có 2 electron;
C. phân lớp p có 5 electron;
D. chưa đạt cấu hình electron bền vững như khí hiếm.
Đáp án đúng là: A
Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen có 7 electron, trong đó 2 electron trên phân lớp s và 5 electron trên phân lớp p; chưa đạt cấu hình electron bền vững như khí hiếm.
Vậy nhận định A sai.
Câu 7. Kết luận đúng là
A. Đơn chất halogen tồn tại ở dạng phân tử X2;
B. Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị phân cực;
C. Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị không phân cực;
D. Cả A và C đều đúng.
Đáp án đúng là: D
Do nguyên tử các nguyên tố halogen đều có 7 electron lớp ngoài cùng, thiếu 1 electron để đạt cấu hình bền vững giống khí hiếm. Do đó mỗi hai nguyên tử halogen góp chung 1 cặp electron để hình thành phân tử.
Công thức cấu tạo: X – X; Công thức phân tử X2.
Liên kết trong phân tử đơn chất halogen là liên kết cộng hóa trị không phân cực.
Câu 8. Đơn chất halogen ở có màu vàng lục là
A. F2
B. Cl2
C. Br2
D. I2
Đáp án đúng là: B
Đơn chất halogen có màu vàng lục là Cl2.
Câu 9. Kết luận sai là
A. Màu sắc của các đơn chất halogen đậm dần từ fluorine đến iodine;
B. Trạng thái tập hợp của đơn chất ở 20°C thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn;
C. Nhiệt độ nóng chảy, nhiệt độ sôi giảm dần fluorine đến iodine;
D. Các đơn chất halogen tan ít trong nước, tan nhiều trong các dung môi hữu cơ (riêng fluorine phản ứng mãnh liệt với nước).
Đáp án đúng là: C
Nhiệt độ nóng chảy, nhiệt độ sôi giảm dần fluorine đến iodine ⇒ sai.
Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác van der Waals giữa các phân tử. Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals, dấn đến nhiệt độ nóng chảy, nhiệt độ sôi tăng.
Câu 10. Phát biểu đúng là
A. Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa tăng dần từ fluorine đến iodine;
B. Tính chất hóa học đặc trưng của halogen là tính khử mạnh, tính khử tăng dần từ fluorine đến iodine;
C. Tính chất hóa học đặc trưng của halogen là tính khử mạnh, tính khử giảm dần từ fluorine đến iodine;
D. Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
Đáp án đúng là: D
Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
Xem thêm tóm tắt lý thuyết Hóa học 10 sách Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 18: Hydrogen halide và một số phản ứng của ion halide
Lý thuyết Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Lý thuyết Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Lý thuyết Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo
