Khoa học tự nhiên 7 Bài 3 (Cánh diều): Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Với lời giải bài tập Khoa học tự nhiên lớp 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 3.
Giải bài tập Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài giảng Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Mở đầu trang 19 Bài 3 KHTN lớp 7: Ai nhanh hơn?
Hãy sắp xếp những tấm thẻ vào các ô trong bảng dưới đây theo quy luật nhất định.
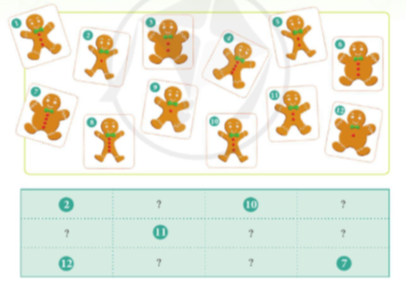
Hãy cho biết các tấm thẻ được sắp xếp theo quy luật nào theo hàng và theo cột.
Tương tự như vậy, có thể sắp xếp các nguyên tố hóa học theo quy luật vào một bảng được không?
Trả lời:
Các tấm thẻ được sắp xếp như sau:
|
(2) |
(5) |
(10) |
(8) |
|
(9) |
(11) |
(1) |
(4) |
|
(12) |
(3) |
(6) |
(7) |
+ Theo hàng ngang từ trái sang phải các tấm thẻ được sắp xếp theo quy luật: Các chú gấu trong tấm thẻ có kích thước bằng nhau, số khuy áo của các chú gấu tăng dần.
+ Theo cột từ trên xuống dưới các tấm thẻ được sắp xếp theo quy luật: Các chú gấu trong tấm thẻ có cùng số khuy áo, kích thước các chú gấu tăng dần.
- Tương tự như vậy, nếu coi các khuy áo là những electron, kích thước chú gấu tăng dần như số lớp electron tăng dần ta có thể sắp xếp các nguyên tố hóa học theo quy luật vào một bảng.
I. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
|
C |
? |
O |
|
Si |
? |
? |
Trả lời:
Sắp xếp các nguyên tố theo chiều điện tích hạt nhân tăng dần từ trái sang phải và từ trên xuống dưới như sau:
|
C (6) |
N (7) |
O (8) |
|
Si (14) |
P (15) |
S (16) |
Trả lời:
Ngay từ khi chưa biết rõ về cấu tạo nguyên tử, các nhà khoa học đã tìm ra cách phân loại, sắp xếp các nguyên tố hóa học để tìm ra quy luật về tính chất của chúng. Trong lịch sử nghiên cứu, một số quy luật sắp xếp đã được tìm ra nhưng đều không thành công.
+ Cách phân loại đầu tiên được A. Lavoiser thực hiện năm 1789, xếp 33 nguyên tố hóa học thành nhóm các chất khí, kim loại, phi kim và “đất”.
+ Năm 1829, J. W. Dobereiner phân loại các nguyên tố thành các nhóm có tính chất hóa học giống nhau.
Ví dụ: lithium, sodium và potassium là nhóm các kim loại mềm, dễ phản ứng.
+ Năm 1866, J. Newlands đã xếp các nguyên tố hóa học theo chiều tăng khối lượng nguyên tử thành các octave (quãng tám), trong đó nguyên tố thứ tám lặp lại tính chất của nguyên tố đầu tiên.
+ Năm 1869, hai nhà hóa học, D. I. Mendeleev và J. L. Meyer đều sắp xếp các nguyên tố theo chiều tăng khối lượng nguyên tử vào các hàng và cột, bắt đầu mỗi hàng (bảng của Mendeleev) hoặc cột mới (bảng của Mayer) khi các tính chất của nguyên tố bắt đầu lặp lại. Trong bảng tuần hoàn của mình, Mendeleev đã thay đổi vị trí một số nguyên tố để tính chất của nguyên tố phù hợp với quy luật, đồng thời để trống một số chỗ cho các nguyên tố chưa biết.
- Sau này, các nguyên tố hóa học ở vị trí còn trống đó được tìm ra và tính chất của chúng đều phù hợp với dự đoán của Mendeleev.
II. Cấu tạo bảng tuần hoàn
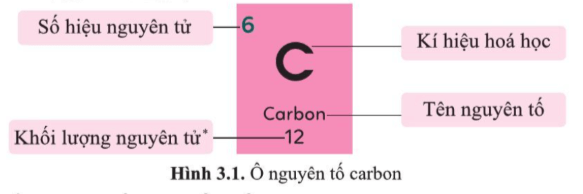
Câu hỏi 2 trang 20 KHTN lớp 7: Hình 3.1 cho biết các thông tin gì về nguyên tố carbon?
Trả lời:
Hình 3.1 cho biết:
+ Tên nguyên tố là carbon.
+ Số hiệu nguyên tử của nguyên tố carbon là Z = 6.
+ Kí hiệu hóa học là C.
+ Khối lượng nguyên tử của nguyên tố carbon bằng 12 (amu).
Trả lời:
Dựa vào bảng tuần hoàn các nguyên tố hóa học trang 25 - SGK Khoa học tự nhiên 7 - Cánh diều ta có:
- Nguyên tố hóa học có số thứ tự 16 là sulfur (lưu huỳnh):
+ Số hiệu nguyên tử: Z = 16
+ Kí hiệu hóa học: S
+ Khối lượng nguyên tử: 32 (amu).
- Nguyên tố hóa học có số thứ tự 20 là calcium:
+ Số hiệu nguyên tử: Z = 20
+ Kí hiệu hóa học: Ca
+ Khối lượng nguyên tử: 40 (amu)
Trả lời:
Để trả lời câu hỏi này các em cần nhớ:
+ Số hiệu nguyên tử của nguyên tố Z = số proton = số electron.
+ Số thứ thự chu kì = số lớp electron.
|
Nguyên tử |
Số hiệu nguyên tử |
Số lớp electron |
Chu kỳ |
|
Carbon (C) |
6 |
2 |
2 |
|
Aluminium (Al) |
13 |
3 |
3 |
Trả lời:
Cách 1:
- Nguyên tử X có số thứ tự 15 = số hiệu nguyên tử Z = số proton = số electron.
⇒ Các electron được sắp xếp vào 3 lớp:
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba có 5 electron
⇒ Nguyên tố X nằm ở chu kì 3 trong bảng tuần hoàn.
Cách 2:
Quan sát bảng tuần hoàn, xác định được nguyên tố có số thứ tự 15 ở chu kì 3 của bảng tuần hoàn.
⇒ X có 3 lớp electron (do số thứ tự chu kì = số lớp electron).
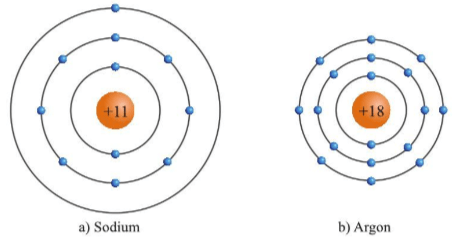
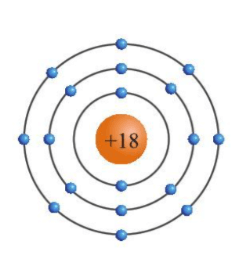
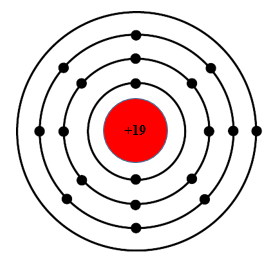
Luyện tập 3 trang 21 KHTN lớp 7:Dựa vào hình 3.4, hãy cho biết một số thông tin về nguyên tố sodium và argon (số hiệu nguyên tử, điện tích hạt nhân, số lớp electron, chu kì, số electron ở lớp ngoài cùng).
Hình 3.4. Mô hình cầu tạo nguyên tử sodium và argon
Trả lời:
|
Nguyên tố |
Số hiệu nguyên tử (Z) |
Điện tích hạt nhân |
Số lớp electron |
Chu kì |
Số electron ở lớp ngoài cùng |
|
Sodium (Na) |
11 |
+11 |
3 |
3 |
1 |
|
Argon (Ar) |
18 |
+18 |
3 |
3 |
8 |
Luyện tập 4 trang 22 KHTN lớp 7: Nguyên tố X tạo nên chất khí duy trì sự hô hấp của con người, động vật và thực vật và có nhiều trong không khí. Hãy cho biết tên của nguyên tố X. Nguyên tố X nằm ở ô nào và chu kì nào trong bảng tuần hoàn?
Trả lời:
Nguyên tố oxygen (O) tạo nên khí oxygen (O2) duy trì sự hô hấp của con người, động vật, thực vật và có nhiều trong không khí (chiếm khoảng 21% thể tích không khí).
- Tên nguyên tố: Oxygen
- Kí hiệu hóa học: O
- Dựa vào bảng tuần hoàn hóa học xác định được nguyên tố O nằm ở ô số 8 và chu kì 2 trong bảng tuần hoàn.
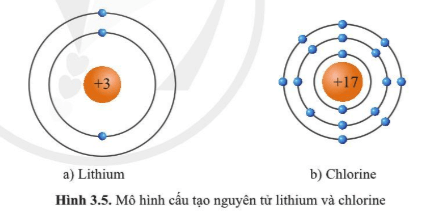
Trả lời:
Quan sát hình 3.5 và bảng tuần hoàn xác định được:
- Nguyên tử Li (lithium) có 1 electron lớp ngoài cùng. Nguyên tử Li (lithium) nằm ở nhóm IA trong bảng tuần hoàn.
- Nguyên tử Cl (chlorine) có 7 electron lớp ngoài cùng. Nguyên tử Cl (chlorine) nằm ở nhóm VIIA trong bảng tuần hoàn.
Lưu ý: Số thứ tự nhóm A = số electron lớp ngoài cùng.
Trả lời:
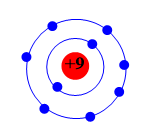
Xét nguyên tố có số thứ tự 9:
- Số thứ tự = 9 = số hiệu nguyên tử Z = số proton = số electron.
- Các electron được sắp xếp vào 2 lớp ⇒ Nguyên tố nằm ở chu kì 2 trong bảng tuần hoàn.
- Lớp ngoài cùng có 7 electron ⇒ Nguyên tố thuộc nhóm VIIA, là phi kim.
Xét nguyên tố có số thứ tự 18:
- Số thứ tự = 18 = số hiệu nguyên tử Z = số proton = số electron.
- Các electron được sắp xếp vào 3 lớp ⇒ Nguyên tố nằm ở chu kì 3 trong bảng tuần hoàn.
- Có 8 electron lớp ngoài cùng ⇒ Nguyên tố thuộc nhóm VIIIA, là khí hiếm.
Xét nguyên tố có số thứ tự 19:
- Số thứ tự = 19 = số hiệu nguyên tử Z = số proton = số electron.
Các electron được xếp vào 4 lớp, lớp ngoài cùng có 1 electron ⇒ Nguyên tố thuộc chu kì 4, nhóm IA trong bảng tuần hoàn, là kim loại.
Chú ý: Học sinh có thể quan sát trực tiếp bảng tuần hoàn để xác định.
Trả lời:
- Nhóm B (còn gọi là nhóm các nguyên tố kim loại chuyển tiếp) gồm 8 nhóm được đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
- Nhóm B gồm 10 cột, riêng nhóm VIIIB gồm 3 cột.
- Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn (từ chu kì 4 trở đi).
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn:
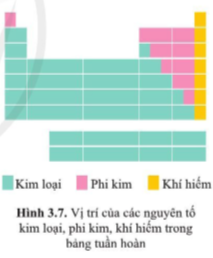
Trả lời:
- Các nguyên tố kim loại nằm ở phía bên trái và góc dưới bên phải của bảng tuần hoàn. (ô nguyên tố màu xanh trong bảng tuần hoàn).
- Các nguyên tố phi kim nằm ở phía trên, bên phải của bảng tuần hoàn. (ô nguyên tố màu hồng trong bảng tuần hoàn).
- Các nguyên tố khí hiếm là tất cả các nguyên tố nằm trong nhóm VIIIA. (ô nguyên tố màu vàng cam trong bảng tuần hoàn).
IV. Ý nghĩa của bảng tuần hoàn
Trả lời:
Nguyên tố X nằm ở chu kì 2, nhóm VA trong bảng tuần hoàn.

Ta biết được:
- Tên nguyên tố X là: Nitrogen.
- Kí hiệu hóa học: N
- Khối lượng nguyên tử: 14 (amu).
- X ở ô thứ 7 trong bảng tuần hoàn, là nguyên tố phi kim.
Trả lời:
Học sinh tự nghiên cứu, thiết kế, có thể tham khảo một số ý tưởng sau:

Lý thuyết Khoa học tự nhiên 7 Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp bảng tuần hoàn các nguyên tố hóa học
- Các nguyên tố hóa học được xếp theo quy luật trong một bảng, gọi là bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn).
- Bảng tuần hoàn hiện nay có 118 nguyên tố hóa học và được xếp theo nguyên tắc sau:
+ Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố được xếp trong cùng một hàng có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố trong cùng một cột có tính chất hóa học tương tự nhau.
II. Cấu tạo bảng tuần hoàn
Bảng tuần hoàn gồm các ô được sắp xếp thành các hàng và các cột.
1. Ô nguyên tố
- Ô nguyên tố: là một ô trong bảng tuần hoàn tương ứng với một nguyên tố hóa học.
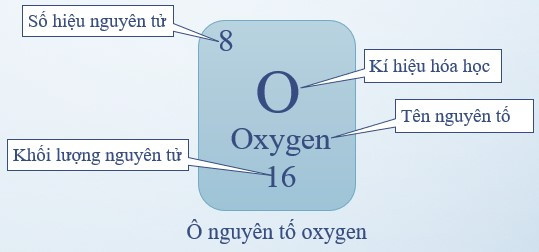
- Ô nguyên tố cho biết:
+ Số hiệu nguyên tử (kí hiệu là Z): bằng số đơn vị điện tích hạt nhân (bằng số proton và bằng số electron) và là số thứ tự của nguyên tố
+ Kí hiệu hóa học
+ Tên nguyên tố
+ Khối lượng nguyên tử
Ví dụ: Ô nguyên tố oxygen
2. Chu kì
- Chu kì gồm các nguyên tố thuộc cùng nguyên tử có cùng số lớp electron và được sắp xếp thành hàng theo chiều tăng dần của điện tích hạt nhân.
- Số thứ tự của chu kì = số lớp electron của nguyên tố
- Bảng tuần hoàn hiện nay gồm 7 chu kì, được đánh số từ chu kì 1 đến chu kì 7.
- Trong một chu kì, khi đi từ trái qua phải theo chiều tăng dần của điện tích hạt nhân:
+ Mở đầu chu kì là một kim loại điển hình (trừ chu kì 1).
+ Cuối chu kì là một phi kim điển hình (trừ chu kì 7).
+ Kết thúc chu kì là một khí hiếm.
- Ví dụ: Trong chu kì 4:
+ Mở đầu chu kì là nguyên tố potassium (K) – là một kim loại điển hình
+ Cuối chu kì là nguyên tố bromine (Br) – là một phi kim điển hình
+ Kết thúc chu kì là nguyên tố krypton (Kr) – là một khí hiếm
3. Nhóm
- Nhóm gồm các nguyên tố có tính chất hóa học tương tự nhau, được xếp thành cột theo chiều tăng dần của điện tích hạt nhân.
- Bảng tuần hoàn gồm 18 cột gồm:
+ 8 cột là nhóm A.
+ 10 cột là nhóm B: gọi kà nhóm các nguyên tố kim loại chuyển tiếp (trong phạm vi chương trình chỉ nghiên cứu 8 nhóm A).
- Nhóm A được đánh số bằng số La Mã lần lượt từ nhóm IA đến VIIIA.
- Số thứ tự của nhóm A = số electron lớp ngoài cùng.
Ví dụ:
+ Nhóm IA: gồm các nguyên tố kim loại hoạt động mạnh (kim loại điển hình), trừ hydrogen (H); đều có 1 electron ở lớp ngoài cùng.
+ Nhóm VIIA: gồm các nguyên tố phi kim hoạt động mạnh (phi kim điển hình), trừ tennessine (Ts); đều có 7 electron ở lớp ngoài cùng.
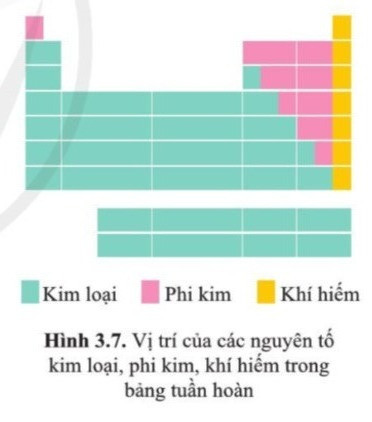
III. Vị trí của các nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
- Các nguyên tố kim loại: (chiếm hơn 80% trong bảng tuần hoàn), nằm bên góc trái và góc dưới bên phải của bảng tuần hoàn.
- Các nguyên tố phi kim: nằm phía trên, bên phải của bảng tuần hoàn. Trong đó, các phi kim hoạt động mạnh nằm ở phía trên.
- Các nguyên tố khí hiếm: Là nguyên tố nằm trong nhóm VIIIA.
IV. Ý nghĩa của bảng tuần hoàn
Bảng tuần hoàn cho biết:
- Các thông tin của một nguyên tố hóa học: tên nguyên tố, số hiệu nguyên tử, kí hiệu hóa học, khối lượng nguyên tử.
- Vị trí của nguyên tố hóa học (ô, chu kì, nhóm). Từ đó nhận ra được các nguyên tố kim loại, phi kim hay khí hiếm:
+ Các nguyên tố ở nhóm IA, IIA, IIIA là kim loại (trừ hydrogen và boron).
+ Hầu hết các nguyên tố ở nhóm VA, VIA, VIIA là phi kim.
+ Các nguyên tố nhóm VIIIA là khí hiếm.
Ví dụ: Bảng tuần hoàn cho biết nguyên tố bromine (Br) ở ô số 35, chu kì 4, nhóm VIIA, là nguyên tố phi kim.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài 4: Phân tử, đơn chất, hợp chất
Bài 5: Giới thiệu về liên kết hóa học
Bài 6: Hóa trị, công thức hóa học
Xem thêm tài liệu Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Lý thuyết Bài 3: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Cánh Diều
- Giải sbt Toán 7 – Cánh Diều
- Lý thuyết Toán 7 – Cánh Diều
- Giải VBT Toán 7 – Cánh diều
- Soạn văn lớp 7 (hay nhất)– Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Giải sbt Ngữ văn lớp 7 – Cánh Diều
- Văn mẫu lớp 7 – Cánh Diều
- Soạn văn lớp 7 (ngắn nhất) – Cánh Diều
- Giải VBT Ngữ văn lớp 7 – Cánh diều
- Giải sgk Tiếng Anh 7 - Explore English
- Giải sgk Tiếng Anh 7 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 7 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 i-learn Smart World
- Bài tập Tiếng Anh 7 iLearn Smart World theo Unit có đáp án
- Giải sbt Tiếng Anh 7 - ilearn Smart World
- Giải sgk Lịch sử 7 – Cánh Diều
- Lý thuyết Lịch Sử 7 – Cánh Diều
- Giải sbt Lịch sử 7 – Cánh Diều
- Giải VBT Lịch sử 7 – Cánh diều
- Giải sgk Địa lí 7 – Cánh Diều
- Lý thuyết Địa Lí 7 – Cánh Diều
- Giải sbt Địa lí 7 – Cánh Diều
- Giải VBT Địa lí 7 – Cánh diều
- Giải sgk Tin học 7 – Cánh Diều
- Lý thuyết Tin học 7 – Cánh Diều
- Giải sbt Tin học 7 – Cánh Diều
- Giải sgk Giáo dục công dân 7 – Cánh Diều
- Lý thuyết Giáo dục công dân 7 – Cánh Diều
- Giải sbt Giáo dục công dân 7 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sgk Công nghệ 7 – Cánh Diều
- Lý thuyết Công nghệ 7 – Cánh Diều
- Giải sbt Công nghệ 7 – Cánh Diều
- Giải sgk Giáo dục thể chất 7 – Cánh Diều
- Giải sgk Âm nhạc 7 – Cánh Diều