Khoa học tự nhiên 7 Bài 6 (Cánh diều): Hóa trị, công thức hóa học
Với lời giải bài tập Khoa học tự nhiên lớp 7 Bài 6: Hóa trị, công thức hóa học sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 6.
Giải bài tập Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học
Bài giảng Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học
Trả lời:
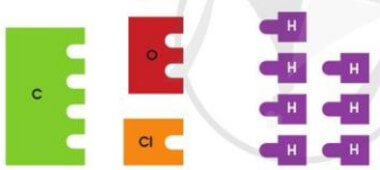
Mỗi nguyên tử C có thể ghép tối đa với 4 nguyên tử H tạo thành hợp chất là CH4.
Mỗi nguyên tử O có thể ghép tối đa với 2 nguyên tử H tạo thành hợp chất là H2O
Mỗi nguyên tử Cl có thể ghép tối đa với 1 nguyên tử H tạo thành hợp chất HCl.
I. Hóa trị
Trả lời:
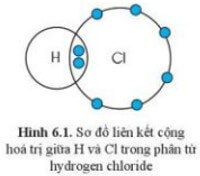
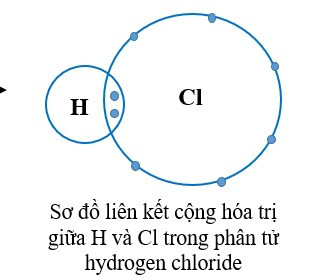
Quan sát sơ đồ thấy nguyên tử H và Cl, mỗi nguyên tử góp 1 electron.
Hóa trị của H và Cl đều là I, bằng với số electron mà nguyên tử H và Cl góp chung để tạo ra liên kết.
Trả lời:
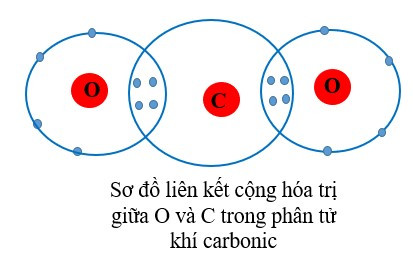
Quan sát vào sơ đồ trên ta thấy:
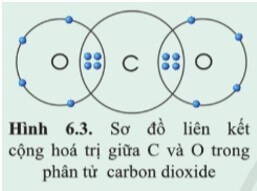
- Mỗi nguyên tử O góp chung 2 electron ⇒ O có hóa trị II.
- Nguyên tử C góp chung 4 electron để hình thành liên kết ⇒ C có hóa trị IV.
Trả lời:
- Sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H:
- Liên kết giữa N và H được tạo thành bởi đôi electron dùng chung giữa hai nguyên tử
nên là liên kết cộng hóa trị.
+ Nguyên tử N góp 3 electron ⇒ N có hóa trị III.
+ Nguyên tử H góp chung 1 electron ⇒ H có hóa trị I.
Trả lời:
|
Nguyên tố |
Si |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
Tích của hóa trị và số nguyên tử tham gia liên kết của Si và O bằng nhau.
Trả lời:
|
Nguyên tố |
Mg |
Cl |
|
Hóa trị |
II |
I |
|
Số nguyên tử |
1 |
y |
|
Tích hóa trị và số nguyên tử |
II × 1 = I × y |
|
Ta có: II × 1 = I × y ⇒ y = 2
Vậy mỗi nguyên tử Mg có thể kết hợp được với 2 nguyên tử Cl.
Trả lời:
|
Nguyên tố |
A |
B |
|
Hóa trị |
III |
II |
|
Số nguyên tử |
x |
y |
|
Tích hóa trị và số nguyên tử |
III × x = II × y |
|
Ta có: III × x = II × y ⟺
Vậy tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó là 2 : 3
II. Công thức hóa học
Câu hỏi 3 trang 41 KHTN lớp 7: Cho công thức hóa học của một số chất như sau:
Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử.
Trả lời:
a) N2 (nitrogen):
+ Nitrogen được tạo thành từ nguyên tố N.
+ Phân tử N2 có 2 nguyên tử N.
b) NaCl (sodium chloride):
+ Sodium chloride được tạo thành từ hai nguyên tố là Na và Cl.
+ Trong phân tử NaCl có 1 nguyên tử Na và 1 nguyên tử Cl.
c) MgSO4 (magnesium sulfate):
+ Magnesium sulfate được tạo thành từ 3 nguyên tố là Mg, S và O.
+ Trong phân tử MgSO4 có 1 nguyên tử Mg, 1 nguyên tử S và 4 nguyên tử O.
Luyện tập 5 trang 42 KHTN lớp 7: Viết công thức hóa học của các chất:
a) Sodium sulfide, biết trong phân tử có hai nguyên tử Na và một nguyên tử S.
b) Phosphoric acid, biết trong phân tử có ba nguyên tử H, một nguyên tử P và bốn nguyên tử O.
Trả lời:
a) Sodium sulfide: Na2S
b) Phosphoric acid: H3PO4
|
Mô hình |
|
|
|
|
|
Công thức hóa học |
? |
? |
? |
Trả lời:
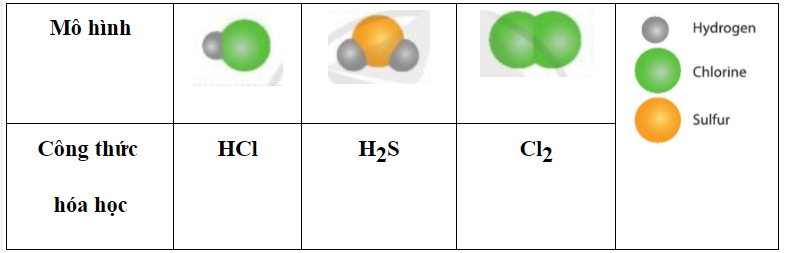
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong một phân tử glucose bằng bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu?
Trả lời:
a) Glucose được tạo thành từ ba nguyên tố là C, H, O.
b) Trong một phân tử glucose:
Khối lượng nguyên tố C là 6 × 12 = 72 amu
Khối lượng nguyên tố H là 12 × 1 = 12 amu
Khối lượng nguyên tố O là 6 × 16 = 96 amu
c) Khối lượng phân tử của glucose là: 72 + 12 + 96 = 180 amu.
Trả lời:
Ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không đúng.
Chứng minh:
Tính phần trăm khối lượng của H, O trong H2O
Khối lượng của nguyên tố H trong H2O là: 2 × 1 = 2 (amu)
Khối lượng của nguyên tố O trong H2O là: 1 × 16 = 16 (amu)
⇒ Khối lượng phân tử H2O là: 2 + 16 = 18 (amu)
Phần trăm về khối lượng của H trong H2O là:
%mH =
Phần trăm về khối lượng của O trong H2O là:
%mO = = = 88,89%
Vậy ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không đúng.
Trả lời:
Khối lượng của nguyên tố Ca trong CaCO3 là:
mCa = 1 × 40 amu = 40 amu
Khối lượng của nguyên tố C trong CaCO3 là:
mC = 1 × 12 amu = 12 amu
Khối lượng của nguyên tố O trong CaCO3 là:
mO = 3 × 16 = 48 amu
→ Khối lượng phân tử CaCO3 là: = 40 + 12 + 48 = 100 amu
Phần trăm về khối lượng của Ca trong CaCO3 là:
%mCa =
Phần trăm về khối lượng của C trong CaCO3 là:
%mC = = = 12%
Phần trăm về khối lượng của O trong CaCO3 là:
%mO =
Trả lời:
Khối lượng của nguyên tố C trong C6H8O7 là:
6 × 12 = 72 (amu)
Khối lượng của nguyên tố H trong C6H8O7 là:
8 × 1 = 8 (amu)
Khối lượng của nguyên tố O trong C6H8O7 là:
7 × 16 = 112 (amu)
⇒ Khối lượng phân tử C6H8O7 là: 72 + 8 + 112 = 192 (amu)
Phần trăm về khối lượng của C trong C6H8O7 là:
%mC =
Phần trăm về khối lượng của H trong C6H8O7 là:
%mH = × 100% = × 100% = 4,17%
Phần trăm về khối lượng của O trong C6H8O7 là:
%mO =
Trả lời:
- Xét hợp chất KCl ta có:
Khối lượng K trong hợp chất KCl là:
mK = 1 × 39 amu = 39 amu
Khối lượng phân tử hợp chất KCl là:
MKCl = 1 × 39 + 1 × 35,5 = 74,5 amu
Phần trăm khối lượng của K trong hợp chất KCl là:
%mK = = = 52,35%
- Xét hợp chất K2SO4 ta có:
Khối lượng K trong hợp chất K2SO4 là
mK = 2 × 39 amu = 78 amu
Khối lượng phân tử hợp chất K2SO4 là
= 2 × 39 amu + 1 × 32 amu + 4 × 16 amu = 174 amu
Phần trăm khối lượng của K trong hợp chất K2SO4 là
%mK = = = 44,83%
Vậy người trồng cây muốn sử dụng loại phân bón có hàm lượng K cao hơn nên dùng phân KCl.
Trả lời:
+ Xét hợp chất HBr
Gọi hóa trị của Br trong hợp chất là a.
Vì H có hóa trị I nên ta có biểu thức:
I × 1 = a × 1 ⇒ a = I
Vậy trong hợp chất HBr: hóa trị của H là I, hóa trị của Br là I.
+ Xét hợp chất BaO
Gọi hóa trị của Ba trong hợp chất là b
Vì O có hóa trị II nên ta có biểu thức:
b × 1 = II × 1 ⇒ b = II
Vậy trong hợp chất BaO, hóa trị của Ba là II, hóa trị của O là II.
Trả lời:
Đặt công thức hóa học của X là FexOy
Khối lượng nguyên tố Fe trong một phân tử X là
(amu)
Khối lượng của nguyên tố S trong một phân tử X là
160 – 112 = 48 (amu)
Ta có: 56 amu × x = 112 amu → x = 2
16 amu × y = 48 amu → y = 3
Vậy công thức hóa học của X là Fe2O3
Lý thuyết Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học
I. Hóa trị
1. Khái niệm về hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Ví dụ:
+ Trong phân tử hydrogen chloride, mỗi nguyên tử H và Cl góp chung 1 electron tạo ra đôi electron dùng chung giữa hai nguyên tử nên H và Cl có hóa trị I.
+ Trong phân tử khí carbonic, mỗi nguyên tử O góp chung 2 electron, nguyên tử C góp chung 4 electron. Như vậy nguyên tử C liên kết với 2 nguyên tử O bằng 4 đôi electron chung nên C có hóa trị IV và O có hóa trị II.
- Thông thường, hóa trị của nguyên tố trong hợp chất cộng hóa trị = số electron mà nguyên tử nguyên tố đó góp chung với nguyên tố khác.
- Trong hợp chất, H luôn có hóa trị I, O luôn có hóa trị II.
- Hóa trị của một số nguyên tố:
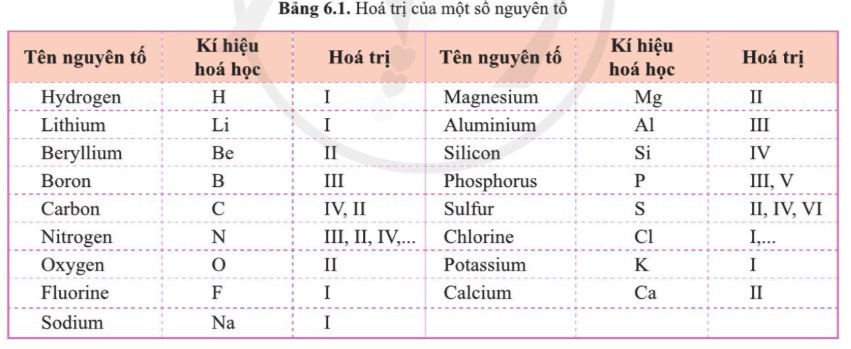
- Hóa trị của một số nhóm nguyên tử

2. Quy tắc hóa trị
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Ví dụ:
+ Trong phân tử nước, hóa trị và số nguyên tử tham gia liên kết của H và O như sau:
|
Nguyên tố |
H |
O |
|
Hóa trị |
I |
II |
|
Số nguyên tử |
2 |
1 |
|
Tích hóa trị và số nguyên tử |
I × 2 = II × 1 |
|
+ Trong phân tử sulfur dioxide (SO2), hóa trị và số nguyên tử tham gia liên kết của S và O như sau:
|
Nguyên tố |
S |
O |
|
Hóa trị |
IV |
II |
|
Số nguyên tử |
1 |
2 |
|
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
II. Công thức hóa học
1. Công thức hóa học
- Công thức hóa học dùng để biểu diễn chất.
- Công thức hóa học gồm hai phần:
+ Phần chữ: gồm kí hiệu hóa học của nguyên tố tạo thành chất.
+ Phần số: gồm các số được ghi bên phải, dưới chân kí hiệu hóa học, ứng với số nguyên tử của nguyên tố trong một phân tử (nếu chỉ có một nguyên tử thì không ghi). Các số này được gọi là chỉ số.

- Công thức hóa học của hợp chất có hai kí hiệu hóa học trở lên.
Ví dụ: NaCl, CaO, HNO3, BaSO4,…
- Công thức hóa học của các đơn chất chỉ có một kí hiẹu hóa học.
+ Với phi kim, phân tử thường có hai nguyên tử.
Ví dụ: N2, H2, O2, Br2,…
+ Với kim loại và một số phi kim, kí hiệu hóa học của nguyên tố được coi là công thức hóa học của đơn chất.
Ví dụ: Kim loại: Fe, Cu, Al, Mg,… và phi kim: C, S, P,…
2. Ý nghĩa của công thức hóa học
Công thức hóa học của một số chất cho biết một số thông tin
+ Nguyên tố tạo ra chất.
+ Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
+ Khối lượng phân tử của chất.
Ví dụ: Công thức hóa học của nitric acid là HNO3:
+ Nitric acid được tạo thành từ H, N và O.
+ Trong một phân tử nitric acid có 1 nguyên tử H, 1 nguyên tử N và 3 nguyên tử O.
+ Khối lượng phân tử của nitric là:
1 × 1 amu + 1 × 14 amu + 3 × 16 amu = 63 amu
Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất
- Khi biết công thức hóa học của một chất, tính được thành phần phần trăm khối lượng của các nguyên tố tạo ra chất theo các bước sau:
+ Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất.
+ Tính khối lượng phân tử.
+ Tính phần trăm khối lượng của nguyên tố theo công thức:
(Khối lượng nguyên tố : Khối lượng phân tử hợp chất) × 100%
Ví dụ: Tính phần trăm khối lượng của Cu, O trong hợp chất CuO.
Hướng dẫn giải:
Ta có: Khối lượng của nguyên tố O trong CuO là:
mO = 1 × 16 amu = 16 amu
Khối lượng của nguyên tố Cu trong CuO là:
mCu = 1 × 64 amu = 64 amu
Khối lượng của phân tử CuO là: MCuO = 16 + 64 = 80 (amu)
Phần trăm khối lượng của Cu trong hợp chất CuO là:
Phần trăm về khối lượng của O trong hợp chất CuO là:
%mO = 100% - %mCu = 100% - 80% = 20%
Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
- Cách xác định hóa trị khi biết công thức hóa học và hóa trị của một nguyên tố:
+ Đặt hóa trị của nguyên tố chưa biết là a.
+ Xác định a dựa vào quy tắc hóa trị.
Ví dụ: Xác định hóa trị của Al trong hợp chất có công thực hóa học Al2O3.
Giải:
Gọi hóa trị của Al trong hợp chất là a.
Vì O có hóa trị II nên ta có biểu thức: a × 2 = II × 3 → a = III
Vậy Al có hóa trị III trong hợp chất Al2O3.
3. Xác định công thức hóa học của hợp chất khi biết hóa trị hoặc phần trăm khối lượng của các nguyên tố
a) Biết hóa trị của các nguyên tố, lập công thức hóa học của hợp chất tạo thành từ hai nguyên tố
- Nếu hai nguyên tố A, B có hóa trị tương ứng là a, b thì công thức hóa học của hợp chất tạo thành từ A và B được xác định như sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Áp dụng quy tắc hóa trị, xác định tỉ lệ
+ Xác định x, y (x, y thường là những số nguyên tố nhỏ nhất thỏa mãn tỉ lệ trên).
Ví dụ: Lập công thức hóa học của hợp chất được tạo bởi S hóa trị IV và O.
Hướng dẫn giải
+ Đặt công thức của hợp chất là SxOy.
+ Theo quy tắc hóa trị: x × IV = y × II
+ Ta có tỉ lệ:
+ Công thức hóa học của hợp chất là: SO2.
b) Xác định công thức hóa học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất
- Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó, xác định công thức hóa học theo bước sau:
+ Đặt công thức hóa học của hợp chất AxBy.
+ Tính khối lượng của A, B trong một phân tử chất.
+ Tìm x, y.
Ví dụ: R là hợp chất của Fe và O, khối lượng phân tử của R là 72 amu. Biết phần trăm khối lượng của oxygen trong R là 22,22%. Hãy xác định công thức hóa học của R.
Hướng dẫn giải
+ Đặt công thức hóa học của R là FexOy.
+ Khối lượng của nguyên tố O trong một phân tử R là:
+ Khối lượng của nguyên tố S trong một phân tử R là:
72 – 16 = 56 (amu)
+ Ta có: 16 amu × y = 16 amu ⇒ y = 1
56 amu × x = 56 amu ⇒ x = 1
Vậy công thức hóa học của R là FeO.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Bài 8: Đồ thị quãng đường – thời gian
Xem thêm tài liệu Khoa học tự nhiên lớp 7 Cánh diều hay, chi tiết khác:
Xem thêm các chương trình khác:
- Giải sgk Toán 7 – Cánh Diều
- Giải sbt Toán 7 – Cánh Diều
- Lý thuyết Toán 7 – Cánh Diều
- Giải VBT Toán 7 – Cánh diều
- Soạn văn lớp 7 (hay nhất)– Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 7 – Cánh Diều
- Giải sbt Ngữ văn lớp 7 – Cánh Diều
- Văn mẫu lớp 7 – Cánh Diều
- Soạn văn lớp 7 (ngắn nhất) – Cánh Diều
- Giải VBT Ngữ văn lớp 7 – Cánh diều
- Giải sgk Tiếng Anh 7 - Explore English
- Giải sgk Tiếng Anh 7 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 7 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 7 i-learn Smart World
- Bài tập Tiếng Anh 7 iLearn Smart World theo Unit có đáp án
- Giải sbt Tiếng Anh 7 - ilearn Smart World
- Giải sgk Lịch sử 7 – Cánh Diều
- Lý thuyết Lịch Sử 7 – Cánh Diều
- Giải sbt Lịch sử 7 – Cánh Diều
- Giải VBT Lịch sử 7 – Cánh diều
- Giải sgk Địa lí 7 – Cánh Diều
- Lý thuyết Địa Lí 7 – Cánh Diều
- Giải sbt Địa lí 7 – Cánh Diều
- Giải VBT Địa lí 7 – Cánh diều
- Giải sgk Tin học 7 – Cánh Diều
- Lý thuyết Tin học 7 – Cánh Diều
- Giải sbt Tin học 7 – Cánh Diều
- Giải sgk Giáo dục công dân 7 – Cánh Diều
- Lý thuyết Giáo dục công dân 7 – Cánh Diều
- Giải sbt Giáo dục công dân 7 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 7 – Cánh Diều
- Giải sgk Công nghệ 7 – Cánh Diều
- Lý thuyết Công nghệ 7 – Cánh Diều
- Giải sbt Công nghệ 7 – Cánh Diều
- Giải sgk Giáo dục thể chất 7 – Cánh Diều
- Giải sgk Âm nhạc 7 – Cánh Diều