Giải KHTN 8 Bài 10 (Kết nối tri thức): Oxide
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 10: Oxide sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 10.
Giải KHTN 8 Bài 10: Oxide
Mở đầu trang 44 Bài 10 KHTN 8: Tại sao vôi sống (CaO) lại được sử dụng để khử chua đất trồng trọt?
Trả lời:
Khi bón vôi sống (CaO) lên ruộng, vôi sống tác dụng với nước tạo thành Ca(OH)2:
CaO + H2O → Ca(OH)2.
Ca(OH)2 tác dụng với acid có trong đất, khử chua cho đất.
I. Khái niệm
Hoạt động trang 44 KHTN 8: Tìm hiểu về khái niệm oxide
Bảng 10.1. Tên, công thức hoá học của một số oxide
1. Đề xuất khái niệm về oxide.
Trả lời:
Nhận xét: Công thức phân tử của các oxide ở cột (2), (4) đều có chứa 2 nguyên tố, trong đó có 1 nguyên tố là oxygen (O).
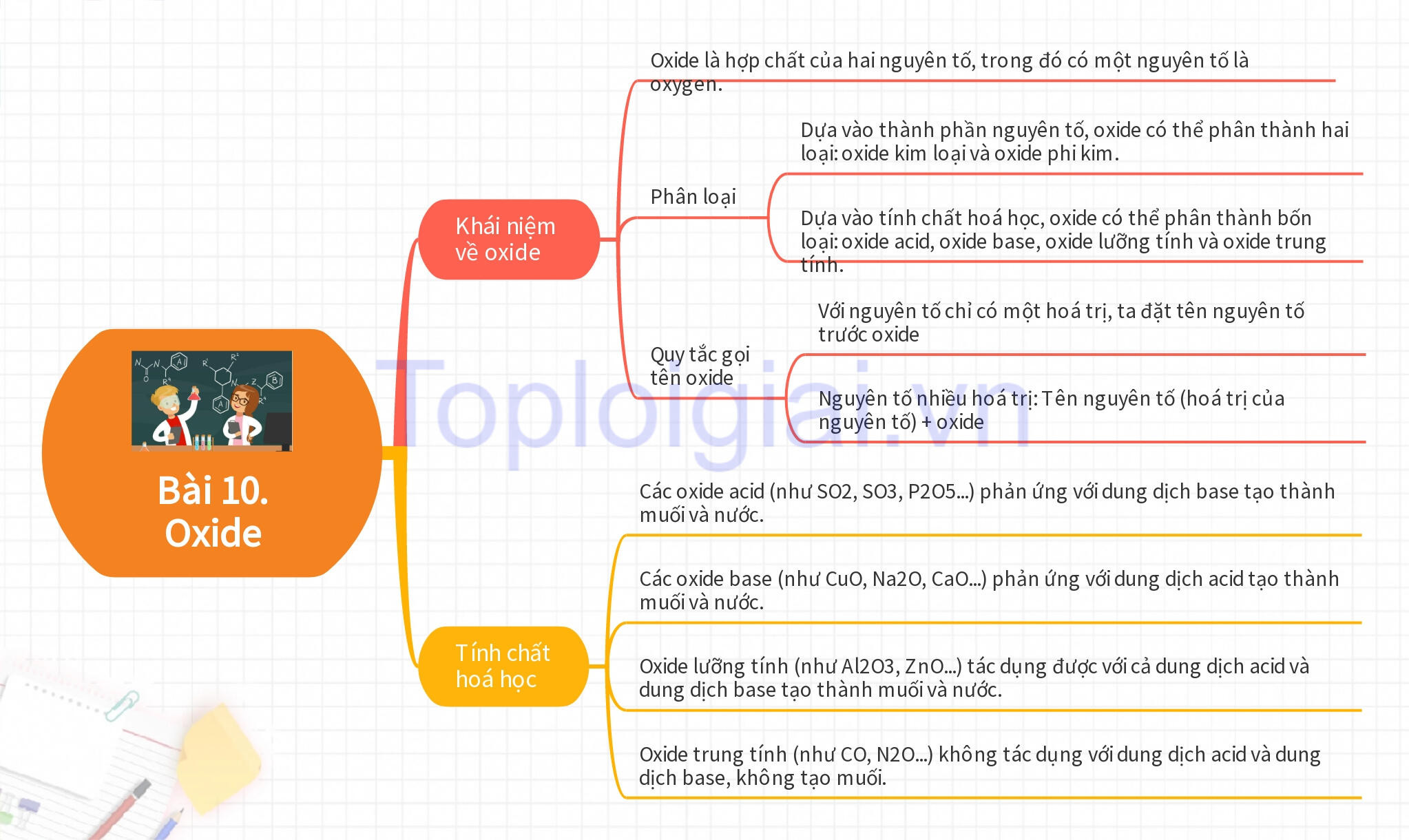
1. Khái niệm oxide: Oxide là hợp chất của hai nguyên tố trong đó có một nguyên tố là oxygen.
2. Phân loại oxide:
- Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim.
- Dựa vào tính chất hoá học, oxide có thể phân thành 4 loại: oxide acid; oxide base; oxide lưỡng tính và oxide trung tính.
Câu hỏi trang 45 KHTN 8: Cho các sơ đồ phản ứng sau:
Hoàn thành các phương trình hoá học và đọc tên các sản phẩm tạo thành.
Trả lời:
(1) 4Al + 3O2 → 2Al2O3 (aluminium oxide)
(2) 4P + 5O2 → 2P2O5 (diphosphorus pentoxide)
(3) S + O2 → SO2 (sulfur dioxide)
(4) 2Mg + O2 → 2MgO (magnesium oxide)
Hoạt động trang 45 KHTN 8: Tìm hiểu tính chất hoá học của oxide acid
Trả lời:
Dẫn từ từ khí carbon dioxide vào nước vôi trong, ban đầu dung dịch vẩn đục; Tiếp tục dẫn khí carbon dioxide vào sau một khoảng thời gian vẩn đục lại tan dần.
Trả lời:
Phương trình hoá học:
SO2 + 2NaOH (dư) → Na2SO3 + H2O
SO2 (dư) + NaOH → NaHSO3.
Hoạt động trang 46 KHTN 8: Tìm hiểu tính chất hoá học của oxide base
Chuẩn bị: CuO (bột); dung dịch H2SO4 loãng; thìa lấy hoá chất, ống nghiệm.
Nêu hiện tượng của thí nghiệm trên và giải thích.
Trả lời:
Hiện tượng: Bột CuO tan dần, sau phản ứng dung dịch thu được có màu xanh.
Giải thích: CuO là oxide base, tác dụng với acid tạo thành muối và nước:
CuO + H2SO4 → CuSO4 + H2O.
Trả lời:
- Tính chất hoá học của oxide base: Tác dụng với dung dịch acid tạo thành muối và nước. Ví dụ:
MgO + 2HCl → MgCl2 + H2O
MgO + H2SO4 → MgSO4 + H2O.
- Tính chất hoá học của oxide acid: Tác dụng với dung dịch base tạo thành muối và nước. Ví dụ:
SO2 + 2KOH → K2SO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O.
Viết các phương trình hoá học. Hãy cho biết các oxide trên thuộc loại oxide nào?
Trả lời:
a) Oxide tác dụng với HCl là: CaO; Fe2O3 (các oxide base).
CaO + 2HCl → CaCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O.
b) Oxide tác dụng với NaOH là: SO3; CO2 (các oxide acid).
SO3 + 2NaOH → Na2SO4 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
Còn lại CO là oxide trung tính, không tác dụng với NaOH và HCl.
Kiến thức trọng tâm KHTN 8 Bài 10: Oxide
- Oxide là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxygen.
- Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim. Oxide kim loại được tạo thành từ phản ứng của kim loại với oxygen, ví dụ như phản ứng giữa Ba và O2 tạo ra BaO. Oxide phi kim được tạo thành từ phản ứng của phi kim với oxygen, ví dụ như phản ứng giữa C và O2 tạo ra CO2.
- Dựa vào tính chất hoá học, oxide có thể phân thành bốn loại: oxide acid, oxide base, oxide lưỡng tính và oxide trung tính.
- Quy tắc gọi tên oxide
+ Với nguyên tố chỉ có một hoá trị, ta đặt tên nguyên tố trước oxide, ví dụ như Sine oxide (ZnO).
+ Nguyên tố nhiều hoá trị: Tên nguyên tố (hoá trị của nguyên tố) + oxide
+ Cách đặt tên oxide của phi kim nhiều hoá trị:
+ (Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide
+ (Tiền tố mono là một, đi là hai, trẻ là ba, tetra là bốn)
Ví dụ: FeO đọc là iron(II) oxide, CO đọc là carbon monoxide hoặc carbon(II) oxide, CO2 đọc là carbon dioxide hoặc carbon(IV) oxide
- Oxide acid tác dụng với dung dịch base tạo thành muối và nước.
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
- Khi sục từ từ khí CO2 vào dung dịch Ca(OH)2, ban đầu dung dịch vẩn đục do tạo muối CaCO3 không tan.
- Các oxide acid (như SO2, SO3, P2O5...) phản ứng với dung dịch base tạo thành muối và nước.
Ví dụ: SO2 + Ca(OH)2 → CaSO3 + H2O.
- Để kiểm tra tính chất của oxide acid, ta có thể thực hiện thí nghiệm bằng cách cho bột đá vôi và dung dịch hydrochloric acid vào ống nghiệm, sau đó dẫn khí carbon dioxide vào để tạo thành khí carbonic, quan sát hiện tượng xảy ra.
- Các oxide base (như CuO, Na2O, CaO...) phản ứng với dung dịch acid tạo thành muối và nước.
Ví dụ: CuO + H2SO4 → CuSO4 + H2O.
- Để kiểm tra tính chất của oxide base, ta có thể thực hiện thí nghiệm bằng cách cho bột CuO và dung dịch H2SO4 vào ống nghiệm, sau đó quan sát hiện tượng xảy ra.
Oxide lưỡng tính:
Oxide lưỡng tính (như Al2O3, ZnO...) tác dụng được với cả dung dịch acid và dung dịch base tạo thành muối và nước. Ví dụ: Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Oxide trung tính (như CO, N2O...) không tác dụng với dung dịch acid và dung dịch base, không tạo muối.
Sơ đồ tư duy KHTN 8 Bài 10: Oxide
Xem thêm lời giải bài tập Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn 8 Kết nối tri thức (hay nhất)
- Văn mẫu lớp 8 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 8 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 8 - Kết nối tri thức
- Giải SBT Ngữ văn 8 – Kết nối tri thức
- Giải Vở thực hành Ngữ văn 8 Kết nối tri thức | VTH Ngữ văn 8 Tập 1, Tập 2
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Soạn văn 8 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 8 – Kết nối tri thức
- Lý thuyết Toán 8 – Kết nối tri thức
- Giải sbt Toán 8 – Kết nối tri thức
- Vở thực hành Toán 8 Kết nối tri thức | Giải VTH Toán 8 Tập 1, Tập 2
- Chuyên đề dạy thêm Toán 8 cả 3 sách (2024 có đáp án)
- Bài tập Tiếng Anh 8 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 8 – Global success
- Giải sbt Tiếng Anh 8 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 8 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 Global success
- Giải sgk Lịch sử 8 – Kết nối tri thức
- Lý thuyết Lịch sử 8 - Kết nối tri thức
- Giải sbt Lịch sử 8 – Kết nối tri thức
- Giải sgk Địa lí 8 – Kết nối tri thức
- Lý thuyết Địa lí 8 - Kết nối tri thức
- Giải sbt Địa lí 8 – Kết nối tri thức
- Giải VTH Địa lí 8 Kết nối tri thức | Vở thực hành Địa lí 8
- Giải sgk Giáo dục công dân 8 – Kết nối tri thức
- Lý thuyết Giáo dục công dân 8 – Kết nối tri thức
- Giải sbt Giáo dục công dân 8 – Kết nối tri thức
- Giải sgk Công nghệ 8 – Kết nối tri thức
- Lý thuyết Công nghệ 8 - Kết nối tri thức
- Giải sbt Công nghệ 8 – Kết nối tri thức
- Giải sgk Tin học 8 – Kết nối tri thức
- Lý thuyết Tin học 8 - Kết nối tri thức
- Giải sbt Tin học 8 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 8 – Kết nối tri thức
