Giải KHTN 8 Bài 9 (Kết nối tri thức): Base. Thang pH
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 9: Base. Thang pH sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 9.
Giải KHTN 8 Bài 9: Base. Thang pH
Mở đầu trang 39 Bài 9 KHTN 8: Tại sao khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt?
Trả lời:
Trong nọc độc của một số côn trùng như: ong, kiến … có chứa một lượng acid gây bỏng da và đồng thời gây rát, ngứa. Khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt, khi đó có phản ứng trung hoà acid – base xảy ra làm cho vết phồng xẹp xuống và không còn cảm giác rát ngứa.
I. Khái niệm
Hoạt động trang 39 KHTN 8: Tìm hiểu khái niệm base
Bảng 9.1. Tên một số base thông dụng, công thức hoá học và dạng tồn tại của base trong dung dịch
Quan sát Bảng 9.1 và thực hiện các yêu cầu:
1. Công thức hoá học của các base có đặc điểm gì giống nhau?
2. Các dung dịch base có đặc điểm gì chung?
3. Thảo luận nhóm và đề xuất khái niệm về base.
4. Em hãy nhận xét về cách gọi tên base và đọc tên base Ca(OH)2.
Trả lời:
1. Công thức hoá học của các base đều có chứa nhóm hydroxide (−OH).
2. Các dung dịch base đều có chứa anion OH−.
3. Khái niệm: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH−.
4. Quy tắc gọi tên các base: Tên kim loại (kèm hoá trị đối với kim loại có nhiều hoá trị) + hydroxide.
Tên base Ca(OH)2: Calcium hydroxide.
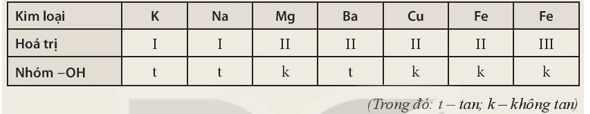
Trả lời:
- Base không tan và tên gọi tương ứng:
+ Mg(OH)2: magnesium hydroxide.
+ Cu(OH)2: copper(II) hydroxide.
+ Fe(OH)2: iron(II) hydroxide.
+ Fe(OH)3: iron(III) hydroxide.
- Base tan (base kiềm) và tên gọi tương ứng:
+ KOH: potassium hydroxide.
+ NaOH: sodium hydroxide.
+ Ba(OH)2: barium hydroxide.
Hoạt động trang 40 KHTN 8: Tính chất hoá học của base
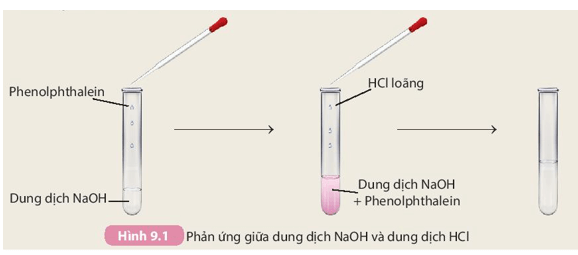
Thí nghiệm 1: Nhỏ 1 – 2 giọt dung dịch NaOH vào mẩu giấy quỳ tím.
Quan sát hiện tượng và thực hiện các yêu cầu sau:
2. Nêu hiện tượng xảy ra ở thí nghiệm 2 và rút ra nhận xét.
Trả lời:
1. Dung dịch kiềm làm đổi màu giấy quỳ tím thành màu xanh, đổi màu dung dịch phenolphthalein thành màu hồng.
2. Hiện tượng xảy ra ở thí nghiệm 2:
Ban đầu hỗn hợp trong ống nghiệm có màu hồng, sau khi nhỏ từ từ HCl vào hỗn hợp nhạt màu dần đến mất màu.
Nhận xét: Dung dịch kiềm phản ứng được với dung dịch acid.
Trả lời:
Sử dụng giấy quỳ tím để thử:
+ Dung dịch làm quỳ tím chuyển sang màu xanh là NaOH.
+ Dung dịch làm quỳ tím chuyển sang màu đỏ là HCl.
Trả lời:
Tác dụng của vôi bột là khử chua cho đất. Khi bón vôi bột lên ruộng, vôi bột tác dụng với nước tạo thành Ca(OH)2.
Ca(OH)2 tác dụng với acid có trong đất, khử chua cho đất.
Câu hỏi 1 trang 43 KHTN 8: Hãy nêu cách để kiểm tra đất trồng có bị chua hay không.
Trả lời:
Để kiểm tra đất trồng có bị chua hay không tiến hành như sau: Lấy mẫu đất trồng sau đó hoà mẫu đất trồng vào nước cất được huyền phù. Lọc lấy phần dung dịch rồi đem thử pH bằng máy đo pH hoặc giấy đo pH.
Nếu giá trị pH thu được nhỏ hơn 7 chứng tỏ đất trồng bị chua.
Trả lời:
- Giá trị pH trong máu, trong dịch dạ dày của người, trong nước mưa, trong đất:
+ Trong cơ thể người, pH của máu luôn được duy trì ổn định trong phạm vi khoảng 7,35 – 7,45.
+ Dịch vị dạ dày của con người chứa acid HCl với pH dao động khoảng 1,5 – 3,5.
+ Nước mưa bình thường mà chúng ta hay sử dụng có giá trị pH rơi vào khoảng 5,6. Cụ thể hơn, tại thành phố, giá trị pH nước mưa dao động từ 4,67 – 7,5. Và tại các khu công nghiệp, nước mưa có giá trị pH trung bình khoảng 4,72, thường dao động từ 3,8 – 5,3.
+ Đất thích hợp cho trồng trọt có giá trị pH trong khoảng từ 5 – 8.
- Trong cơ thể người, máu và dịch dạ dày … đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khoẻ. Nếu chỉ số pH tăng hoặc giảm đột ngột (ngoài khoảng chuẩn) thì là dấu hiệu ban đầu của bệnh lí.
+ Nếu giá trị pH dạ dày cao hơn khoảng chuẩn sẽ khiến cho tình trạng tiêu hóa khó khăn, các vi khuẩn sẽ dễ sinh sôi hơn trong hệ tiêu hóa và tăng nguy cơ gây ra các bệnh đường tiêu hóa … Nếu giá trị pH trong dạ dày thấp hơn khoảng chuẩn sẽ gây ra các vấn đề như đắng miệng, ợ chua, ợ hơi, nóng trong lồng ngực, đau dạ dày, viêm loét dạ dày, xuất huyết tiêu hóa,…
+ Nếu có pH máu ngoài khoảng chuẩn, có thể bắt đầu gặp các triệu chứng nhất định. Các triệu chứng gặp phải sẽ phụ thuộc vào việc máu có tính acid hơn hay kiềm hơn. Một số triệu chứng nhiễm toan (máu có tính acid) bao gồm: đau đầu; lú lẫn; mệt mỏi; buồn ngủ; ho và khó thở; nhịp tim không đều hoặc tăng; đau bụng; yếu cơ … Các triệu chứng nhiễm kiềm bao gồm: lú lẫn và chóng mặt; run tay; tê hoặc ngứa ran ở bàn chân, bàn tay hoặc mặt; co thắt các cơ; nôn hoặc buồn nôn …
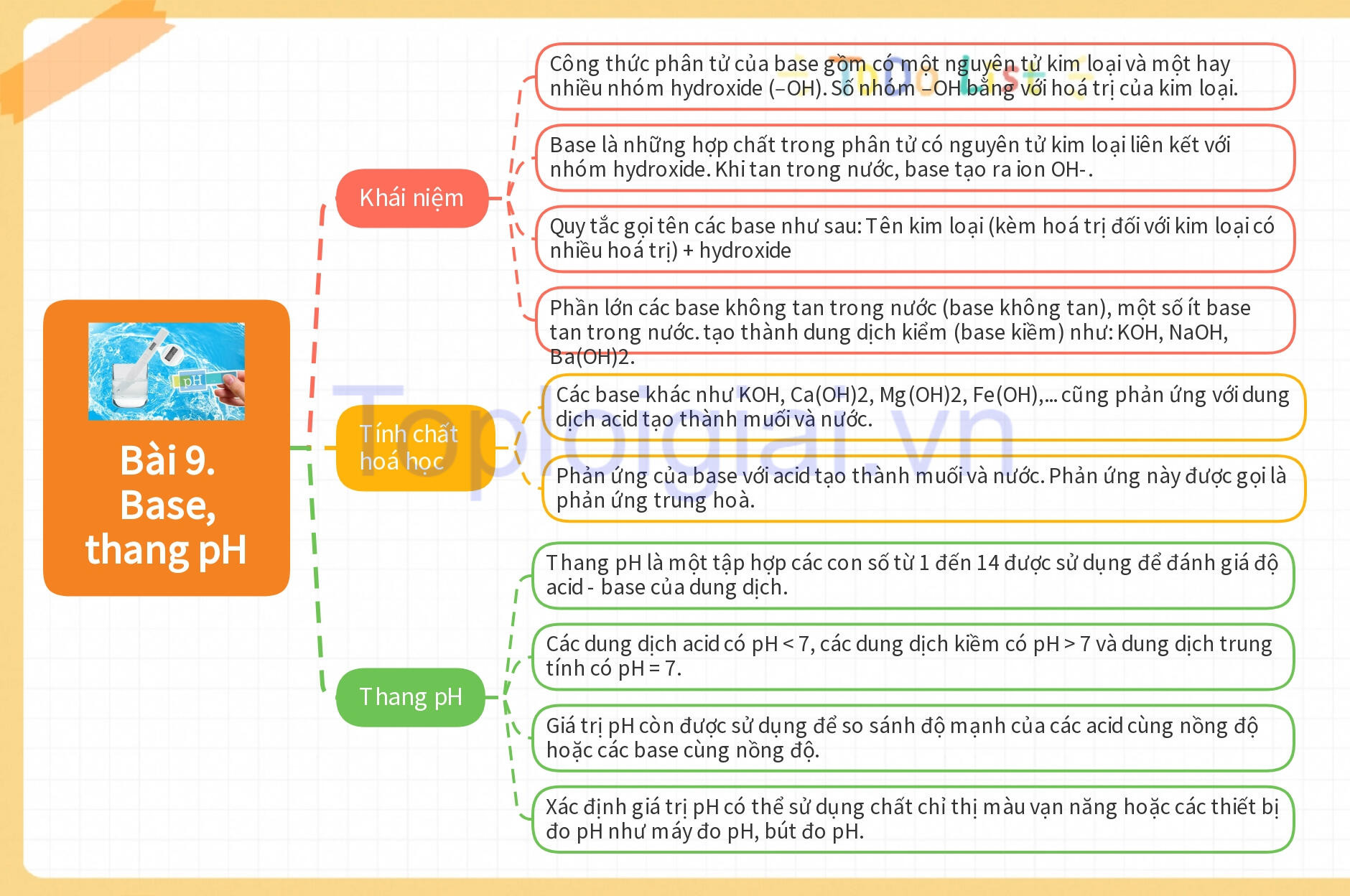
Kiến thức trọng tâm KHTN 8 Bài 9: Base, thang pH
- Tương tự acid, base cũng là một trong những hợp chất phổ biến.
- Công thức phân tử của base gồm có một nguyên tử kim loại và một hay nhiều nhóm hydroxide (–OH). Số nhóm –OH bằng với hoá trị của kim loại.
- Khái niệm về base được phát biểu như sau: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH-.
- Hầu hết các hydroxide của kim loại là các base. Quy tắc gọi tên các base như sau:
- Tên kim loại (kèm hoá trị đối với kim loại có nhiều hoá trị) + hydroxide
Ví dụ: Fe(OH) : iron(II) hydroxide;
Fe(OH)3: iron(III) hydroxide.
- Phần lớn các base không tan trong nước (base không tan), một số ít base tan trong nước. tạo thành dung dịch kiểm (base kiềm) như: KOH, NaOH, Ba(OH)2.
- Tính chất hoá học của base
+ Chuẩn bị: Dung dịch NaOH loãng, dung dịch HCl loãng, giấy quỳ tím, dung dịch phenolphthalein; ống nghiệm, ống hút nhỏ giọt.
+ Các base khác như KOH, Ca(OH)2, Mg(OH)2, Fe(OH),... cũng phản ứng với dung dịch acid tạo thành muối và nước.
+ Phản ứng của base với acid tạo thành muối và nước. Phản ứng này được gọi là phản ứng trung hoà.
Ví dụ: Ca(OH)2 +H2SO4→ CaSO4 + 2H2O.
- Thang pH là một tập hợp các con số từ 1 đến 14 được sử dụng để đánh giá độ acid - base của dung dịch.

- Các dung dịch acid có pH < 7, các dung dịch kiềm có pH > 7 và dung dịch trung tính có pH = 7.
- Giá trị pH còn được sử dụng để so sánh độ mạnh của các acid cùng nồng độ hoặc các base cùng nồng độ.
- Xác định giá trị pH có thể sử dụng chất chỉ thị màu vạn năng hoặc các thiết bị đo pH như máy đo pH, bút đo pH.
Sơ đồ tư duy KHTN 8 Bài 9: Base, thang pH
Xem thêm lời giải bài tập Khoa học tự nhiên 8 Kết nối tri thức hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn 8 Kết nối tri thức (hay nhất)
- Văn mẫu lớp 8 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 8 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 8 - Kết nối tri thức
- Giải SBT Ngữ văn 8 – Kết nối tri thức
- Giải Vở thực hành Ngữ văn 8 Kết nối tri thức | VTH Ngữ văn 8 Tập 1, Tập 2
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Soạn văn 8 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 8 – Kết nối tri thức
- Lý thuyết Toán 8 – Kết nối tri thức
- Giải sbt Toán 8 – Kết nối tri thức
- Vở thực hành Toán 8 Kết nối tri thức | Giải VTH Toán 8 Tập 1, Tập 2
- Chuyên đề dạy thêm Toán 8 cả 3 sách (2024 có đáp án)
- Bài tập Tiếng Anh 8 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 8 – Global success
- Giải sbt Tiếng Anh 8 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 8 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 Global success
- Giải sgk Lịch sử 8 – Kết nối tri thức
- Lý thuyết Lịch sử 8 - Kết nối tri thức
- Giải sbt Lịch sử 8 – Kết nối tri thức
- Giải sgk Địa lí 8 – Kết nối tri thức
- Lý thuyết Địa lí 8 - Kết nối tri thức
- Giải sbt Địa lí 8 – Kết nối tri thức
- Giải VTH Địa lí 8 Kết nối tri thức | Vở thực hành Địa lí 8
- Giải sgk Giáo dục công dân 8 – Kết nối tri thức
- Lý thuyết Giáo dục công dân 8 – Kết nối tri thức
- Giải sbt Giáo dục công dân 8 – Kết nối tri thức
- Giải sgk Công nghệ 8 – Kết nối tri thức
- Lý thuyết Công nghệ 8 - Kết nối tri thức
- Giải sbt Công nghệ 8 – Kết nối tri thức
- Giải sgk Tin học 8 – Kết nối tri thức
- Lý thuyết Tin học 8 - Kết nối tri thức
- Giải sbt Tin học 8 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 8 – Kết nối tri thức