Giải KHTN 8 Bài 4 (Kết nối tri thức): Dung dịch và nồng độ
Với lời giải bài tập Khoa học tự nhiên lớp 8 Bài 4: Dung dịch và nồng độ sách Kết nối tri thức hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 8 Bài 4.
Giải KHTN 8 Bài 4: Dung dịch và nồng độ
Trả lời:
Để định lượng một dung dịch đặc hay loãng, người ta dùng đại lượng nồng độ. Có hai loại nồng độ dung dịch thường dùng là nồng độ phần trăm và nồng độ mol.
+ Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch.
+ Nồng độ mol (kí hiệu CM) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
I. Dung dịch, chất tan và dung môi
Hoạt động trang 20 KHTN 8: Nhận biết dung dịch, chất tan và dung môi
- Cho khoảng 20 mL nước vào bốn cốc thuỷ tinh, đánh số (1), (2), (3) và (4).
2. Phần dung dịch ở cốc (4) có phải là dung dịch bão hoà ở nhiệt độ phòng không? Giải thích.
Trả lời:
1. Cốc (1) và cốc (2) chứa dung dịch. Do hai cốc này là hỗn hợp đồng nhất của chất tan và dung môi.
+ Cốc (1): chất tan là muối ăn; dung môi là nước.
+ Cốc (2): chất tan là copper(II) sulfate; dung môi là nước.
2. Phần dung dịch ở cốc (4) là dung dịch bão hoà ở nhiệt độ phòng. Do ở điều kiện này dung dịch không thể hoà tan thêm chất tan được nữa.
Trả lời:
Cho dần dần sodium carbonate (Na2CO3) vào cốc chứa một lượng nước xác định (giả sử 200 mL). Khuấy đều cho đến khi Na2CO3 không thể hoà tan thêm được nữa. Tách bỏ chất rắn không tan, ta thu được dung dịch bão hoà.
II. Độ tan
Trả lời:
Độ tan của muối X được tính theo công thức:
S=mctmH2O.100
Trong đó: mnước = 20 gam; mct = 12 – 5 = 7 gam.
Vậy S=720.100=35 (g/100 g nước).
Trả lời:
Độ tan của Na2CO3 trong nước ở 18 oC là:
S=mctmH2O.100=53250.100=21,2(g/ 100 g nước).
III. Nồng độ dung dịch
Câu hỏi 1 trang 22 KHTN 8: Tính khối lượng H2SO4 có trong 20 gam dung dịch H2SO4 98%.
Trả lời:
Nồng độ phần trăm được xác định bằng biểu thức:
C%=mctmdd.100%
Vậy khối lượng H2SO4 có trong 20 gam dung dịch H2SO4 98% là:
mct=C%.mdd100%=98%.20100%=19,6 (gam).
a) Tính số mol urea trong dung dịch A, B và C.
Trả lời:
Nồng độ mol được xác định bằng biểu thức: CM=nV⇒n=CM.V
a) Số mol urea trong dung dịch A là: n(A) = 0,02 . 2 = 0,04 (mol).
Số mol urea trong dung dịch B là: n(B) = 0,1 . 3 = 0,3 (mol).
Số mol urea trong dung dịch C là: n(C) = 0,04 + 0,3 = 0,34 (mol).
b) Nồng độ mol của dung dịch C là: CM(C)=0,345=0,068 (M).
Ta có: Nồng độ mol của dung dịch A < Nồng độ mol của dung dịch C < Nồng độ mol của dung dịch B.
Hoạt động trang 22 KHTN 8: Pha 100 gam dung dịch muối ăn nồng độ 0,9%
Chuẩn bị: muối ăn khan, nước cất; cốc thuỷ tinh, cân, ống đong.
- Xác định khối lượng muối ăn (m1) và nước (m2) dựa vào công thức:
- Cân m1 gam muối ăn rồi cho vào cốc thuỷ tinh.
- Cân m2 gam nước cất, rót vào cốc, lắc đều cho muối tan hết.
1. Tại sao phải dùng muối ăn khan để pha dung dịch?
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng để làm gì?
Trả lời:
1. Dùng muối ăn khan pha dung dịch để xác định được chính xác khối lượng chất tan.
2. Dung dịch muối ăn nồng độ 0,9% có thể được dùng với các mục đích khác nhau như:
- Làm thuốc nhỏ mắt, thuốc nhỏ mũi, thuốc nhỏ tai, súc miệng và rửa vết thương, giúp làm sạch, loại bỏ chất bẩn, vi khuẩn, ngăn ngừa viêm nhiễm…
- Dùng làm dịch truyền vào cơ thể để điều trị tình trạng mất nước do một số bệnh lí gây ra như đái tháo đường, viêm dạ dày …
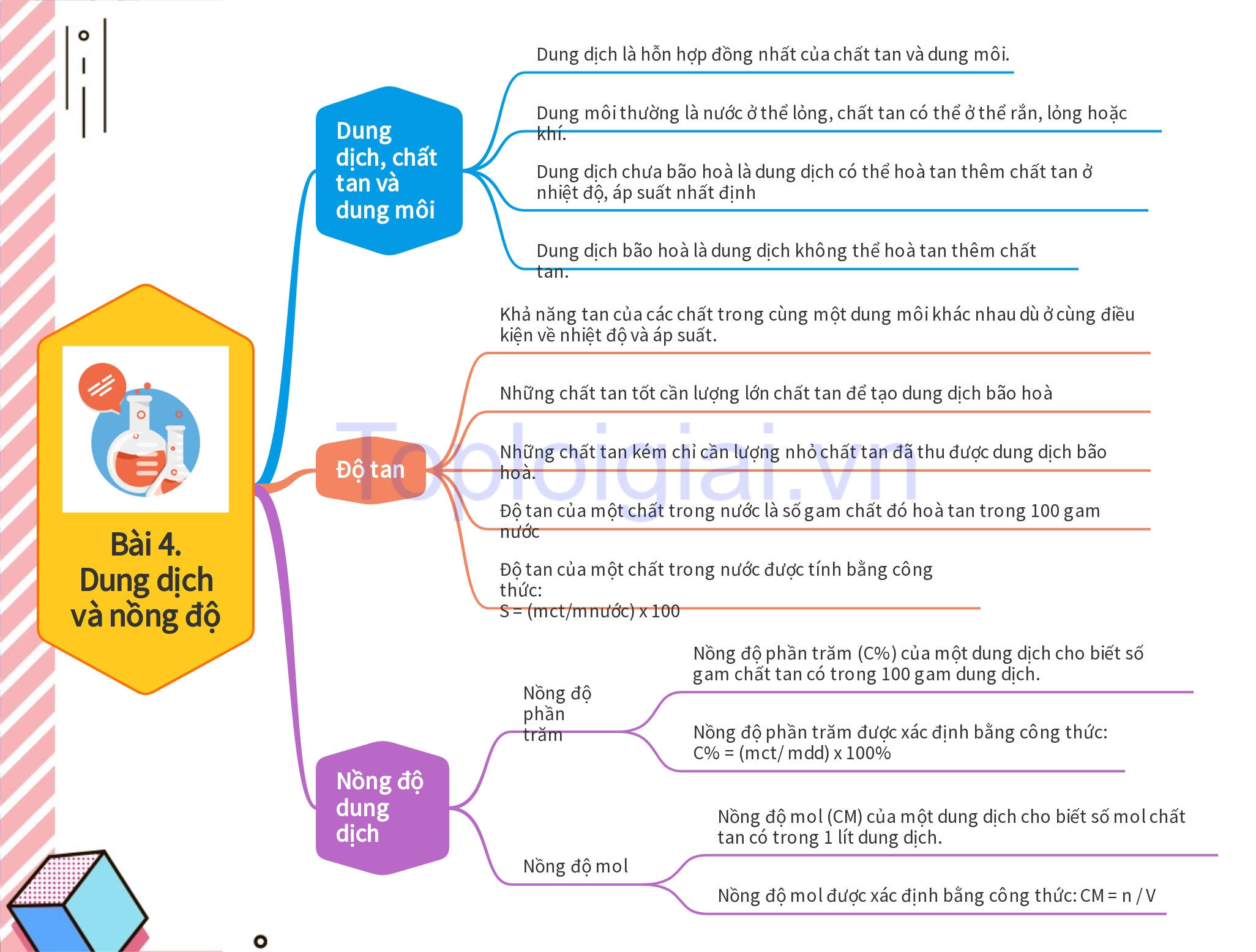
Kiến thức trọng tâm KHTN 8 Bài 4: Dung dịch và nồng độ
I. Dung dịch, chất tan và dung môi
- Dung dịch là hỗn hợp đồng nhất của chất tan và dung môi.
- Dung môi thường là nước ở thể lỏng, chất tan có thể ở thể rắn, lỏng hoặc khí.
- Dung dịch chưa bão hoà là dung dịch có thể hoà tan thêm chất tan ở nhiệt độ, áp suất nhất định, còn dung dịch bão hoà là dung dịch không thể hoà tan thêm chất tan.

- Khả năng tan của các chất trong cùng một dung môi khác nhau dù ở cùng điều kiện về nhiệt độ và áp suất.
- Những chất tan tốt cần lượng lớn chất tan để tạo dung dịch bão hoà, còn những chất tan kém chỉ cần lượng nhỏ chất tan đã thu được dung dịch bão hoà.
- Độ tan của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ở nhiệt độ, áp suất xác định.
- Độ tan của một chất trong nước được tính bằng công thức: S = (mct/mnước) x 100, trong đó S là độ tan, đơn vị g/100 g nước; mct là khối lượng chất tan, đơn vị là gam (g); mnước là khối lượng nước, đơn vị là gam (g).
- Nồng độ dung dịch là đại lượng được sử dụng để định lượng một dung dịch đặc hay loãng. Có hai loại nồng độ dung dịch thường dùng là nồng độ phần trăm và nồng độ mol.
- Nồng độ phần trăm:
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Nồng độ phần trăm được xác định bằng công thức:
C% = (mct/ mdd) x 100%
Trong đó: C% là nồng độ phần trăm của dung dịch, đơn vị %; mct là khối lượng chất tan, đơn vị là gam (g); mdd là khối lượng dung dịch, đơn vị là gam (g).
- Nồng độ mol:
Nồng độ mol (CM) của một dung dịch cho biết số mol chất tan có trong 1 lít dung dịch. Nồng độ mol được xác định bằng công thức:
CM = n / V
Trong đó: CM là nồng độ mol của dung dịch, có đơn vị là mol/l và thường được biểu diễn là M; n là số mol chất tan, đơn vị là mol; V là thể tích dung dịch, đơn vị là lít (L).
Sơ đồ tư duy KHTN 8 Bài 4: Dung dịch và nồng độ
Xem thêm lời giải bài tập KHTN 8 Kết nối tri thức hay, chi tiết khác:
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
Bài 6: Tính theo phương trình hóa học
Xem thêm các chương trình khác:
- Soạn văn 8 Kết nối tri thức (hay nhất)
- Văn mẫu lớp 8 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 8 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn lớp 8 - Kết nối tri thức
- Giải SBT Ngữ văn 8 – Kết nối tri thức
- Giải Vở thực hành Ngữ văn 8 Kết nối tri thức | VTH Ngữ văn 8 Tập 1, Tập 2
- Nội dung chính tác phẩm Ngữ văn lớp 8 – Kết nối tri thức
- Soạn văn 8 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 8 – Kết nối tri thức
- Lý thuyết Toán 8 – Kết nối tri thức
- Giải sbt Toán 8 – Kết nối tri thức
- Vở thực hành Toán 8 Kết nối tri thức | Giải VTH Toán 8 Tập 1, Tập 2
- Chuyên đề dạy thêm Toán 8 cả 3 sách (2024 có đáp án)
- Bài tập Tiếng Anh 8 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 8 – Global success
- Giải sbt Tiếng Anh 8 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 8 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 8 Global success
- Giải sgk Lịch sử 8 – Kết nối tri thức
- Lý thuyết Lịch sử 8 - Kết nối tri thức
- Giải sbt Lịch sử 8 – Kết nối tri thức
- Giải sgk Địa lí 8 – Kết nối tri thức
- Lý thuyết Địa lí 8 - Kết nối tri thức
- Giải sbt Địa lí 8 – Kết nối tri thức
- Giải VTH Địa lí 8 Kết nối tri thức | Vở thực hành Địa lí 8
- Giải sgk Giáo dục công dân 8 – Kết nối tri thức
- Lý thuyết Giáo dục công dân 8 – Kết nối tri thức
- Giải sbt Giáo dục công dân 8 – Kết nối tri thức
- Giải sgk Công nghệ 8 – Kết nối tri thức
- Lý thuyết Công nghệ 8 - Kết nối tri thức
- Giải sbt Công nghệ 8 – Kết nối tri thức
- Giải sgk Tin học 8 – Kết nối tri thức
- Lý thuyết Tin học 8 - Kết nối tri thức
- Giải sbt Tin học 8 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 8 – Kết nối tri thức

