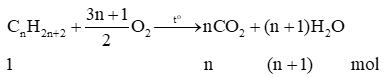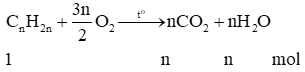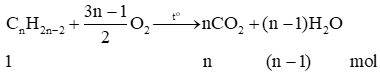Giải Hóa 11 trang 89 Cánh diều
Với giải bài tập Hóa học lớp 11 trang 89 trong Bài 13: Hydrocarbon không no sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 trang 89.
Giải Hóa 11 trang 89 Cánh diều
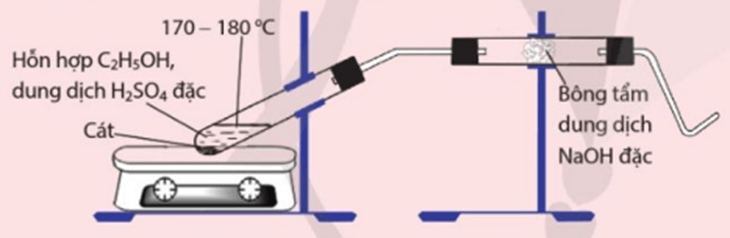
Thí nghiệm 1 trang 89 Hóa học 11: Điều chế và thử tính chất của ethylene
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.
Lời giải:
Hiện tượng: có khí sinh ra, khí này làm mất màu dung dịch bromine, làm mất màu thuốc tím. Đốt khí thoát ra ở đầu ống dẫn khí, thấy khí cháy và toả nhiều nhiệt.
Phương trình hoá học giải thích hiện tượng:
C2H5OH H2SO4,to→ CH2 = CH2 + H2O
CH2 = CH2 + Br2 → CH2Br – CH2Br
3CH2 = CH2 + 2KMnO4 + 4H2O → 3HO – CH2 – CH2 – OH + 2MnO2 + 2KOH
C2H4 + 3O2 to→ 2CO2 + 2H2O.
Đun ethanol với sulfuric acid đặc sinh ra khí ethylene; dẫn tiếp khí qua ống nghiệm đựng Br2 (hoặc thuốc tím) thấy dung dịch Br2 (hoặc dung dịch KMnO4) nhạt dần đến mất màu do liên kết pi ở liên kết đôi của ethylene kém bền vững.
Thí nghiệm 2 trang 89 Hóa học 11: Điều chế và thử tính chất của acetylene
Yêu cầu: Quan sát, viết phương trình hoá học và giải thích hiện tượng xảy ra.
Lời giải:
Hiện tượng: Đất đèn (thành phần chính CaC2) tác dụng với nước sinh ra khí acetylene (C2H2). Dẫn acetylene vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 thấy các dung dịch này nhạt dần đến mất màu do liên kết pi ở acetylene kém bền vững.
Khi đốt acetylene cháy, toả nhiều nhiệt.
Phương trình hoá học minh hoạ:
CaC2 + 2H2O → Ca(OH)2 + C2H2
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
C2H2+52O2to→2CO2+H2O
Lời giải:
Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
Sử dụng dung dịch AgNO3/ NH3 (dung dịch silver nitrate trong ammonia) làm thuốc thử.
Nếu xuất hiện kết tủa vàng → hex – 1 – yne. Phương trình hoá học:
CH3[CH2]3C ≡ CH + Ag(NH3)2OH → CH3[CH2]3C ≡ CAg + 2NH3 + H2O.
Không có hiện tượng gì xuất hiện → hex – 2 – yne.
Lời giải:
- Phản ứng cháy hoàn toàn của alkane:
Trong phản ứng đốt cháy hoàn toàn alkane: nH2O>nCO2
- Phản ứng cháy hoàn toàn của alkene:
Trong phản ứng đốt cháy hoàn toàn alkene: nH2O=nCO2
- Phản ứng đốt cháy hoàn toàn alkyne:
Trong phản ứng đốt cháy hoàn toàn alkene: nH2O<nCO2
a) Viết phương trình hoá học của phản ứng xảy ra.
Lời giải:
a) Phương trình hoá học của phản ứng xảy ra:
C2H5OH H2SO4,to→ CH2 = CH2 + H2O
b) Khí ethylene sinh ra có thể có lẫn các tạp chất như CO2, SO2… bông tẩm dung dịch NaOH đặc có tác dụng loại bỏ các tạp chất này.
Phương trình hoá học minh hoạ:
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O.
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 82 Hóa học 11: Cho công thức cấu tạo của các chất dưới đây:
Luyện tập 2 trang 83 Hóa học 11: Gọi tên các chất có công thức cấu tạo sau:
Vận dụng 1 trang 84 Hóa học 11: Thêm hex – 1 – ene
Câu hỏi 4 trang 85 Hóa học 11: Năng lượng liên kết của liên kết
Câu hỏi 6 trang 87 Hóa học 11: Viết phương trình hoá học của phản ứng trùng hợp propene.
Thí nghiệm 1 trang 89 Hóa học 11: Điều chế và thử tính chất của ethylene
Thí nghiệm 2 trang 89 Hóa học 11: Điều chế và thử tính chất của acetylene
Vận dụng 2 trang 89 Hóa học 11: Hãy trình bày cách phân biệt hex – 1 – yne (CH3[CH2]3C ≡ CH)
Bài 1 trang 91 Hóa học 11: Viết công thức cấu tạo của các chất có tên dưới đây
Bài 4 trang 91 Hóa học 11: Cho các đoạn mạch polymer như ở dưới đây:
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 11: Cấu tạo hoá học của hợp chất hữu cơ
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều