Giải Hóa 11 trang 24 Cánh diều
Với giải bài tập Hóa học lớp 11 trang 24 trong Bài 3: PH của dung dịch. Chuẩn độ acid – base sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 trang 24.
Giải Hóa 11 trang 24 Cánh diều
Lời giải:
nHCl=10.x1000(mol); nNaOH=50.0,51000=0,025 (mol)
Phương trình hoá học:
HCl + NaOH → NaCl + H2O
Theo phương trình hoá học ta có:
nHCl = nNaOH ⇒ 10.x1000=0,025 ⇒x=2,5.
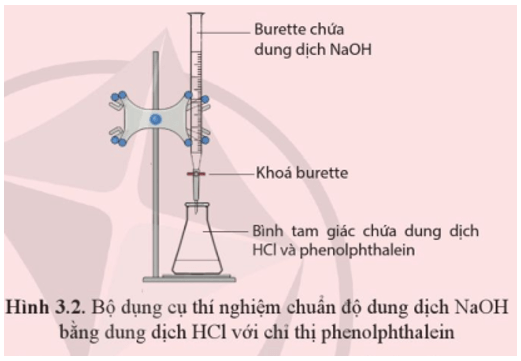
Tiến hành: Burette (loại 25 mL) đã được đổ đầy đến vạch 0 bằng dung dịch NaOH và chắc chắn không còn bọt khí trong burette. Cho 10 mL dung dịch chuẩn HCl vào bình tam giác (loại 100 mL), thêm 2 giọt chỉ thị phenolphthalein (loại 1% pha trong cồn).
Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình. Tiếp tục nhỏ dung dịch NaOH (vẫn duy trì lắc đều bình) cho tới khi dung dịch trong bình chuyển từ không màu sang hồng và bền trong ít nhất 20 giây thì kết thúc chuẩn độ (khoá burette). Ghi lại thể tích NaOH đã dùng. Lặp lại thí nghiệm ít nhất 3 lần.
Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học và xác định nồng độ dung dịch NaOH.
Lời giải:
Hiện tượng: Ban đầu dung dịch trong bình tam giác không có màu. Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình thấy dung dịch trong bình chuyển từ không màu sang hồng.
Phương trình hoá học: NaOH + HCl → NaCl + H2O.
Xác định nồng độ dung dịch NaOH: Học sinh tự xác định theo kết quả chuẩn độ trên lớp.
Lời giải:
Trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl, ta kết thúc chuẩn độ ngay khi dung dịch trong bình tam giác chuyển từ không màu sang hồng (bền trong ít nhất 20 giây) do đã đạt tới điểm tương đương.
Lời giải:
NaOH + HCl → NaCl + H2O
Ta có: VHCl. CHCl = VNaOH. CNaOH
⇒CNaOH=VHCl.CHClVNaOH=10.0,110,27=0,097 M.
Lời giải:
Chuẩn bị:
- Bắp cải tím thái nhỏ (khoảng 100 g).
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Các cốc (đã được dán nhãn) đựng các acid và base thích hợp.
- Giấy pH hoặc máy đo pH.
Tiến hành:
– Ngâm khoảng 100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
– Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch acid, base đã chuẩn bị.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch acid, base đã chuẩn bị và khuấy đều. Quan sát sự đổi màu của các dung dịch.
Từ đó thiết lập được bảng màu của nước ép bắp cải tím theo pH như sau:
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Câu hỏi 1 trang 21 Hoá học 11: Giải thích vì sao nước nguyên chất có môi trường trung tính.
Luyện tập 1 trang 21 Hoá học 11: Sử dụng máy tính cầm tay để tính:
Xem thêm lời giải bài tập Hóa học lớp 11 Cánh diều hay, chi tiết khác:
Bài 5: Một số hợp chất quan trọng của nitrogen
Bài 6: Sulfur và sulfur dioxide
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Cánh diều (hay nhất)
- Văn mẫu lớp 11 - Cánh diều
- Tóm tắt tác phẩm Ngữ văn 11 – Cánh diều
- Tác giả tác phẩm Ngữ văn 11 - Cánh diều
- Giải SBT Ngữ văn 11 – Cánh diều
- Bố cục tác phẩm Ngữ văn 11 – Cánh diều
- Giải Chuyên đề học tập Ngữ văn 11 – Cánh diều
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Cánh diều
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 – Cánh diều
- Giải Chuyên đề học tập Toán 11 – Cánh diều
- Lý thuyết Toán 11 - Cánh diều
- Giải sbt Toán 11 – Cánh diều
- Giải sgk Tiếng Anh 11 – ilearn Smart World
- Giải sbt Tiếng Anh 11 - ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 11 ilearn Smart World đầy đủ nhất
- Giải sgk Vật lí 11 – Cánh diều
- Lý thuyết Vật lí 11 – Cánh diều
- Giải sbt Vật lí 11 – Cánh diều
- Giải Chuyên đề học tập Vật lí 11 – Cánh diều
- Giải sgk Sinh học 11 – Cánh diều
- Lý thuyết Sinh học 11 – Cánh diều
- Giải Chuyên đề học tập Sinh học 11 – Cánh diều
- Giải sbt Sinh học 11 – Cánh diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Cánh diều
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Cánh diều
- Lý thuyết Kinh tế pháp luật 11 – Cánh diều
- Giải sbt Kinh tế pháp luật 11 – Cánh diều
- Giải sgk Lịch sử 11 – Cánh diều
- Giải Chuyên đề học tập Lịch sử 11 – Cánh diều
- Lý thuyết Lịch sử 11 - Cánh diều
- Giải sbt Lịch sử 11 – Cánh diều
- Giải sgk Địa lí 11 – Cánh diều
- Giải Chuyên đề học tập Địa lí 11 – Cánh diều
- Lý thuyết Địa lí 11 - Cánh diều
- Giải sbt Địa lí 11 – Cánh diều
- Giải sgk Công nghệ 11 – Cánh diều
- Lý thuyết Công nghệ 11 - Cánh diều
- Giải sbt Công nghệ 11 – Cánh diều
- Giải sgk Tin học 11 – Cánh diều
- Giải Chuyên đề học tập Tin học 11 – Cánh diều
- Lý thuyết Tin học 11 - Cánh diều
- Giải sbt Tin học 11 – Cánh diều
- Giải sgk Giáo dục quốc phòng an ninh 11 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 11 – Cánh diều
- Giải sbt Giáo dục quốc phòng 11 – Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 – Cánh diều