Giải Hóa 10 Bài 13 ( Chân trời sáng tạo ): Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Với giải bài tập Hóa 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 13.
Giải bài tập Hóa lớp 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Lời giải:
Các phản ứng kèm theo sự thay đổi năng lượng rất phổ biến như: phản ứng đốt nhiên liệu, phản ứng tạo gỉ sắt, phản ứng trong lò nung vôi ….
Trong đó nhiều phản ứng đem lại lợi ích quan trọng, gắn liền với cuộc sống như:
- Phản ứng đốt cháy than tỏa một lượng nhiệt lớn giúp đun nấu và sưởi ấm.
- Phản ứng nhiệt nhôm tỏa ra một lượng nhiệt lớn được ứng dụng để hàn đường ray, hàn nối các thanh kim loại đồng, hàn thép không gỉ, gang …
1. Phản ứng tỏa nhiệt
Lời giải:
- Phương trình hóa học của phản ứng nhiệt nhôm để hàn đường ray:
2Al + Fe2O3 →t°Al2O3 + 2Fe
- Nhận xét về sự thay đổi nhiệt: Phản ứng nhiệt nhôm tỏa nhiệt rất lớn (trên 2 500oC), làm nóng chảy hỗn hợp và sắt sinh ra từ phản ứng lấp đầy khe hở.
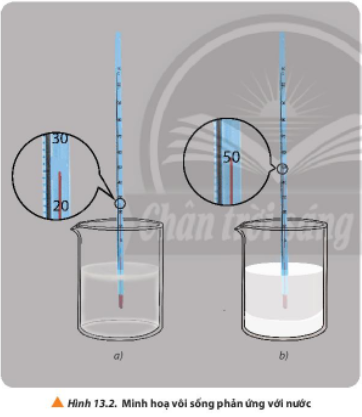
Thí nghiệm 1: Sự thay đổi nhiệt độ khi vôi sống phản ứng với nước.
Dụng cụ và thiết bị: Cốc chịu nhiệt 500 mL, cân, nhiệt kế, đũa thủy tinh, giá đỡ nhiệt kế.
Hóa chất: Vôi sống (CaO), nước cất.
Bước 3: Ghi nhận giá trị nhiệt độ sau khoảng 2 phút.
Lời giải:
- Hiện tượng:
+ Ở bước 1, ghi nhận giá trị của nhiệt kế là khoảng 25oC.
+ Ở bước 2, CaO màu trắng tan trong nước, nhiệt độ tăng dần trên trên nhiệt kế.
+ Sau 2 phút ghi nhận giá trị của nhiệt kế là khoảng 50oC.
- Kết luận: Nhiệt độ chất lỏng trong cốc tăng lên từ 25oC đến 50oC
- Giải thích: CaO đã phản với nước theo phương trình: CaO + H2O → Ca(OH)2
Phản ứng này tỏa nhiệt nên làm nhiệt độ chất lỏng trong cốc tăng.
Lời giải:
- Hiện tượng: Cả than và ethanol đều cháy trong không khí, tuy nhiên ethanol dễ cháy hoàn toàn hơn.
- Phương trình hóa học:
+ Đốt cháy than: C + O2 CO2
+ Đốt cháy ethanol: C2H6O + 3O2 2CO2 + 3H2O
- Cả hai quá trình trên đều làm nhiệt độ môi trường xung quanh tăng lên.
2. Phản ứng thu nhiệt
Lời giải:
Dự đoán sự thay đổi nhiệt độ của nước trong cốc:
Khi thả viên vitamin C sủi vào cốc nước, viên C sủi tan, thấy nước trong cốc mát hơn.
Lời giải:
Phản ứng nung đá vôi (CaCO3) là phản ứng thu nhiệt, nếu ngừng cung cấp nhiệt phản ứng sẽ không tiếp tục xảy ra.
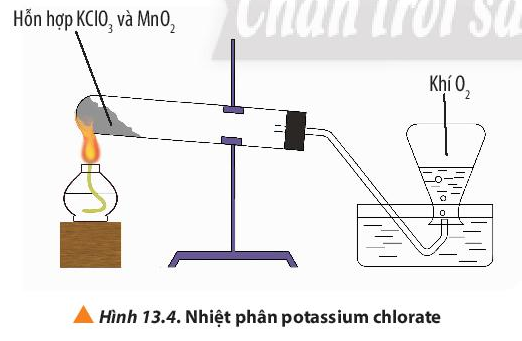
Thí nghiệm 2: Nhiệt phân potassium chlorate
Hóa chất: Potassium chlorate (KClO3), manganese dioxide (MnO2)
Phương trình hóa học của phản ứng:
Lời giải:
- Hiện tượng:
+ Trước khi đốt nóng hỗn hợp không có hiện tượng gì xảy ra.
+ Sau khi đốt nóng, thấy hỗn hợp chất rắn trong ống nghiệm bị phân hủy, có bọt khí nổi lên và đẩy nước ra khỏi bình tam giác.
- Nếu ngừng đốt nóng thì phản ứng dừng lại, khí không được sinh ra thêm nữa.
3. Biến thiên enthalpy chuẩn của phản ứng
Lời giải:
Biến thiên enthalpy chuẩn của một phản ứng hóa học được xác định trong điều kiện chuẩn: Áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
Câu hỏi 7 trang 82 Hóa học 10: Phương trình nhiệt hóa học cho biết thông tin gì về phản ứng hóa học.
Lời giải:
Phương trình nhiệt hóa học cho biết:
- Nhiệt phản ứng (nhiệt lượng tỏa ra hay thu vào của phản ứng), cụ thể:
∆rH > 0: Phản ứng thu nhiệt.
∆rH < 0: Phản ứng tỏa nhiệt.
- Trạng thái của các chất đầu (cđ) và sản phẩm (sp), cụ thể:
(s): rắn
(aq): dung dịch
(l): lỏng
(g): khí.
Ví dụ:
CH4 (g) + H2O (l) CO (g) + 3H2 (g)
∆ r= 250 kJ.
Luyện tập trang 82 Hóa học 10: Cho hai phương trình nhiệt hóa học sau:
C(s) + H2O(g) CO(g) + H2(g) ∆ r = +131,25 kJ (1)
CuSO4 (aq) + Zn(s) → ZnSO4(aq) + Cu(s) ∆ r = -231,04 kJ (2)
Trong hai phản ứng trên, phản ứng nào là thu nhiệt, phản ứng nào là tỏa nhiệt?
Lời giải:
Phản ứng (1) là thu nhiệt vì ∆ r = +131,25 kJ > 0.
Phản ứng (2) là tỏa nhiệt vì ∆ r = -231,04 kJ < 0.
4. Enthalpy tạo thành (nhiệt tạo thành)
Lời giải:
|
Enthalpy tạo thành của một chất |
Enthalpy của phản ứng |
|
- Nhiệt lượng tỏa ra hay thu vào của phản ứng tạo thành 1 mol chất từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định. - Các chất tham gia phải ở dạng đơn chất bền nhất, sản phẩm thu được chỉ có 1 chất. - Kí hiệu: ∆fH |
- Nhiệt lượng tỏa ra hay thu vào của phản ứng trong điều kiện áp suất không đổi.
- Sản phẩm có thể là 1 hay nhiều chất, các chất tham gia có thể ở dạng đơn chất hoặc hợp chất. - Kí hiệu: ∆rH |
|
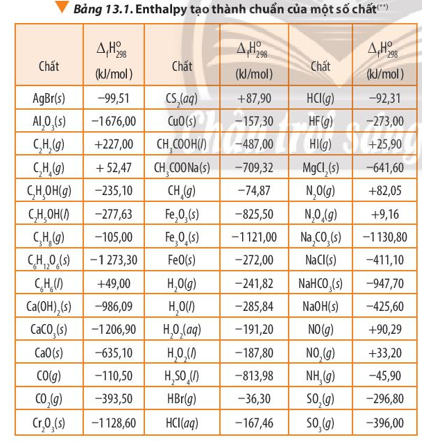
Ví dụ: C (graphite) + O2(g) CO2 (g) ∆ f(CO2, g) = -393,50 kJ/mol Carbon dạng graphite, oxygen dạng phân tử khí là các dạng đơn chất bền nhất của carbon và oxygen. |
Ví dụ: C(s) + H2O(g) CO(g) + H2(g) ∆ r = +131,25 kJ |
Chú ý: Enthalpy tạo thành của một hợp chất cũng chính là enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền.
Câu hỏi 9 trang 84 Hóa học 10: Cho phản ứng sau:
Cho biết ý nghĩa của giá trị ∆ f(SO2, g)
Lời giải:
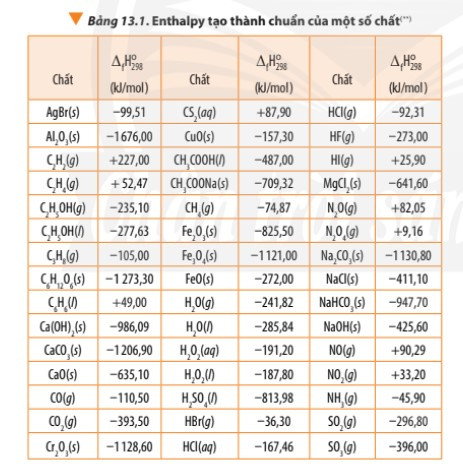
∆ f(SO2, g) = -296,80 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol SO2(g) từ các đơn chất ở trạng thái bền ở điều kiện chuẩn (sulfur ở trạng thái rắn, oxygen dạng phân tử khí chính là các dạng đơn chất bền nhất của sulfur và oxygen).
Lời giải:
∆ f(SO2, g) = -296,80 kJ/mol < 0
⇒ Hợp chất SO2(g) bền hơn về mặt năng lượng so với các đơn chất bền S(s) và O2(g).
Lời giải:
Các phản ứng có enthalpy tạo thành dương (lấy nhiệt từ môi trường):
Phản ứng tạo thành các chất: C2H2(g), C2H4(g), C6H6(l), CS2(aq), HI(g), N2O(g), N2O4(g), NO(g), NO2(g).
Lời giải:
1J = 0,239 cal ⇒ 1 kJ = 0,239 kcal.
∆ f(Fe2O3, s) = -825,50 kJ/mol = -825,50 × 0,239 kcal/mol = -197,2945 kcal/mol
∆ f(NO, g) = +90,29 kJ/mol = +90,29 × 0,239 kcal/mol = +21,5793 kcal/mol
∆ f(H2O, g) = -241,82 kJ/mol = -241,82 × 0,239 kcal/mol = -57,795 kcal/mol
∆ f(C2H5OH, l) = -277,63 kJ/mol = -277,63 × 0,239 kcal/mol = -66,354 kcal/mol
5. Ý nghĩa của dấu và giá trị ∆ r
Lời giải:
Biến thiên enthalpy của phản ứng: ∆ r = -111,68 kJ < 0
∆ f(sp) < ∆ f(cđ).
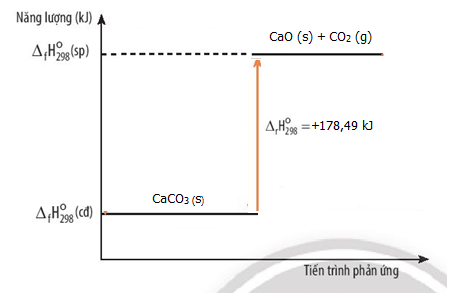
Lời giải:
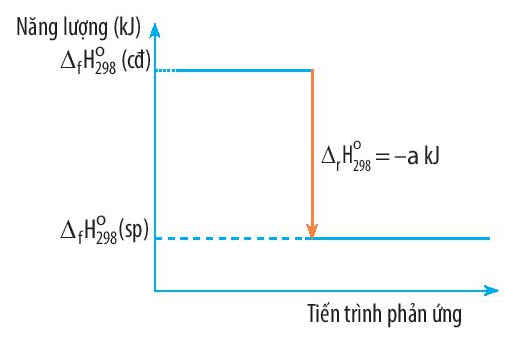
CaCO3(s) CaO(s) + CO2(g) ∆ r = +178,49 kJ
Sơ đồ biểu diễn biến thiên enthalpy của phản ứng nhiệt phân CaCO3
Câu hỏi 14 trang 85 Hóa học 10: Cho hai phương trình nhiệt hóa học sau:
CO(g) + O2(g) → CO2(g) ∆ r = -283,00 kJ (1)
H2(g) + F2(g) → 2HF(g) ∆ r = -546,00 kJ (2)
So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn?
Lời giải:
Nhiệt phản ứng (2) (∆ r = -546,00 kJ) âm hơn nhiệt phản ứng (1) (∆ r = -283,00 kJ) ⇒ Phản ứng (2) xảy ra thuận lợi hơn.
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) ∆ r = 94,30kJ
Phản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phản ứng trên.
Lời giải:
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(l) ∆ r = 94,30kJ
- Phản ứng trên là thu nhiệt vì ∆ r = 94,30kJ > 0
- Một số ứng dụng khác của phản ứng trên: Thông bồn cầu, vệ sinh máy giặt, khử mùi, tẩy trắng quần áo …
Bài 1 trang 86 Hóa học 10: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau:
N2(g) + O2(g) → 2NO(g) ∆ r = +180 kJ
A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp.
C. Phản ứng xảy ra thuận lợi ở điều kiện thường.
D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường.
Lời giải:
Đáp án đúng là: D
∆ r = +180 kJ > 0 ⇒ Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường
B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng chất sản phẩm
C. Biến thiên enthalpy của phản ứng là a kJ/mol
Lời giải:
Đáp án A
Phản ứng có biến thiên enthalpy là ∆ r = -a kJ < 0 ⇒ Phản ứng tỏa nhiệt
Lời giải:
Đáp án đúng là: A
Phản ứng giữa hydrochloric acid (HCl) và sodium hydroxide (NaOH) là phản ứng tỏa nhiệt (∆ r = -57,3 kJ).
Khi hydrochloric acid (HCl) phản ứng với sodium hydroxide (NaOH) nhiệt độ tăng dần. Đến khi phản ứng kết thúc, nhiệt độ sẽ giảm dần để cân bằng với nhiệt độ môi trường.
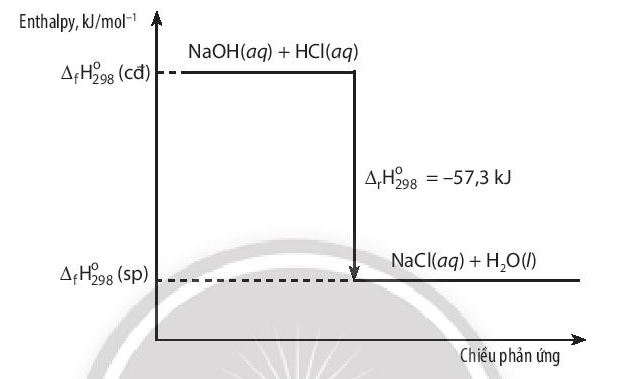
Bài 4 trang 86 Hóa học 10: Cho phương trình nhiệt hóa học sau:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l) ∆ r = -57,3 kJ
Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng
Lời giải:
Sơ đồ biểu diễn biến thiên enthalpy của phản ứng:
Lý thuyết Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
I. Phản ứng tỏa nhiệt
- Phản ứng tỏa nhiệt là phản ứng có sự giải phóng nhiệt năng ra môi trường.
- Ví dụ:
+ Phản ứng nhiệt nhôm tỏa một lượng nhiệt rất lớn làm nóng chảy hỗn hợp chất phản ứng và sắt sinh ra. Ứng dụng để hàn đường ray
2Al + Fe2O3 Al2O3 + 2Fe
+ Phản ứng đốt cháy than tỏa một lượng nhiệt lớn giúp nấu chín thức ăn và sưởi ấm.
C + O2 CO2
II. Phản ứng thu nhiệt
- Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường.
Ví dụ: Phản ứng nung đá vôi là phản ứng thu nhiệt:
CaCO3(s) CaO(s) + CO2(g)
Nếu ngừng cung cấp nhiệt thì phản ứng sẽ không tiếp tục xảy ra.
III. Biến thiên enthalpy chuẩn của phản ứng
1. Biến thiên enthalpy của phản ứng
- Biến thiên enthalpy của phản ứng (hay nhiệt phản ứng) được kí hiệu là ∆rH, thường tính theo đơn vị kJ hoặc kcal.
- Biến thiên enthalpy của phản ứng là nhiệt lượng tỏa ra hay thu vào của một phản ứng hóa học trong quá trình đẳng áp (áp suất không đổi).
- Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hóa học, được kí hiệu , là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
- Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/ L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K).
2. Phương trình nhiệt hóa học
- Phương trình nhiệt hóa học là phương trình phản ứng hóa học có kèm theo nhiệt phản ứng và trạng thái của các chất đầu (cđ) và sản phẩm (sp).
- Phản ứng thu nhiệt (hệ nhận nhiệt của môi trường) thì .
- Phản ứng tỏa nhiệt (hệ tỏa nhiệt ra môi trường) thì
Ví dụ:
C(s) + H2O(g) CO(g) + H2(g) ∆ r = +131,25 kJ > 0 (1)
⇒ Phản ứng (1) là phản ứng thu nhiệt.
CuSO4 (aq) + Zn(s) → ZnSO4(aq) + Cu(s) ∆ r = -231,04 kJ < 0 (2)
⇒ Phản ứng (2) là phản ứng tỏa nhiệt.
IV. Enthalpy tạo thành (nhiệt tạo thành)
- Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Enthalpy tạo thành (hay nhiệt tạo thành) được kí hiệu bằng ∆fH, thường được tính theo đơn vị kJ/ mol hoặc kcal/ mol.
- Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) và được kí hiệu là .
Chú ý:
1. của đơn chất bền nhất bằng 0 (xét ở điều kiện chuẩn).
2. < 0, chất bền hơn về mặt năng lượng so với các đơn chất bền tạo nên nó.
3. > 0, chất kém bền hơn mặt năng lượng so với các đơn chất bền tạo nên nó.
V. Ý nghĩa của dấu và giá trị
- Phản ứng tỏa nhiệt:
- Phản ứng thu nhiệt:
- Thường các phản ứng có < 0 thì xảy ra thuận lợi.
Chú ý: Phản ứng thu nhiệt cần cung cấp nhiệt liên tục, nếu dừng cung cấp nhiệt phản ứng sẽ không tiếp diễn
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der Waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Xem thêm tài liệu Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo