Giải Hóa 10 Bài 16 ( Chân trời sáng tạo ): Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Với giải bài tập Hóa 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 16.
Giải bài tập Hóa lớp 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Những yếu tố nào ảnh hưởng đến tốc độ của các quá trình biến đổi trên.
Lời giải:
(a) Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn ⇒ Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
(b) Khi nấu một loại thực phẩm bằng nồi áp suất sẽ nhanh chín hơn ⇒ Ảnh hưởng của áp suất đến tốc độ phản ứng.
(c) Bệnh nhân sẽ dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí ⇒ Ảnh hưởng của nồng độ đến tốc độ phản ứng.
1. Ảnh hưởng của nồng độ
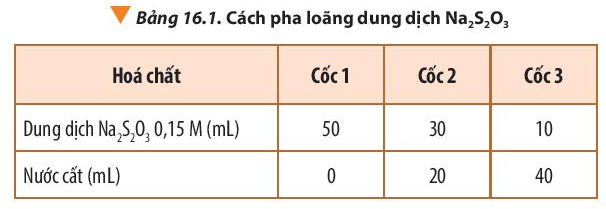
Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng
Hóa chất: Dung dịch sodium thiosulfate (Na2S2O3) 0,15M; sulfuric acid (H2SO4) 0,10M; nước cất.
Dụng cụ: cốc thủy tinh 100 mL (được đánh dấu thập ở mặt ngoài đáy cốc), ống đong 50 mL.
Bước 2: Rót đồng thời 10 mL dung dịch H2SO4 0,1 M vào mỗi cốc và khuấy đều.
Phương trình hóa học của phản ứng:
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Lời giải:
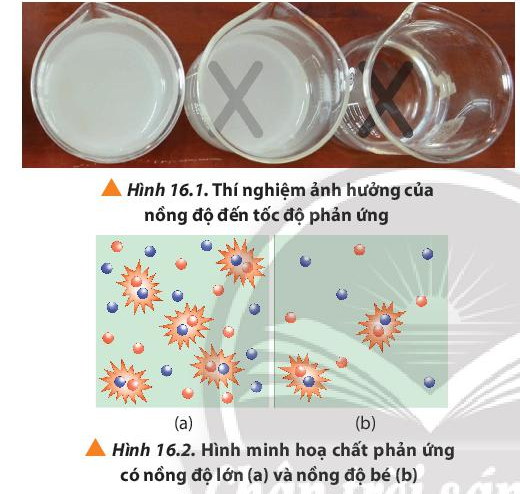
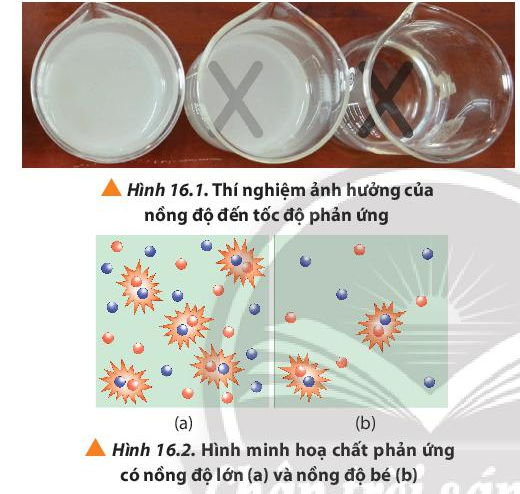
Khi rót dung dịch H2SO4 vào cốc đựng dung dịch Na2S2O3 theo trình tự từ cốc 1 đến cốc 3, cốc 1 có lượng S tạo ra nhiều làm mờ dấu thập nhanh nhất, chậm dần ở các cốc còn lại.
Nhận xét: Thể tích của dung dịch Na2S2O3 0,15M càng giảm, tốc độ phản ứng càng chậm.
Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Lời giải:
Nồng độ Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
Lời giải:
Pha loãng dung dịch H2SO4 ⇒ Nồng độ H2SO4 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
2. Ảnh hưởng của nhiệt độ
Lời giải:
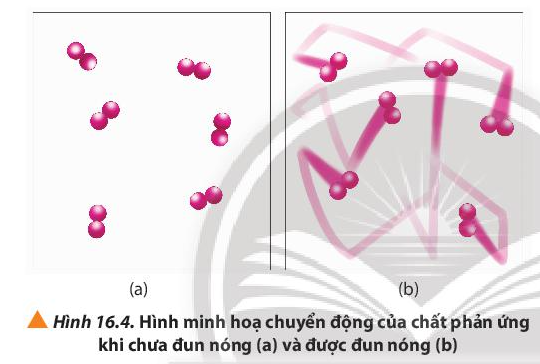
Trong cùng một khoảng thời gian, cốc (1) được đun nóng bị mất màu, cốc (2) không được đun nóng màu chỉ nhạt hơn. Chứng tỏ nhiệt độ cao hơn đã làm phản ứng ở cốc (1) xảy ra nhanh hơn.
Lời giải:
Khi đun nóng, các phân tử chất chuyển động với vận tốc nhanh hơn dẫn đến sự gia tăng số va chạm hiệu quả giữa các phân tử, do đó tốc độ phản ứng tăng.
Lời giải:
Khi nhiệt độ tăng thêm 10oC, tốc độ của một phản ứng hóa học tăng 4 lần
⇒ γ = 4
Khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 64 lần.
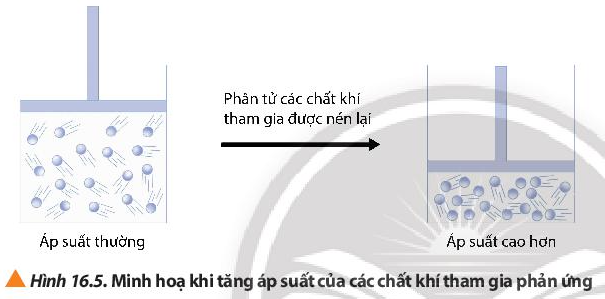
3. Ảnh hưởng của áp suất
Lời giải:
Khi nén, áp suất trong bình kín tăng, thể tích giảm, các phân tử chất khí phân bố với độ đặc khít cao hơn, nồng độ cao hơn, các chất dễ va chạm hiệu quả hơn dẫn đến tốc độ phản ứng tăng.
Luyện tập trang 101 Hóa học 10: Xét các phản ứng xảy ra trong bình kín:
NH4Cl(s) → NH3(g) + HCl(g) (2)
Lời giải:
Trong phản ứng hóa học có sự tham gia của chất khí, áp suất có thể ảnh hưởng đến tốc độ phản ứng.
Yếu tố áp suất ảnh hưởng đến tốc độ của phản ứng (1). Khi tăng áp suất tốc độ phản ứng tăng.
4. Ảnh hưởng của bề mặt tiếp xúc
Thí nghiệm 2: Ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng
Hóa chất: Dung dịch HCl 1 M, đá vôi (CaCO3) dạng khối và dạng hạt nhỏ.
Dụng cụ: bình tam giác 100 mL, ống đong 50 mL, cân.
Bước 1: Cân khoảng 2 g CaCO3, mỗi loại, cho vào 2 bình tam giác (1), (2).
Bước 2: Đong khoảng 20 mL dung dịch HCl, rót đồng thời vào mỗi bình tam giác.
Phương trình hóa học của phản ứng:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Lời giải:
Bình (1) chứa đá vôi dạng khối.
Bình (2) chứa đá vôi dạng hạt.
Nhận thấy khí thoát ra ở bình (2) nhanh hơn khí thoát ra ở bình (1).
Câu hỏi 7 trang 101 Hóa học 10: Nhận xét mối liên hệ giữa tốc độ phản ứng với kích thước của CaCO3.
Lời giải:
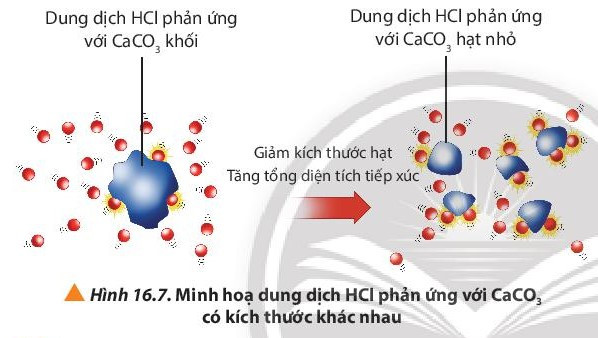
Kích thước của hạt đá vôi (CaCO3) càng nhỏ thì tốc độ phản ứng càng lớn.
Do CaCO3 có kích thước nhỏ sẽ có bề mặt tiếp xúc với dung dịch HCl lớn hơn so với CaCO3 kích thước lớn (cùng khối lượng), làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.
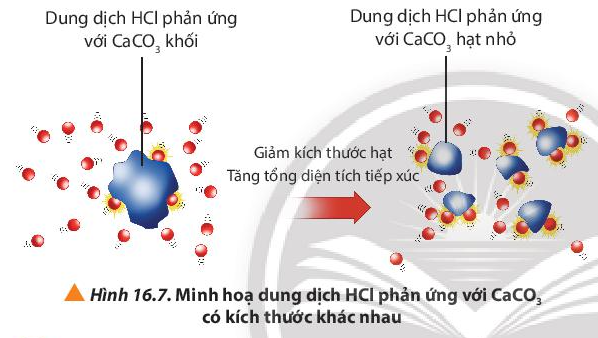
Câu hỏi 8 trang 101 Hóa học 10: Quan sát Hình 16.7, giải thích kết quả của thí nghiệm 2.
Lời giải:
CaCO3 có kích thước nhỏ sẽ có bề mặt tiếp xúc với dung dịch HCl lớn hơn so với CaCO3 kích thước lớn (cùng khối lượng), làm tăng tần số va chạm giữa các chất phản ứng, dẫn đến tốc độ phản ứng tăng.
Lời giải:
Củi được chẻ nhỏ có diện tích tiếp xúc giữa củi (nhiên liệu) với oxygen trong không khí lớn hơn, làm tăng khả năng phản ứng cháy với oxygen, tốc độ phản ứng tăng.
5. Ảnh hưởng của chất xúc tác
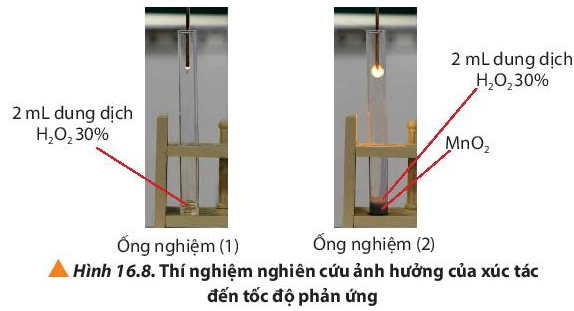
Thí nghiệm 3: Ảnh hưởng của xúc tác đến tốc độ phản ứng
Hóa chất: dung dịch hydrogen peroxide (H2O2) 30%, bột MnO2.
Dụng cụ: Ống nghiệm, tàn đóm đỏ.
Bước 1: Rót khoảng 2 mL dung dịch H2O2 vào 2 ống nghiệm (1), (2).
Phương trình hóa học của phản ứng:
Lời giải:
Hiện tượng:
- Tàn đóm ở ồng nghiệm (1) chỉ cháy nhẹ.
- Tàn đóm ở ống nghiệm (2) bùng cháy mãnh liệt hơn.
Luyện tập trang 103 Hóa học 10: Tại sao nhai kĩ cơm, cảm nhận cơm có vị ngọt hơn?
Lời giải:
Thành phần chính của cơm là tinh bột, (C6H10O5)n, khi nhai kĩ cơm, tuyến nước bọt cung cấp enzyme amylase, có vai trò là chất xúc tác, chuyển hóa tinh bột thành đường glucose có vị ngọt.
6. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
Lời giải:
- Hình 16.9a) Vận dụng yếu tố ảnh hưởng của nồng độ đến tốc độ phản ứng: Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ tăng tốc độ phản ứng cháy, sinh ra lượng nhiệt lớn để hàn, cắt kim loại.
- Hình 16.9b) Vận dụng yếu tố ảnh hưởng của áp suất đến tốc độ phản ứng: Dùng nồi áp suất làm tăng áp suất trong nồi ⇒ tăng tốc độ phản ứng ⇒ làm thức ăn nhanh chín hơn.
- Hình 16.9c) Vận dụng yếu tố ảnh hưởng của diện tích tiếp xúc đến tốc độ phản ứng: Đậy nắp lò làm giảm diện tích tiếp xúc của than với oxygen trong không khí ⇒ giảm tốc độ phản ứng cháy ⇒ than cháy được lâu hơn.
- Hình 16.9d) Vận dụng yếu tố ảnh hưởng của nhiệt độ đến tốc độ phản ứng: Bảo quản thức ăn trong tủ lạnh ⇒ giảm nhiệt độ ⇒ giảm tốc độ phản ứng oxi hóa thức ăn ⇒ thức ăn lâu bị ôi thiu.
Lời giải:
Vi sinh vật lên men ethanol thành giấm. Trong điều kiện thích hợp, vi sinh vật lên men chuối chín hay nước dừa (thành phần chính có đường glucose) chuyển hóa thành ethanol và tạo ra acetic acid (thành phần của giấm ăn). Thêm chuối chín, nước dừa hoặc một số loại trái cây khác, gián tiếp bổ sung ethanol cho quá trình lên men, đồng thời tạo ra mùi vị đặc trưng cho loại giấm đó.
Lời giải:
Trong điều kiện giống nhau (nhiệt độ, lượng dầu ăn …) thì chế biến món gà rán bằng cách chia từng phần nhỏ làm tăng diện tích tiếp xúc của gà với chảo dầu nóng ⇒ giúp gà nhanh chín hơn.
Lời giải:
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng
- Khi tăng nhiệt độ, tốc độ phản ứng tăng
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất lượng khi kết thúc phản ứng
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Tốc độ khí H2 thoát ra như thế nào khi thay đổi các yếu tố dưới đây
a) Thay a g Zn hạt bằng a g bột Zn
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl.
Lời giải:
a) Thay a g Zn hạt bằng a g bột Zn ⇒ diện tích tiếp xúc của chất phản ứng tăng ⇒ tốc độ phản ứng tăng ⇒ khí H2 thoát ra nhanh hơn.
b) Thay dung dịch HCl 2M bằng dung dịch HCl 1M ⇒ nồng độ chất tham gia giảm ⇒ tốc độ phản ứng giảm ⇒ khí H2 thoát ra chậm hơn.
c) Thực hiện phản ứng ở nhiệt độ cao hơn bằng cách đun nóng nhẹ dung dịch HCl ⇒ tăng nhiệt độ của phản ứng⇒ tốc độ phản ứng tăng ⇒ khí H2 thoát ra nhanh hơn.
Bài 4 trang 104 Hóa học 10: Cho phương trình hóa học của phản ứng:
Lời giải:
Hệ số nhiệt độ Van’t Hoff γ = 2.
Khi tăng nhiệt độ của phản ứng từ 30oC lên 60oC tốc độ phản ứng tăng 8 lần.
Lý thuyết Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
I. Ảnh hưởng của nồng độ
- Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Nồng độ của các chất phản ứng tăng làm tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
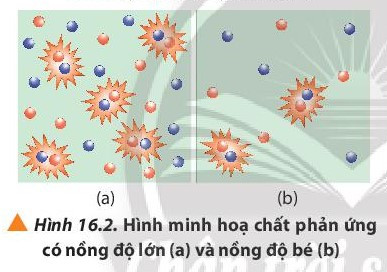
Chú ý: Khi các chất phản ứng va chạm đúng hướng và đủ năng lượng dẫn đến xảy ra phản ứng, gọi là va chạm hiệu quả.
Ví dụ: Phản ứng hóa học: Na2S2O3(aq) + H2SO4(aq) → Na2SO4(aq) + S(s) + SO2(g) + H2O(l)
Nồng độ Na2S2O3 giảm ⇒ Các hạt phân tử Na2S2O3 giảm ⇒ Số va chạm hiệu quả giữa các phân tử Na2S2O3 và phân tử H2SO4 giảm ⇒ Kết tủa tạo thành chậm tức là tốc độ phản ứng chậm hơn.
II. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ, tốc độ phản ứng tăng.
- Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ; khi tăng nhiệt độ; các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng.
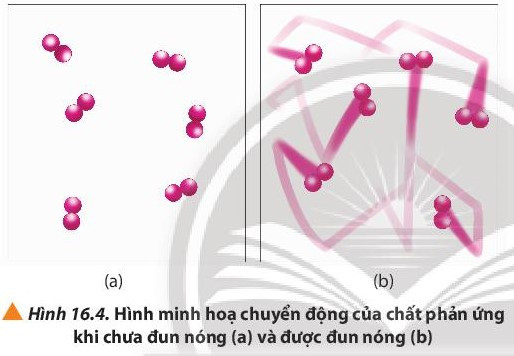
- Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức:
Trong đó:
+ là tốc độ phản ứng ở hai nhiệt độ t1 và t2;
+ γ là hệ số nhiệt độ Van’t Hoff.
Chú ý: Quy tắc Van’t Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
III. Ảnh hưởng của áp suất
- Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
- Giải thích: Khi tăng áp suất thì nồng độ chất khí tăng, nên tốc độ phản ứng tăng.

IV. Ảnh hưởng của bề mặt tiếp xúc
- Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
- Giải thích: Khi tăng diện tích tiếp xúc của chất phản ứng, số va chạm hiệu quả tăng dẫn đến tốc độ phản ứng tăng.
- Ví dụ: Thực hiện các thí nghiệm sau:
+ Thí nghiệm 1: Cho 2 gam CaCO3 dạng khối tác dụng với 20 ml HCl 1M;
+ Thí nghiệm 2: Cho 2 gam CaCO3 dạng bột tác dụng với 20 ml HCl 1M.
Khi HCl phản ứng với CaCO3 dạng bột, diện tích tiếp xúc giữa các phân tử HCl và CaCO3 tăng lên
⇒ Số va chạm hiệu quả tăng ⇒ tốc độ phản ứng tăng.
⇒ Ở thí nghiệm 2 phản ứng diễn ra nhanh hơn.
V. Ảnh hưởng của chất xúc tác
- Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
- Chất xúc tác được ghi trên mũi tên trong phương trình hóa học.
Ví dụ 1: Phương trình hóa học của phản ứng:
2H2O2 (aq) 2H2O (l) + O2 (g)
Trong phản ứng trên MnO2 là chất xúc tác.
Ví dụ 2: Enzyme amylase có trong nước bọt là chất xúc tác đẩy nhanh quá trình tiêu hóa tinh bột.
VI. Ý nghĩa thực tiễn của tốc độ phản ứng trong đời sống và sản xuất
- Kiểm soát tốc độ các phản ứng diễn ra trong đời sống, sản xuất khi vận dụng các yếu tố ảnh hưởng như: nồng độ, nhiệt độ, áp suất, bề mặt tiếp xúc và chất xúc tác giúp mang lại các giá trị hiệu quả.
Ví dụ:
+ Nồng độ oxygen trong không khí chỉ chiếm 21%. Dùng bình chứa oxygen mục đích làm tăng nồng độ chất tham gia ⇒ Tăng tốc độ phản ứng cháy
+ Bảo quản thức ăn trong tủ lạnh ⇒ Giảm nhiệt độ ⇒ Giảm tốc độ phản ứng oxi hóa thức ăn ⇒ Thức ăn lâu bị ôi thiu.

Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Bài 18: Hydrogen halide và một số phản ứng của ion halide
Xem thêm tài liệu Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Lý thuyết Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo