Giải Hóa 10 Bài 3 ( Chân trời sáng tạo ): Nguyên tố hóa học
Với giải bài tập Hóa 10 Bài 3: Nguyên tố hóa học sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 3.
Giải bài tập Hóa lớp 10 Bài 3: Nguyên tố hóa học
Video giải Hóa lớp 10 Bài 3: Nguyên tố hóa học
Mở đầu trang 20 Hóa học 10: Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên, chúng đều được tạo thành từ cùng một nguyên tố hóa học là nguyên tố carbon (C). Nguyên tố hóa học là gì? Một nguyên tử của nguyên tố hóa học có những đặc trưng cơ bản nào?
Lời giải:
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
- Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
1. Hạt nhân nguyên tử
Lời giải:
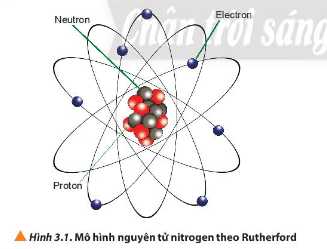
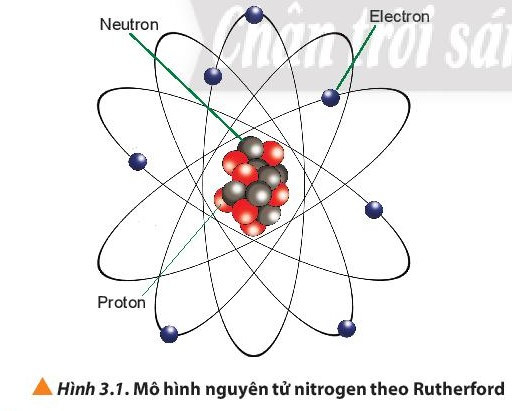
Dựa vào hình 3.1 ta thấy: Nguyên tử nitrogen có 7 proton, 7 neutron và 7 electron.
Câu hỏi 2 trang 20 Hóa học 10: Điện tích hạt nhân của nguyên tử nitrogen có giá trị là bao nhiêu?
Lời giải:
Nguyên tử nitrogen có số đơn vị điện tích hạt nhân Z = số proton = 7.
Điện tích hạt nhân của nguyên tử nitrogen bằng +Z = +7.
Lời giải:
Nguyên tử sodium có số đơn vị điện tích hạt nhân (Z) = số proton = số electron = 11.
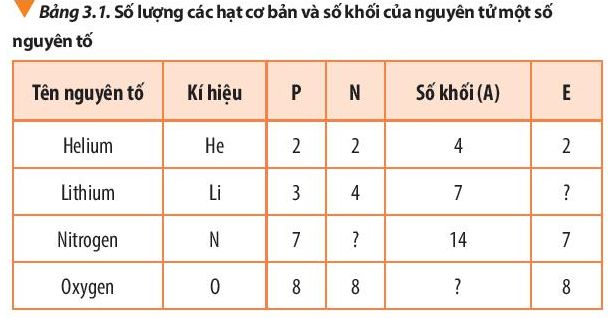
Câu hỏi 3 trang 21 Hóa học 10: Bổ sung những dữ liệu còn thiếu trong bảng 3.1.
Lời giải:
Vận dụng:
Số khối (A) = số proton (P) + số neutron (N)
Số proton (P) = số electron (E)
|
Tên nguyên tố |
Kí hiệu |
P |
N |
Số khối (A) |
E |
|
Helium |
He |
2 |
2 |
4 |
2 |
|
Lithium |
Li |
3 |
4 |
7 |
3 |
|
Nitrogen |
N |
7 |
7 |
14 |
7 |
|
Oxygen |
O |
8 |
8 |
16 |
8 |
2. Nguyên tố hóa học
Lời giải:
Điện tích hạt nhân của carbon (+Z) là +6.
Lời giải:
|
Nguyên tử |
Số proton |
Số neutron |
Số electron |
Điện tích hạt nhân |
|
Protium |
1 |
0 |
1 |
+1 |
|
Deuterium |
1 |
1 |
1 |
+1 |
|
Tritium |
1 |
2 |
1 |
+1 |
Câu hỏi 6 trang 22 Hóa học 10: Kí hiệu nguyên tử cho biết những thông tin nào?
Lời giải:
Kí hiệu nguyên tử cho biết:
- Kí hiệu nguyên tố hóa học (X)
- Số khối (A)
- Số hiệu nguyên tử (Z)
Ví dụ:

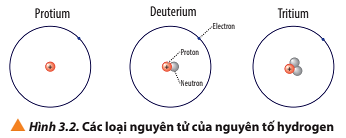
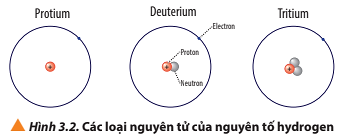
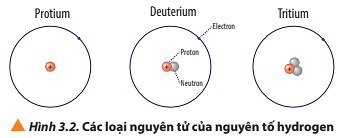
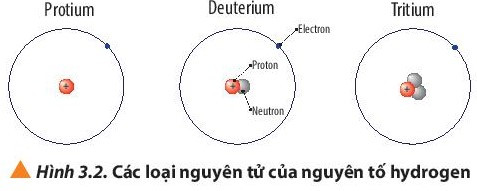
Luyện tập trang 22 Hóa học 10: a) Viết kí hiệu các nguyên tử của nguyên tố hydrogen (Hình 3.2).
Lời giải:
a)
- Nguyên tử protium: 1 proton, 0 neutron ⇒ Z = 1, A = 1.
Kí hiệu: .
- Nguyên tử deuterium: 1 proton, 1 neutron ⇒ Z = 1, A = 2.
Kí hiệu: .
- Nguyên tử tritium: 1 proton, 2 neutron ⇒ Z = 1, A = 3.
Kí hiệu:
b)
- Nguyên tử oxygen có 8 electron, 8 neutron.
+ Số E = Số P = Z = 8
+ Số khối A = P + N = 8 + 8 = 16
⇒ Kí hiệu nguyên tử: .
3. Đồng vị
Lời giải:
Các loại nguyên tử của nguyên tố hydrogen, có các điểm:
+ Giống nhau: đều có 1 proton và 1 electron;
+ Khác nhau: số lượng hạt neutron (protium không có neutron; deuterium có 1 neutron; tritium có 2 neutron).
Lời giải:
- Carbon có 6 proton ⇒ Số hiệu nguyên tử Z = 6.
- Kí hiệu nguyên tử carbon có số khối bằng 12 là: ;
- Kí hiệu nguyên tử carbon có số khối bằng 13 là: ;
4. Nguyên tử khối và nguyên tử khối trung bình
Lời giải:
Một cách gần đúng có thể coi nguyên tử khối có giá trị bằng số khối.
⇒ Nguyên tử khối của Mg = số khối (A) = số proton + số neutron = 24 (amu)
Lời giải:
Nguyên tử khối trung bình của nguyên tố copper:
.
Lời giải:
Tỉ lệ hai đồng vị (98,98%) và (1,11%) trong testosterone tự nhiên trong cơ thể là
Đối với kết quả mẫu phân tích ta có:
⇒ > 89, 171
⇒ Từ kết quả thu được, em nghi ngờ vận động viên này đã có sử dụng doping.
Bài tập (trang 25)
Lời giải:
Đáp án: C
- Nguyên tử X có 16 proton ⇒ X là sulfur (S), loại đáp án B.
- Số hiệu nguyên tử (Z) = số proton = 16.
- Số khối (A) = số proton + số neutron = 16 + 16 = 32.
⇒ Kí hiệu nguyên tử X: .
Lời giải:
Kí hiệu nguyên tử của các đồng vị silicon là: , và .
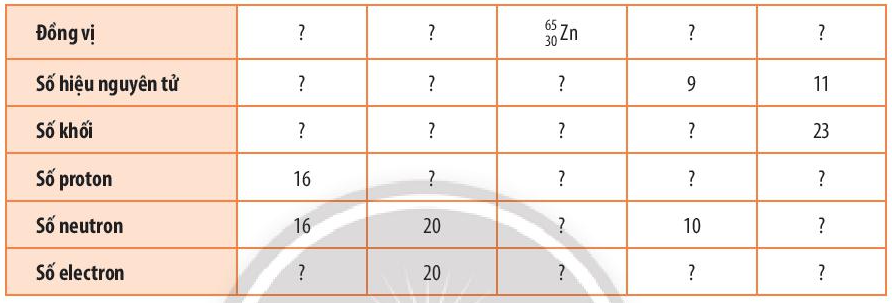
Bài 3 trang 25 Hóa học 10: Hoàn thành những thông tin chưa biết trong bảng sau:
Lời giải:
|
Đồng vị |
|
|
|
|
|
|
Số hiệu nguyên tử |
16 |
20 |
30 |
9 |
11 |
|
Số khối |
32 |
40 |
65 |
19 |
23 |
|
Số proton |
16 |
20 |
30 |
9 |
11 |
|
Số neutron |
16 |
20 |
35 |
10 |
12 |
|
Số electron |
16 |
20 |
30 |
9 |
11 |
Lời giải:
Gọi % số nguyên tử của mỗi đồng vị 24Mg, 25Mg lần lượt là x, y.
Theo bài ta có hệ phương trình sau:
Lý thuyết Nguyên tố hóa học
1. Hạt nhân nguyên tử
- Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E).
- Điện tích hạt nhân = + Z.
- Số khối (A) = số proton (P) + số neutron (N)
Ví dụ: Nguyên tử aluminium (Al) có 13 proton, 14 neutron. Suy ra:
+ Nguyên tử aluminium có số đơn vị điện tích hạt nhân = số proton = số electron = 13.
+ Điện tích hạt nhân nguyên tử aluminium là +13.
+ Số khối A = số proton (P) + số neutron (N) = 13 + 14 = 27.
II. Nguyên tố hóa học
1. Số hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử (Z) của nguyên tố đó.
- Mỗi nguyên tố hóa học có một số hiệu nguyên tử.
- Số hiệu nguyên tử (kí hiệu là Z) cho biết:
+ Số proton trong hạt nhân nguyên tử.
+ Số electron trong nguyên tử.
Ví dụ: Nguyên tố carbon có số hiệu nguyên tử là 6. Suy ra:
+ Số proton trong hạt nhân nguyên tử carbon = 6
+ Số electron trong nguyên tử carbon = 6
2. Nguyên tố hóa học
- Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
Ví dụ: Protium; deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
3. Kí hiệu nguyên tử
- Số đơn vị điện tích hạt nhân nguyên tử (số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
- Để kí hiệu nguyên tử, người ta thường ghi các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố với số khối A ở phía trên, số hiệu nguyên tử Z ở phía dưới.

Ví dụ:
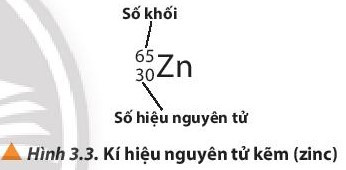
III. Đồng vị
- Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N). Do đó, số khối (A) của chúng khác nhau.
- Ví dụ: Potassium (K) có 3 đồng vị là:
- Trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị.
- Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học…
IV. Nguyên tử khối và nguyên tử khối trung bình
1. Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
Ví dụ: Nguyên tử của nguyên tố magnesium (Mg) có 12 proton và 12 neutron.
⇒ Nguyên tử khối của Mg = 12 + 12 = 24 amu
2. Nguyên tử khối trung bình
- Mỗi nguyên tố thường có nhiều đồng vị, do đó trong thực tế người ta thường sử dụng giá trị nguyên tử khối trung bình.
- Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
Ai: là nguyên tử khối đồng vị thứ i
ai: là tỉ lệ % số nguyên tử đồng vị thứ i
Ví dụ:
Trong tự nhiên, nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là (69,15%) và (30,85%). Nguyên tử khối trung bình của nguyên tố copper là:
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Xem thêm tài liệu Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo