Giải Hóa 10 Bài 9 ( Chân trời sáng tạo ): Liên kết ion
Với giải bài tập Hóa 10 Bài 9: Liên kết ion sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 9.
Giải bài tập Hóa lớp 10 Bài 9: Liên kết ion
Video giải Hóa lớp 10 Bài 9: Liên kết ion
Muối thường là các hợp chất chứa liên kết ion. Liên kết ion là gì?
Lời giải:
Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
1. Ion và sự hình thành liên kết ion
Lời giải:
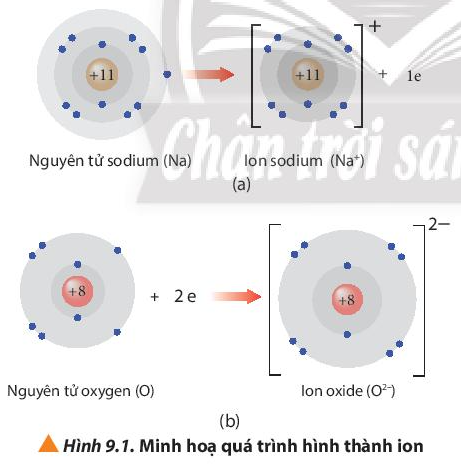
- Ion sodium có số electron trên lớp vỏ ít hơn số proton trong hạt nhân.
- Ion oxide có số electron trong lớp vỏ nhiều hơn số proton trong hạt nhân.
Lời giải:
Điện tích ion = số đơn vị điện tích hạt nhân – số electron của ion.
+ Điện tích ion sodium = 11 – 10 = +1
+ Điện tích ion oxide = 8 – 10 = -2.
Lời giải:
- Ion Na+ và ion O2- thu được đều có 8 electron ở lớp ngoài cùng nên bền vững về mặt hóa học.
- Hai ion Na+ và O2- đều có cấu hình electron giống với khí hiếm He với 2 lớp electron và 8 electron ở lớp ngoài cùng.
Lời giải:
- Nguyên tử các nguyên tố kim loại dễ nhường electron tạo thành cation.
- Nguyên tử các nguyên tố phi kim dễ nhận electron tạo thành anion.
Lời giải:
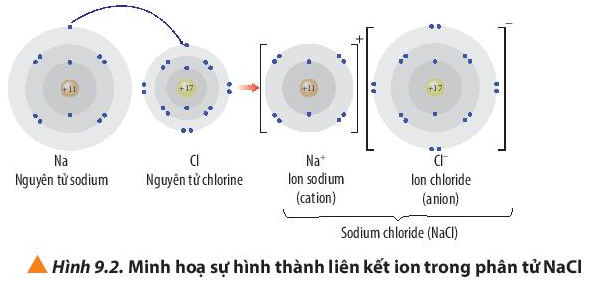
Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- mang điện tích trái dấu hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
Lời giải:
- Ion Na+ có 2 lớp electron, lớp ngoài cùng có 8 electron ⇒ Cấu hình electron ion Na+ giống cấu hình electron của khí hiếm Ne.
- Ion Cl- có 3 lớp electron, lớp ngoài cùng có 8 electron ⇒ Cấu hình electron ion Cl- giống với cấu hình electron của khí hiếm Ar.
Lời giải:
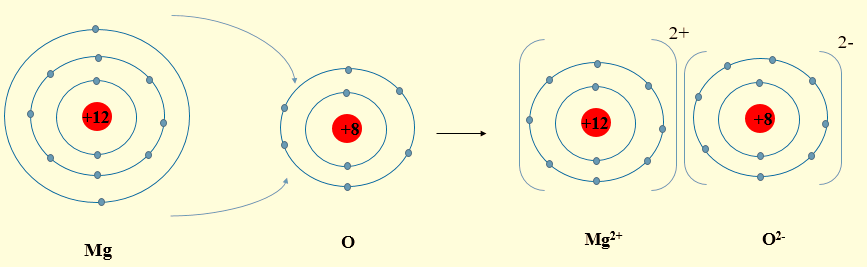
- Nguyên tử Mg (cấu hình electron: 1s22s22p63s2) có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt cấu hình electron của khí hiếm, tạo thành ion Mg2+.
- Nguyên tử O (cấu hình electron: 1s22s22p4) có 6 electron ở lớp ngoài cùng, có xu hướng nhận 2 electron của Mg để đạt cấu hình electron của khí hiếm, tạo thành ion O2-.
- Hai ion Mg2+ và O2- tạo thành mang điện tích trái dấu, hút nhau tạo thành phân tử MgO
2. Tinh thể ion
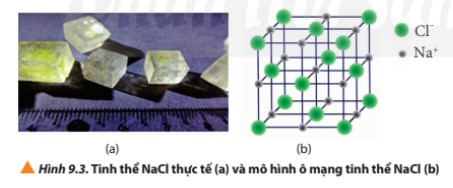
Câu hỏi 7 trang 56 Hóa học 10: Quan sát Hình 9.3, cho biết:
a) Tinh thể NaCl có cấu trúc của hình khối nào.
b) Các ion Na+ và Cl- phân bố trong tinh thể như thế nào
c) Xung quanh mỗi loại ion có bao nhiêu ion ngược dấu gần nhất
Lời giải:
a) Tinh thể NaCl có cấu trúc là hình lập phương.
b) Các ion Na+ và Cl- được xếp xen kẽ nhau đều đặn trên các đỉnh và tâm các mặt của hình lập phương.
c) Xung quanh mỗi loại ion có 6 ion ngược dấu gần nhất.
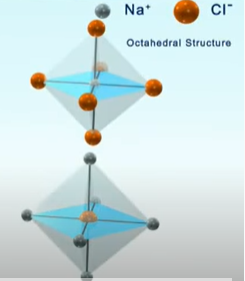
Câu hỏi 8 trang 56 Hóa học 10: Em hiểu thế nào về tinh thể ion?
Lời giải:
Tinh thể ion là loại tinh thể được tạo nên bởi các cation và anion. Các ion được sắp xếp theo trật tự nhất định trong không gian theo kiểu mạng lưới (ở các nút mạng các cation và anion xếp luân phiên liên kết chặt chẽ với nhau do cân bằng lực hút và lực đẩy).
Lời giải:
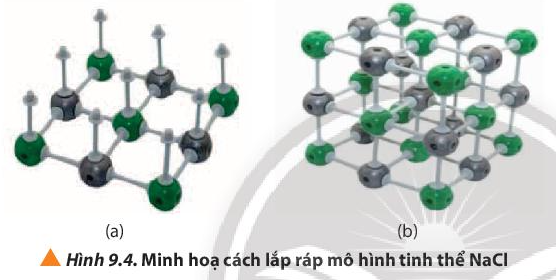
Quan sát hình 9.4 ta có:
- Số lượng quả cầu cần là: 3 × 3 × 3 = 27 quả.
- Số lượng mỗi que nối cần là: 12 × 3 + 9 × 2 = 54 que nối.
Lời giải:
Lượng ion Na+ mà người này nạp vào cơ thể là:
= 1,966 gam = 1966 mg
Ta có: 500 < 1966 < 2300 nên nếu một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể không vượt mức giới hạn cho phép.
Bài tập (trang 58)
Bài 1 trang 58 Hóa học 10: Ion Mg2+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
Lời giải:
Đáp án đúng là: B
Cấu hình electron nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:
1s22s22p6 giống với cấu hình electron của khí hiếm neon.
Lời giải:
Đáp án đúng là: D
- Cấu hình electron của ion Ca2+ là: 1s22s22p6 3s23p6 giống với cấu hình electron của khí hiếm agon.
- Cấu hình electron của ion F- là: 1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của ion Al3+ là: 1s22s22p6 giống với cấu hình electron của khí hiếm neon.
- Cấu hình electron của ion N3- là:1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Có hợp chất ion nào chỉ tạo bởi các ion trên với nhau không? Vì sao?
Lời giải:
a)
– Potassium (K, Z = 19) có cấu hình electron là: 1s22s22p63s23p64s1
Nguyên tử K nhường 1 electron tạo thành ion K+ có cấu hình electron là: 1s22s22p63s23p6 giống với cấu hình electron của khí hiếm Ar.
- Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2
Nguyên tử Mg nhường 2 electron tạo thành ion Mg2+ có cấu hình electron là:1s22s22p6 giống với cấu hình electron của khí hiếm neon.
b) Hợp chất ion được tạo thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Do đó không có hợp chất ion nào chỉ tạo bởi các ion K+ và Mg2+ với nhau vì hai ion này cùng mang điện tích dương.
Bài 4 trang 58 Hóa học 10: Hoàn thành những thông tin còn thiếu trong bảng sau: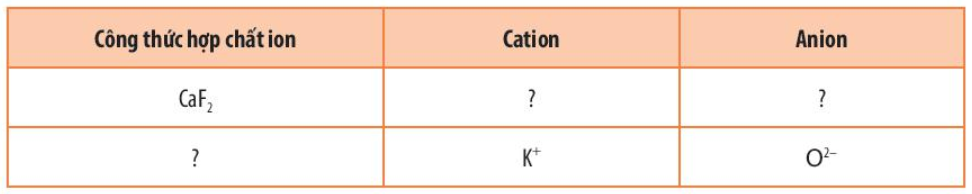
Lời giải:
|
Công thức hợp chất ion |
Cation |
Anion |
|
CaF2 |
Ca2+ |
F- |
|
K2O |
K+ |
O2- |
Bài 5 trang 58 Hóa học 10: Sodium oxide (Na2O) có trong thành phần thủy tinh và các sản phẩm gốm sứ. Trình bày sự hình thành liên kết ion trong phân tử sodium oxide.
Lời giải:
- Nguyên tử Na (Z = 11, cấu hình electron: 1s22s22p63s1) có 1 electron ở lớp ngoài cùng, có xu hướng nhường 1 electron để đạt cấu hình electron của khí hiếm, tạo thành ion Na+.
- Nguyên tử O (Z = 8, cấu hình electron: 1s22s22p4) có 6 electron ở lớp ngoài cùng, có xu hướng nhận 2 electron để đạt cấu hình electron của khí hiếm, tạo thành ion O2-.
Nguyên tử O nhận 2 electron của hai nguyên tử Na tạo thành ion là O2-.
- Hai ion Na+ và ion O2- hút nhau tạo thành phân tử Na2O.
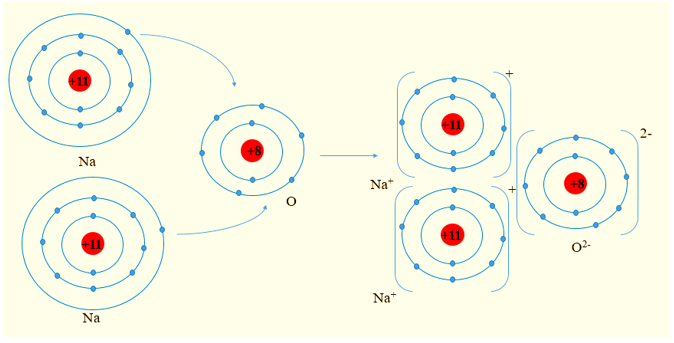
Lý thuyết Liên kết ion
I. Ion và sự hình thành liên kết ion
1. Sự tạo thành ion
- Khi nhường electron, nguyên tử trở thành ion dương (cation)
Ví dụ:
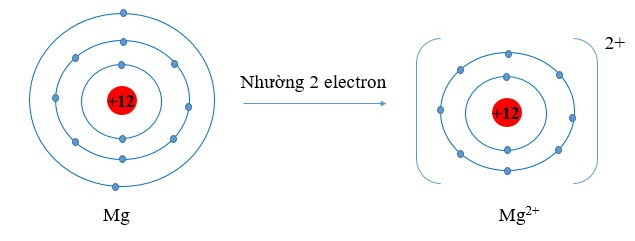
Viết gọn: Mg → Mg2+ + 2e
- Khi nhận electron, nguyên tử trở thành ion âm (anion)
Ví dụ:
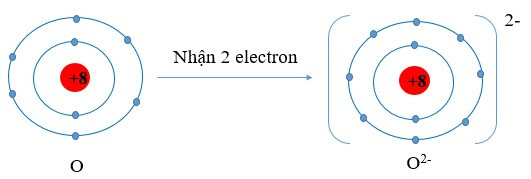
Viết gọn: O + 2e → O2-
Chú ý: Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tưr nhường hoặc nhận.
2. Liên kết ion
- Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
- Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
- Ví dụ: Sự hình thành liên kết ion trong phân từ sodium chloride:
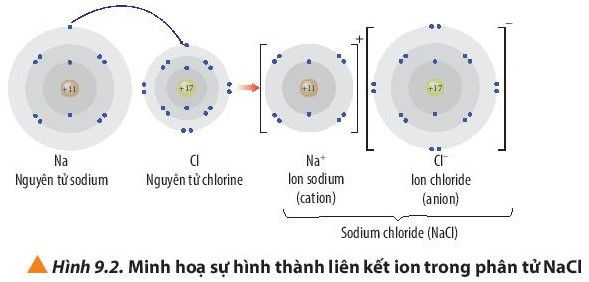
+ Nguyên tử Na (Z = 11) nhường đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Na+.
+ Nguyên tử Cl (Z = 17) nhận 1 electron từ nguyên tử Na trở thành ion mang điện tích âm, kí hiệu là Cl-.
Các ion Na+ và Cl- hút nhau tạo thành liên kết trong phân tử NaCl.
Phương trình hóa học: 2Na + Cl2 → 2NaCl.
II. Tinh thể ion
- Tinh thể ion là hợp chất ion ở dạng rắn. Chúng gồm các ion liên kết với nhau bằng lực hút tĩnh điện tạo thành một mạng tinh thể.
- Ô mạng tinh thể là đơn vị nhỏ nhất của mạng tinh thể, hiển thị cấu trúc không gian ba chiều của toàn bộ tinh thể.
- Tinh thể của một chất có thể xem là một ô mạng lặp đi lặp lại trong không gian ba chiều.
- Do các hợp chất ion có cấu trúc tinh thể nên trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
Ví dụ: NaCl là hợp chất ion phổ biến. Trong điều kiện thường, hợp chất này tồn tại dưới dạng tinh thể rắn, cứng, dễ tan trong nước và có nhiệt độ nóng chảy cao.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der Waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Bài 2: Thành phần của nguyên tử
Xem thêm tài liệu Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo