Giải Hóa 10 Bài 8 ( Chân trời sáng tạo ): Quy tắc octet
Với giải bài tập Hóa 10 Bài 8: Quy tắc octet sách Chân trời sáng tạo hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 10 Bài 8.
Giải bài tập Hóa lớp 10 Bài 8: Quy tắc octet
Video giải Hóa lớp 10 Bài 8: Quy tắc octet
Lời giải:
Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
1. Liên kết hóa học
Lời giải:
- Sự hình thành phân tử H2:
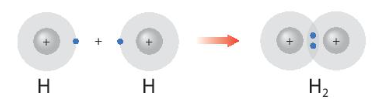
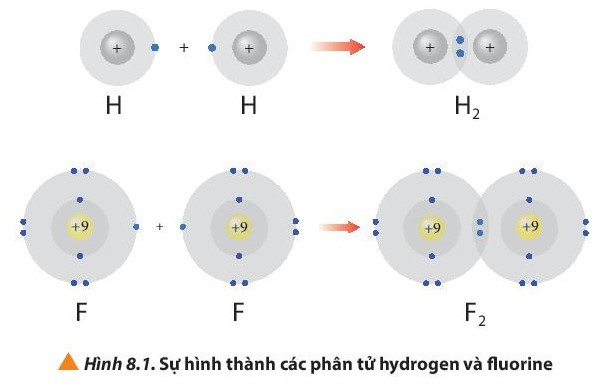
Sau khi tham gia liên kết nguyên tử H: Có 1 lớp electron, 2 electron ở lớp ngoài cùng giống cấu hình electron của He.
- Sự hình thành phân tử F2:
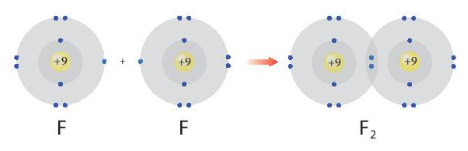
Sau khi hình thành liên kết Nguyên tử F: Có 2 lớp electron, 8 electron ở lớp ngoài cùng giống cấu hình electron của Ne.
Lời giải:
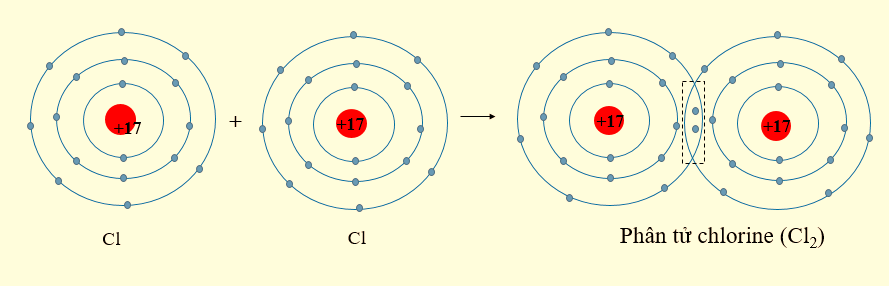
- Nguyên tử chlorine có 7 electron ở lớp ngoài cùng. Khi 2 nguyên tử Cl liên kết với nhau, mỗi nguyên tử Cl sẽ góp 1 electron để tạo 1 cặp electron dùng chung, khi đó mỗi nguyên tử chlorine sẽ đạt được cấu hình electron bền vững.
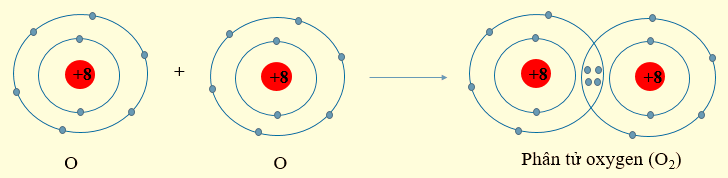
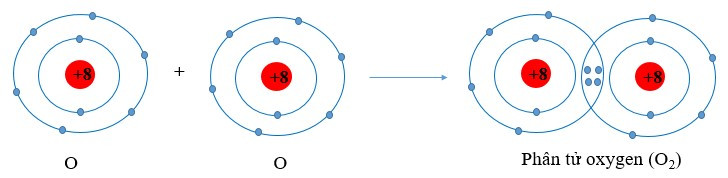
- Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung, khi đó mỗi nguyên tử oxygen sẽ đạt được cấu hình electron bền vững.
2. Quy tắc octet
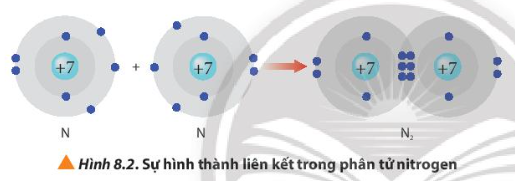
Lời giải:
Sau khi hình thành liên kết, mỗi nguyên tử nitrogen có 2 lớp electron và có 8 electron ở lớp ngoài cùng. Vậy mỗi nguyên tử nitrogen đạt được cấu hình electron bền vững của nguyên tử khí hiếm neon.
Lời giải:
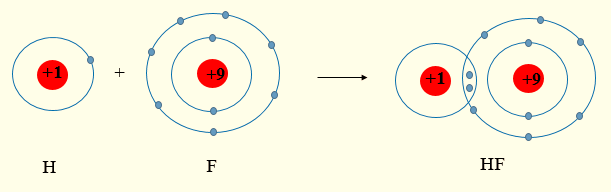
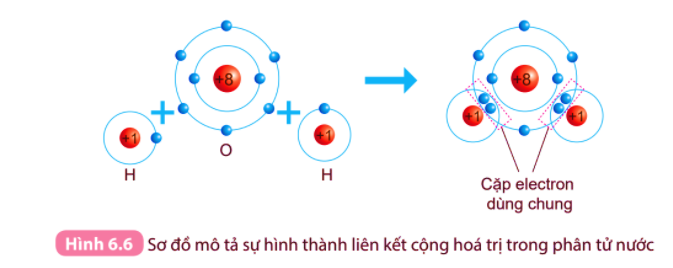
Fluorine có 7 electron lớp ngoài cùng, hydrogen có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron).
Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ góp chung 1 electron hóa trị để tạo thành cặp electron dùng chung.
Lời giải:
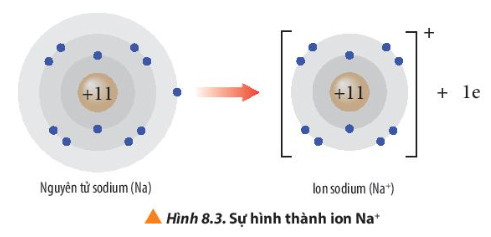
- Ion sodium có 2 lớp electron và có 8 electron ở lớp ngoài cùng giống cấu hình electron của khí hiếm neon.
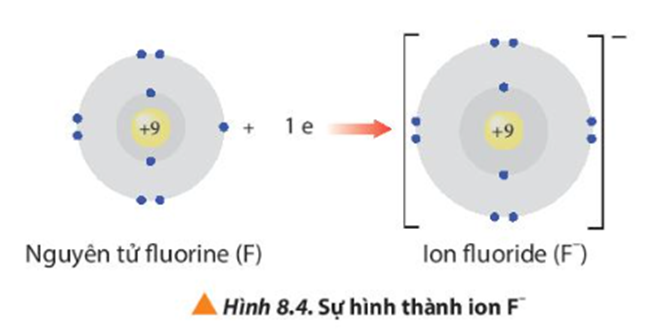
- Ion fluoride có 2 lớp electron và có 8 electron ở lớp ngoài cùng giống cấu hình electron của khí hiếm neon.
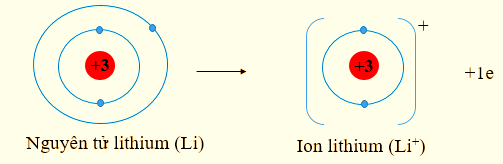
Lời giải:
Lithium có số hiệu nguyên tử: Z = 3 ⇒ Cấu hình electron: 1s22s1
⇒ Lithium có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm He. Phần tử thu được mang điện tích dương, gọi là ion lithium, kí hiệu Li+.
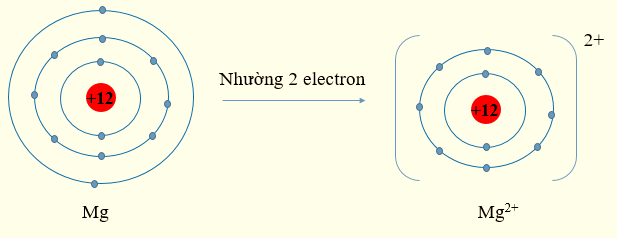
Lời giải:
- Sự hình thành ion Mg2+:
Nguyên tử Mg có Z = 12, cấu hình electron: 1s22s22p63s2
Nguyên tử Mg có 2 electron lớp ngoài cùng có xu hướng nhường 2 electron để đạt cấu hình electron bền vững của khí hiếm. Khi đó, phần tử thu được mang điện tích dương, kí hiệu Mg2+.
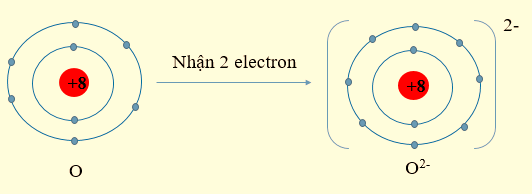
- Sự hình thành ion O2-
Nguyên tử O có Z = 8, cấu hình electron: 1s22s22p4
Nguyên tử O có 6 electron lớp ngoài cùng có xu hướng nhận 2 electron tạo thành ion O2- đạt cấu hình electron bền vững của khí hiếm:
Bài tập (trang 54)
Lời giải:
Đáp án đúng là: D
Cấu hình electron chlorine (Z = 17): 1s22s22p63s23p5 ⇒ Cl có xu hướng nhận 1 electron thành Cl- có cấu hình: 1s22s22p63s23p6 giống với cấu hình khí hiếm Ar.
Lời giải:
Đáp án đúng là: C
Cấu hình electron potassium: 1s22s22p63s23p64s1.
Potassium có 1 electron lớp ngoài cùng có xu hướng nhường 1 electron để đạt cấu hình electron bền vững của khí hiếm Ar: 1s22s22p63s23p6.
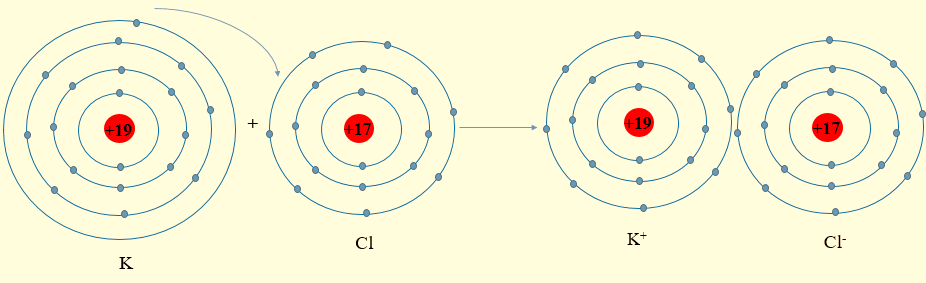
Lời giải:
- Nguyên tử K (cấu hình electron: 1s22s22p63s23p64s1) có 1 electron lớp ngoài cùng, có xu hướng nhường 1 electron này để đạt cấu hình electron giống khí hiếm. Phần tử thu được mang điện tích dương, gọi là ion potassium, kí hiệu K+.
- Nguyên tử Cl (cấu hình electron: 1s22s22p63s23p5) có 7 electron lớp ngoài cùng, có xu hướng nhận 1 electron từ nguyên tử K để đạt cấu hình electron giống khí hiếm. Phần tử thu được mang điện tích âm, gọi là ion chlorine, kí hiệu, Cl-
- Hai ion trái dấu hút nhau tạo thành phân tử potassium chloride (KCl)
- Sơ đồ mô tả:
Lời giải:
- Nguyên tử O (cấu hình electron: 1s22s22p4) có 6 electron lớp ngoài cùng, có xu hướng nhận 2 electron để đạt được cấu hình electron giống khí hiếm.
- Nguyên tử H (cấu hình electron: 1s1) có xu hướng nhận 1 electron để đạt được cấu hình electron giống khí hiếm.
⇒ Mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử O tạo thành 2 cặp electron dùng chung.
Lý thuyết Quy tắc octet
I. Liên kết hóa học
- Phân tử được tạo nên từ các nguyên tử bằng liên kết hóa học.
Ví dụ:
- Phân tử hydrogen (H2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử hydrogen (H).
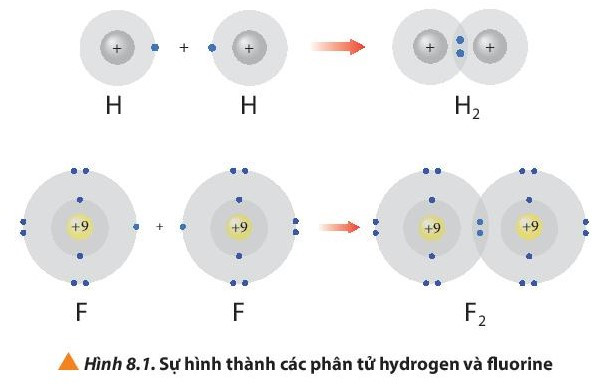
- Phân tử fluorine (F2) được tạo nên bằng liên kết hóa học giữa hai nguyên tử fluorine (F).
II. Quy tắc octet
- Quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium).
Ví dụ 1: Vận dụng quy tắc octet trong sự hình thành phân tử oxygen (O2)
Nguyên tử oxygen có 6 electron ở lớp ngoài cùng. Khi 2 nguyên tử O liên kết với nhau, mỗi nguyên tử O sẽ góp 2 electron để tạo 2 cặp electron dùng chung tạo thành cấu hình electron bền vững của khí hiếm neon.
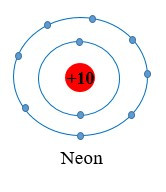
Ví dụ 2: Vận dụng quy tắc octet trong sự tạo thành ion potassium (K+).
Nguyên tử potassium có 1 electron ở lớp ngoài cùng. Nếu mất đi 1 electron nguyên tử potassium sẽ đạt được cấu hình electron bền vững, giống với khí hiếm gần nhất là Ar.
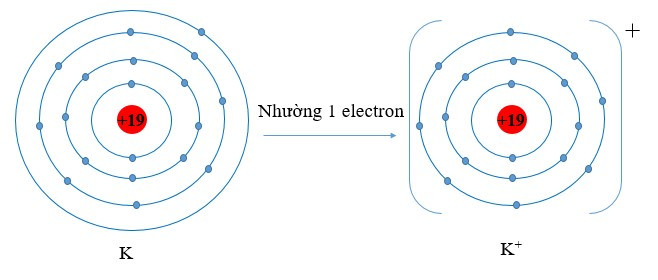
Viết gọn: K → K+ + 1e
Ví dụ 3: Vận dụng quy tắc octet trong sự tạo thành phân tử HF.
+ Fluorine thuộc nhóm VIIA ⇒ có 7 electron lớp ngoài cùng.
+ Hydrogen thuộc nhóm IA ⇒ có 1 electron lớp ngoài cùng (lớp 1 có tối đa 2 electron)
⇒ Cả 2 có xu hướng nhận electron để đạt cấu hình electron của khí hiếm
⇒ Khi tham gia liên kết hình thành phân tử HF, mỗi nguyên tử sẽ gọp chung 1 electron để tạo thành cặp electron dùng chung.
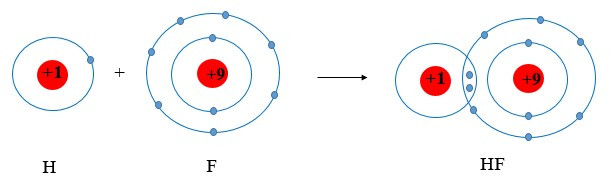
Chú ý:
+ Không phải mọi trường hợp, nguyên tử của các nguyên tố khi tham gia liên kết đều tuân theo quy tắc octet. Người ta nhận thấy, một số phân tử có thể không tuân theo quy tắc octet như: NO; BH3; SF6 …
+ Với nguyên tử của các nguyên tố nhóm B, người ta áp dụng một số quy tắc khác, tương ứng với quy tắc octet, là quy tắc 18 electron để giải thích xu hướng khi tham gia liên kết hóa học của chúng.
Xem thêm lời giải bài tập Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 11: Liên kết hydrogen và tương tác van der Waals
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Xem thêm tài liệu Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Soạn văn lớp 10 (ngắn nhất) – Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Giải sbt Ngữ văn lớp 10 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Chân trời sáng tạo
- Văn mẫu lớp 10 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 10 – Chân trời sáng tạo
- Giải sgk Toán 10 – Chân trời sáng tạo
- Giải Chuyên đề Toán 10 – Chân trời sáng tạo
- Lý thuyết Toán 10 – Chân trời sáng tạo
- Giải sbt Toán 10 – Chân trời sáng tạo
- Chuyên đề dạy thêm Toán 10 Chân trời sáng tạo (2024 có đáp án)
- Giải sgk Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Giải sbt Tiếng Anh 10 Friends Global – Chân trời sáng tạo
- Trọn bộ Từ vựng Tiếng Anh 10 Friends Global đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 Friends Global
- Giải sgk Vật lí 10 – Chân trời sáng tạo
- Giải sbt Vật lí 10 – Chân trời sáng tạo
- Lý thuyết Vật lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Vật lí 10 – Chân trời sáng tạo
- Giải sgk Sinh học 10 – Chân trời sáng tạo
- Giải sbt Sinh học 10 – Chân trời sáng tạo
- Lý thuyết Sinh học 10 – Chân trời sáng tạo
- Giải Chuyên đề Sinh học 10 – Chân trời sáng tạo
- Giải sgk Lịch sử 10 – Chân trời sáng tạo
- Giải sbt Lịch sử 10 – Chân trời sáng tạo
- Giải Chuyên đề Lịch sử 10 – Chân trời sáng tạo
- Lý thuyết Lịch sử 10 – Chân trời sáng tạo
- Giải sgk Địa lí 10 – Chân trời sáng tạo
- Lý thuyết Địa Lí 10 - Chân trời sáng tạo
- Giải sbt Địa lí 10 – Chân trời sáng tạo
- Giải Chuyên đề Địa lí 10 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Chân trời sáng tạo
- Giải Chuyên đề Kinh tế và pháp luật 10 – Chân trời sáng tạo
- Lý thuyết KTPL 10 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sbt Hoạt động trải nghiệm 10 – Chân trời sáng tạo
- Giải sgk Giáo dục thể chất 10 – Chân trời sáng tạo