TOP 15 câu Trắc nghiệm Liên kết ion (Chân trời sáng tạo 2024) có đáp án - Hóa học 10
Bộ 15 câu hỏi trắc nghiệm Hóa lớp 10 Bài 9: Liên kết ion có đáp án đầy đủ các mức độ sách Chân trời sáng tạo giúp học sinh ôn luyện trắc nghiệm Hóa 10 Bài 9.
Trắc nghiệm Hóa 10 Bài 9: Liên kết ion - Chân trời sáng tạo
Câu 1. Liên kết ion thường được hình thành khi
A. kim loại điển hình tác dụng với phi kim điển hình
B. 2 phi kim điển hình tác dụng với nhau
C. kim loại điển hình tác dụng với khí hiếm
D. phi kim điển hình tác dụng với khí hiếm
Đáp án đúng là: A
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
Câu 2. Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa
A. cation K2+ và anion Cl2−
B. cation K+ và anion Cl−
C. cation Cl+ và anion K−
D. cation Cl2+ và anion K2−
Đáp án đúng là: B
K (Z = 19): [Ar]4s1⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để trở thành caction K+
Cl (Z = 17): [Ne]3s23p5⇒ có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để trở thành anion Cl−
Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa cation K+ và anion Cl−.
Câu 3. Phát biểu nào sau đây là đúng?
A. Liên kết ion chỉ có trong đơn chất
B. Liên kết ion chỉ có trong hợp chất
C. Liên kết ion có cả trong đơn chất và hợp chất
D. Cả A, B, và C đều sai.
Đáp án đúng là: B
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa ion dương (hình thành từ kim loại) và ion âm (hình thành từ phi kim).
⇒ Phân tử chứa liên kết ion được hình thành từ kim loại và phi kim điển hình.
⇒ Liên kết ion chỉ có trong hợp chất.
Câu 4. Quá trình hình thành liên kết ion trong phân tử MgO là
A. Mg ⟶ Mg2+ + 2e; O + 2e ⟶ O2−; Mg2+ + O2−⟶ MgO
B. Mg ⟶ Mg+ + 1e; O + 1e ⟶ O−; Mg+ + O−⟶ MgO
C. O ⟶ O2+ + 2e; Mg + 2e ⟶ Mg2−; O2+ + Mg2−⟶ MgO
D. O ⟶ O+ + 1e; Mg + 1e ⟶ Mg−; O+ + Mg−⟶ MgO
Đáp án đúng là: A
Mg (Z = 12): [Ne]3s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
O (Z = 8): [He]2s22p4 có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
Mg⟶Mg2+ + 2e
[Ne]3s2 [Ne]
O+ 2e ⟶ O2−
[He]2s22p4 [Ne]
Mg2+ + O2−⟶ MgO
Câu 5. Khẳng định đúng là
A. Khi nhường electron, nguyên tử trở thành ion dương (cation)
B. Khi nhận electron, nguyên tử trở thành ion âm (anion)
C. Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận
D. Cả A, B và C đều đúng.
Đáp án đúng là: D
Khi nhường electron, nguyên tử trở thành ion dương (cation)
Khi nhận electron, nguyên tử trở thành ion âm (anion)
Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận.
Câu 6. Quá trình hình thành liên kết ion trong phân tử CaCl2 là
A. Ca ⟶ Ca2+ + 2e; Cl + 2e ⟶ Cl2−; Ca2+ + Cl2−⟶ CaCl2
B. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + Cl−⟶ CaCl2
C. Ca ⟶ Ca2+ + 2e; Cl + 1e ⟶ Cl−; Ca2+ + 2Cl−⟶ CaCl2
D. Ca ⟶ Ca+ + 1e; Cl + 2e ⟶ Cl2−; Ca+ + Cl2−⟶ CaCl2
Đáp án đúng là: C
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
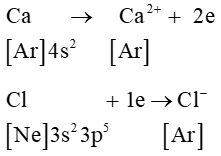
Ca2+ + 2Cl−⟶ CaCl2
Câu 7. Ion Al3+ có cấu hình electron giống cấu hình electron của khí hiếm nào?
A. Helium
B. Neon
C. Argon
D. Krypton
Đáp án đúng là: B
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
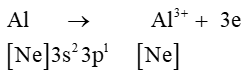
Câu 8. Cho các ion sau: Ca2+, F-, Al3+ và P3−. Số ion có cấu hình electron của khí hiếm neon là
A. 4
B. 2
C. 1
D. 3
Đáp án đúng là: B
Ca (Z = 20): [Ar]4s2 có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của Ca2+ là: [Ar]
F (Z = 9): 1s22s22p5 có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của F− là: [Ne]
Al (Z = 13): [Ne]3s23p1 có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của Al3+ là: [Ne]
P (Z = 15): [Ne]3s23p3 có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của P3− là: [Ar]
Vậy có 2 ion có cấu hình electron của khí hiếm neon.
Câu 9. So sánh nào dưới đây là đúng?
A. Bán kính nguyên tử Ca bằng bán kính ion Ca2+
B. Bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
C. Bán kính nguyên tử Ca nhỏ hơn bán kính ion Ca2+
D. Bán kính nguyên tử Ca lớn hơn hoặc bằng bán kính ion Ca2+
Đáp án đúng là: B
Nguyên tử Ca (Z = 20): [Ar]4s2 có 4 lớp electron.
Ca ⟶ Ca2+ + 2e
Ion Ca2+ (Z = 20): [Ar] có 3 lớp electron.
Do đó bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
Câu 10. Hợp chất nào dưới đây là hợp chất ion?
A. NaCl
B. N2
C. H2O
D. CO2
Đáp án đúng là: A
Hợp chất ion là hợp chất được hình thành từ kim loại điển hình với phi kim điển hình.
Na là kim loại điển hình, Cl là phi kim điển hình ⇒ NaCl là hợp chất ion.
Câu 11. Cho các tính chất dưới đây:
(i) Dẫn điện ở trạng thái rắn.
(ii) Dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
(iii) Thường tồn tại ở thể rắn trong điều kiện thường.
(iiii) Dễ nóng chảy, dễ bay hơi.
Số tính chất điển hình đúng của hợp chất ion là
A. 1
B. 2
C. 3
D. 4
Đáp án đúng là: B
Tính chất điển hình của hợp chất ion là
(i) Dẫn điện ở trạng thái rắn. ⇒ sai vì không dẫn điện ở trạng thái rắn.
(ii) Dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện. ⇒ đúng
(iii) Thường tồn tại ở thể rắn trong điều kiện thường. ⇒ đúng
(iiii) Dễ nóng chảy, dễ bay hơi. ⇒ sai vì khó nóng chảy, khó bay hơi.
Vậy có 2 tính chất đúng.
Câu 12. Anion X3− có cấu hình electron 1s22s22p63s23p6. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s23p3
B. 1s22s22p63s23p6
C. 1s22s22p63s23p63d14s2
D. 1s22s22p6
Đáp án đúng là: A
Anion X3− có cấu hình electron 1s22s22p63s23p6
Mà X + 3e → X3−
Nên cấu hình electron nguyên tử của X là 1s22s22p63s23p3.
Câu 13. Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng
A. chất lỏng
B. chất khí
C. tinh thể rắn
D. rắn, lỏng hoặc khí
Đáp án đúng là: C
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể rắn.
Câu 14. Liên kết ion là loại liên kết phổ biến trong
A. các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình
B. các hợp chất được tạo nên từ 2 phi kim điển hình
C. các hợp chất được tạo nên từ 2 kim loại điển hình
D. các đơn chất
Đáp án đúng là: A
Liên kết ion là loại liên kết phổ biến trong các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình.
Câu 15. Công thức của hợp chất ion được hình thành từ anion Y2− và cation X+ là
A. XY
B. X2Y2
C. X2Y
D. XY2
Đáp án đúng là: C
Tổng điện tích của các ion trong hợp chất ion bằng 0.
Giả sử công thức có dạng: XaYb
Khi đó: ⇒ . ⇒ a = 2 và b = 1
Công thức của hợp chất ion là: X2Y.
Xem thêm bài tập trắc nghiệm Hóa học lớp 10 có đáp án sách Chân trời sáng tạo hay khác:
Trắc nghiệm Hóa 10 Bài 7: Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Hóa 10 Bài 8: Quy tắc octet
Trắc nghiệm Hóa 10 Bài 9: Liên kết ion
Trắc nghiệm Hóa 10 Bài 10: Liên kết cộng hóa trị
Trắc nghiệm Hóa 10 Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Xem thêm các chương trình khác:
- Trắc nghiệm Toán lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Hóa học lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Công nghệ lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Giáo Dục Quốc Phòng lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Vật Lí lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Lịch sử lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Sinh học lớp 10 có đáp án – Kết nối tri thức
- Trắc nghiệm Tin học lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Kinh tế pháp luật lớp 10 có đáp án - Kết nối tri thức
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án - Global Success Kết nối tri thức
- Trắc nghiệm Hóa học lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Vật Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Địa Lí lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Công nghệ lớp 10 có đáp án – Cánh Diều
- Trắc nghiệm Giáo Dục Quốc Phòng lớp 10 có đáp án – Cánh Diều
