Giải SBT Hóa 9 Bài 2: Một số oxit quan trọng
Lời giải sách bài tập Hóa học lớp 9 Bài 2: Một số oxit quan trọng chi tiết bám sát SBT Hóa học 9 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong sách bài tập Hóa 9 Bài 2. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 9 Bài 2: Một số oxit quan trọng
Bài 2.1 trang 4 SBT Hóa 9: Kim loại M tác dụng với dung dịch HCl sinh ra khí hiđro. Dẫn khí hiđro đi qua oxit của kim loại N nung nóng. Oxit này bị khử cho kim loại N. M và N là
Lời giải:
Phương án C. Cặp kim loại kẽm và đồng (M là Zn, N là Cu)
Các phương trình hoá học :
Zn + 2HCl → ZnCl2 + H2↑
CuO + H2 to→ Cu + H2O
Bài 2.2 trang 4 SBT Hóa 9: Canxi oxit tiếp xúc lâu ngày với không khí sẽ bị giảm chất lượng. Hãy giải thích hiện tượng này và minh hoạ bằng phương trình hoá học.
Lời giải:
CaO là oxit bazơ tác dụng với oxit axit CO2 trong không khí, tạo ra CaCO3 (đá vôi).
Phương trình hóa học
CaO + CO2 → CaCO3
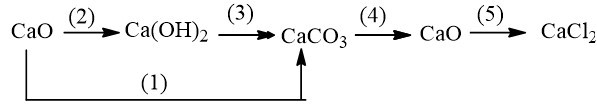
Bài 2.3 trang 4 SBT Hóa 9: Viết các phương trình hoá học thực hiện những chuyển đổi hoá học theo sơ đồ sau :
Lời giải:
1. CaO tác dụng với CO2.
CaO + CO2 → CaCO3
2. CaO tác dụng với H2O.
CaO + H2O → Ca(OH)2
3. Ca(OH)2 tác dụng với CO2 hoặc Na2CO3.
Ca(OH)2 + CO2 → CaCO3↓ + H2O
4. Phân huỷ CaCO3 ở nhiệt độ cao.
CaCO3 to→ CaO + CO2
5. CaO tác dụng với dung dịch HCl.
CaO + 2HCl → CaCl2 + H2O
Bài 2.4 trang 4 SBT Hóa 9: CaO là oxit bazơ, P2O5 là oxit axit. Chúng đều là những chất rắn, màu trắng. Bằng những phương pháp hoá học nào có thể giúp ta nhận biết được mỗi chất trên ?
Lời giải:
Cho mỗi chất tác dụng với H2O, sau đó thử dung dịch bằng quỳ tím.
CaO tan trong nước tạo ra dung dịch Ca(OH)2 là dung dịch bazơ làm quỳ tím đổi sang màu xanh
P2O5 tan trong H2O tạo ra dung dịch H3PO4 là axit làm quỳ tím đổi sang màu đỏ
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Bài 2.5 trang 4 SBT Hóa 9: Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống CaO, nếu hiệu suất là 85% ?
Lời giải:
mCaCO3
CaCO3 CaO + CO2
Cứ 100kg CaCO3 thì tạo ra 56g CaO
⇒ Với 800kg CaCO3 tạo ra:
mCaO = = 448(kg)
Khối lượng CaO thực tế: mCaO = = 380,8 kg
Bài 2.6 trang 4 SBT Hóa 9: Để tôi vôi, người ta đã dùng một khối lượng nước bằng 70% khối lượng vôi sống. Hãy cho biết khối lượng nước đã dùng lớn hơn bao nhiêu lần so với khối lượng nước tính theo phương trình hoá học.
Lời giải:
Phương trình hóa học:
CaO + H2O → Ca(OH)2
Theo phương trình hoá học : 56 kg CaO tác dụng với 18 kg H2O.
Thực tế thì khối lượng H2O dùng để tôi vôi sẽ là :
Khối lượng nước đã dùng lớn hơn là : ≈ 2,2 (lần)
Bài 2.7 trang 4 SBT Hóa 9: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4).
b) Xác định nồng độ mol của dung dịch axit thu được.
Lời giải:
a) Phương trình hoá học:
SO3 + H2O → H2SO4
b) Theo phương trình hoá học :
Nồng độ mol của dung dịch H2SO4:
Bài 2.8 trang 5 SBT Hóa 9: Dẫn 1,12 lít khí lưu huỳnh đioxit (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M.
b) Tính khối lượng các chất sau phản ứng.
Lời giải:
a) Ta có: ;
Nhận thấy → Chỉ xảy ra phản ứng tạo muối CaSO3 và Ca(OH)2 dư, SO3 phản ứng hết.
Phương trình hoá học :
SO2 + Ca(OH)2 → CaSO3↓ + H2O
b) Tính theo phương trình ta có:
→ dư = 0,07 – 0,05 = 0,02 mol
Sau phản ứng gồm Ca(OH)2 dư và CaSO3.
Khối lượng các chất sau phản ứng là :
= 120 x 0,05 = 6 gam
= 74 x 0,02 = 1,48 gam
Bài 2.9 trang 5 SBT Hóa 9: Có các chất sau :
Hãy chọn những chất thích hợp trong các chất trên điền vào chỗ trống trong các sơ đồ phản ứng sau :
Lời giải:
1. D. SO3
2. E. P2O5
3. A. CuO
4. A. CuO, G. H2O
5. B. H2.
Xem thêm lời giải sách bài tập Hóa học lớp 9 hay, chi tiết khác:
Bài 3: Tính chất hóa học của axit
Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
Bài 7: Tính chất hóa học của bazơ
Xem thêm tài liệu sách bài tập Hóa học lớp 9 hay, chi tiết khác:
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9