Giải SBT Hóa 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
Lời giải sách bài tập Hóa học lớp 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ chi tiết bám sát SBT Hóa học 9 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong sách bài tập Hóa 9 Bài 12. Mời các bạn đón xem:
Mục lục Giải SBT Hóa 9 Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
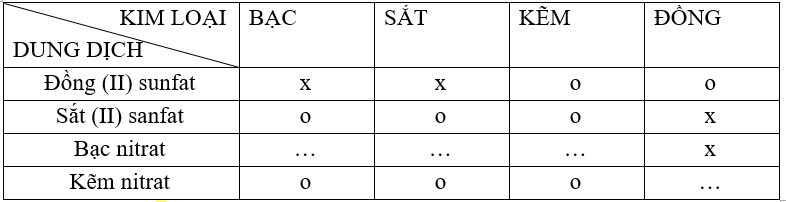
Bài 12.1 trang 15 SBT Hóa 9: Bạn em đã lập bảng về mối quan hệ giữa một số kim loại với một số dung dịch muối như sau :
Dấu x là có phản ứng hoá học xảy ra.
Dấu o là không xảy ra phản ứng.
a) Sửa lại những dấu x và o không đúng trong các ô của bảng.
b) Bổ sung dấu x hoặc dấu o vào những dấu chấm trong các ô trống.
c) Viết các phương trình hoá học của phản ứng xảy ra theo dấu x.
Lời giải:
a) + b):
Ta có: bảng về mối quan hệ giữa một kim loại với một số dung dịch muối:
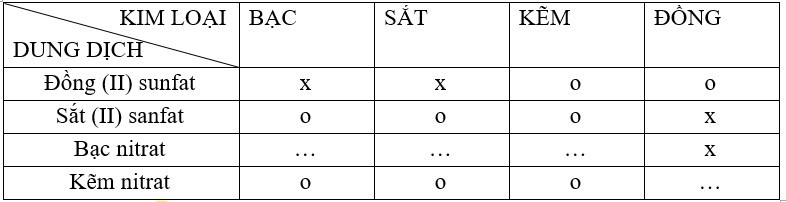
Các phương trình hóa học của phản ứng xảy ra theo dấu x
Fe + CuSO4 → FeSO4 + Cu↓
Zn + CuSO4 → ZnSO4 + Cu↓
Zn + FeSO4 → ZnSO4 + Fe↓
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag↓
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Bài 12.2 trang 16 SBT Hóa 9: Có những chất sau : CuSO4, CuCl2, CuO, Cu(OH)2, Cu(NO3)2.
a) Hãy sắp xếp các chất đã cho thành một dãy chuyển đổi hoá học.
b) Viết các phương trình hoá học theo dãy chuyển đổi đã sắp xếp.
Lời giải:
a) Có nhiều cách sắp xếp các chất đã cho thành các dãy chuyển đổi hoá học, miễn sao từ chất đứng trước có thể điều chế trực tiếp chất đứng sau. Thí dụ:
Dãy chuyển hóa (1):
CuSO4 CuCl2 Cu(OH)2 CuO Cu(NO3)2.
Dãy chuyển hóa (2):
Cu(OH)2 CuO CuSO4 CuCl2 Cu(NO3)2.
- Các phương trình hoá học của dãy chuyển hoá (1)
(1) CuSO4 + BaCl2 → BaSO4 ↓ + CuCl2
(2) CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
(3) Cu(OH)2 CuO + H2O
(4) CuO + 2HNO3 → Cu(NO3)2 + H2O
- Các phương trình hoá học của dãy biến hoá (2)
(1) Cu(OH)2 CuO + H2O
(2) CuO + H2SO4 → CuSO4 + H2O
(3) CuSO4 + BaCl2 → BaSO4↓ + CuCl2
(4) CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2
Bài 12.3 trang 16 SBT Hóa 9: Có 5 ống nghiệm A, B, C, D, E. Mỗi ống có chứa 12,4 gam đồng (II) cacbonat CuCO3. Khi đun nóng, muối này bị phân huỷ dần :
|
|
||||
a) Hãy dùng những kết quả ở bảng trên để trả lời những câu hỏi sau:
1. Ống nghiệm nào đã bị bỏ quên, không đun nóng ?
2. Ống nghiệm nào có kết quả cuối cùng dự đoán là sai ? Vì sao ?
3. Vì sao khối lượng chất rắn trong ống nghiệm A là không đổi sau lần nung thứ 3 và thứ 4 ?
4. Ống nghiệm nào mà toàn lượng đồng (II) cacbonat đã bị phân huỷ sau lần nung thứ nhất ?
b) Hãy tính toán để chứng minh kết quả thí nghiệm của những ống nghiệm nào là đúng.
Lời giải:
a) 1. Ống nghiệm E vì khối lượng CuCO3 không thay đổi.
2. Ống nghiệm C, vì khác với các kết quả của những ống nghiệm A, B, D.
3. Sau lần nung thứ 3 thì toàn lượng CuCO3 đã bị phân huỷ hết thành CuO.
4. Ống nghiệm D.
b) Phần tính toán :
Theo phương trình hoá học :
124 gam CuCO3 sau khi bị phân huỷ sinh ra 80 gam CuO.
Vậy 12,4 gam CuCO3 sau khi bị phân huỷ sinh ra:
mCuO = = 8 gam
Thí nghiệm được tiến hành trong các ống nghiệm A, B, D là đúng.
Bài 12.4 trang 17 SBT Hóa 9: Dẫn ra những phản ứng hoá học để chứng minh rằng :
a) Từ các đơn chất có thể điều chế hợp chất hoá học.
b) Từ hợp chất hoá học có thể điều chế các đơn chất.
c) Từ hợp chất hoá học này có thể điều chế hợp chất hoá học khác.
Lời giải:
a) Thí dụ, từ hai đơn chất Na và Cl2 có thể điều chế hợp chất NaCl.
2Na + Cl2 2NaCl
b) Từ hợp chất H2O bằng phương pháp điện phân có thể điều chế các đơn chất là H2 và O2.
2H2O 2H2 + O2
c) Từ hợp chất bazơ Cu(OH)2 có thể điều chế hợp chất oxit CuO bằng phương pháp nhiệt phân. Hoặc từ muối CaCO3 có thể điều chế các oxit CaO, CO2.
Cu(OH)2 CuO + H2O
CaCO3 CaO + CO2↑
Bài 12.5 trang 17 SBT Hóa 9: Có những chất sau :
a) Chất nào tác dụng với dung dịch HCl hoặc H2SO4 loãng, sinh ra
1. chất khí cháy được trong không khí ?
2. chất khí làm đục nước vôi trong ?
3. dung dịch có màu xanh lam ?
4. dung dịch không màu và nước ?
b) Chất nào không tác dụng với dung dịch HCl và axit sunfuric loãng ?
Lời giải:
a) 1. D. Mg, sinh ra khí hiđro cháy được trong không khí.
2. C. MgCO3, khí sinh ra là CO2 làm đục nước vôi trong.
3. B. CuO, dung dịch muối đồng có màu xanh.
4. E. MgO, dung dịch thu được không màu.
b) A. Cu. Vì Cu đứng sau H trong dãy hoạt động của kim loại nên không phản ứng với dung dịch HCl và axit sunfuric loãng.
Bài 12.6 trang 17 SBT Hóa 9: Từ những chất đã cho: Na2O, Fe2(SO4)3, H2O, H2SO4, CuO, hãy viết các phương trình hoá học điều chế những bazơ sau:
Lời giải:
a) Điều chế NaOH theo sơ đồ:
Na2O NaOH
Na2O + H2O → 2NaOH
b) Điều chế Fe2(SO4)3 theo sơ đồ:
Fe2(SO4)3 Fe(OH)3
Fe2(SO4)3 + 6NaOH → 2Fe(OH)3 + 3Na2SO4
c) Điều chế Cu(OH)2 :
CuO CuSO4 Cu(OH)2
CuO + H2SO4 → CuSO4 + H2O
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Bài 12.7* trang 17 SBT Hóa 9: Ca(OH)2 dư, sinh ra 1 gam kết tủa trắng. Nếu cho hỗn hợp này tác dụng với CuO dư, nung nóng, thu được 0,64 gam kim loại màu đỏ.
a) Viết các phương trình hoá học.
b) Xác định thành phần phần trăm theo thể tích của hỗn hợp khí.
Lời giải:
a) Các phương trình hoá học :
- CO2 tác dụng với dung dịch Ca(OH)2 dư, sinh ra kết tủa CaCO3 :
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O (1)
- CO khử CuO thành kim loại Cu màu đỏ :
CO + CuO CO2 + Cu (2)
b) Xác định thành phần của hỗn hợp khí:
- Số mol CO2 có trong hỗn hợp được tính theo (1):
= 0,01 mol
- Số mol CO có trong hỗn hợp được tính theo (2):
nCO = nCu = = 0,01mol
Thành phần phần trăm theo thể tích của hỗn hợp khí được tính theo số mol của mỗi khí. Mà hai khí có số mol bằng nhau nên hỗn hợp khí có 50% thể tích của mỗi khí.
Bài 12.8 trang 17 SBT Hóa 9: Cho một dung dịch có chứa 10 gam NaOH tác dụng với một dung dịch có chứa 10 gam HNO3.
Lời giải:
a) Phương trình hoá học:
NaOH + HNO3 → NaNO3 + H2O
b) Dung dịch sau phản ứng có chứa NaOH hay HNO3 dư sẽ quyết định màu của quỳ tím.
- Số mol các chất đã dùng :
Nhận thấy, số mol NaOH nhiều hơn số mol HNO3. Theo phương trình hoá học, ta thấy khi phản ứng kết thúc, trong dung dịch còn dư NaOH. Do vậy, dung dịch sau phản ứng làm cho quỳ màu tím chuyển thành màu xanh.
Xem thêm lời giải sách bài tập Hóa học lớp 9 hay, chi tiết khác:
Bài 15, 16 và 17: Tính chất của kim loại và dãy hoạt động của kim loại
Bài 20: Hợp kim sắt: Gang, thép
Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
Xem thêm tài liệu sách bài tập Hóa học lớp 9 hay, chi tiết khác:
Lý thuyết Mối quan hệ giữa các loại hợp chất vô cơ
Trắc nghiệm Mối liên hệ giữa các loại chất vô cơ có đáp án
Xem thêm các chương trình khác:
- Tóm tắt tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Soạn văn 9 (hay nhất) | Để học tốt Ngữ văn 9 (sách mới)
- Soạn văn 9 (ngắn nhất)
- Văn mẫu 9 (sách mới) | Để học tốt Ngữ văn 9 Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Tác giả - tác phẩm Ngữ văn 9 (sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Giải sgk Toán 9 (sách mới) | Giải bài tập Toán 9 Tập 1, Tập 2
- Giải sbt Toán 9
- Lý thuyết Toán 9
- Các dạng bài tập Toán lớp 9
- Giáo án Toán lớp 9 mới nhất
- Bài tập Toán lớp 9 mới nhất
- Chuyên đề Toán lớp 9 mới nhất
- Giải sgk Tiếng Anh 9 (thí điểm)
- Giải sgk Tiếng Anh 9 (sách mới) | Để học tốt Tiếng Anh 9
- Giải sbt Tiếng Anh 9
- Giải sbt Tiếng Anh 9 (thí điểm)
- Giải sgk Sinh học 9 (sách mới) | Giải bài tập Sinh học 9
- Giải vở bài tập Sinh học 9
- Lý thuyết Sinh học 9
- Giải sbt Sinh học 9
- Giải sgk Vật Lí 9 (sách mới) | Giải bài tập Vật lí 9
- Giải sbt Vật Lí 9
- Lý thuyết Vật Lí 9
- Các dạng bài tập Vật lí lớp 9
- Giải vở bài tập Vật lí 9
- Giải sgk Địa Lí 9 (sách mới) | Giải bài tập Địa lí 9
- Lý thuyết Địa Lí 9
- Giải Tập bản đồ Địa Lí 9
- Giải sgk Tin học 9 (sách mới) | Giải bài tập Tin học 9
- Lý thuyết Tin học 9
- Lý thuyết Giáo dục công dân 9
- Giải vở bài tập Lịch sử 9
- Giải Tập bản đồ Lịch sử 9
- Lý thuyết Lịch sử 9
- Lý thuyết Công nghệ 9