[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề)
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 13)
-
5334 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Gọi công thức phân tử của este no, đơn chức, mạch hở X là CnH2nO2 (n ≥ 2).
Từ %mH ⟹ n ⟹ CTPT của X ⟹ Đồng phân cấu tạo của X.
Giải chi tiết:
Gọi công thức phân tử của este no, đơn chức, mạch hở X là CnH2nO2 (n ≥ 2).
⟹ CTPT của X là C4H8O2.
Các đồng phân cấu tạo của X là
HCOOCH2CH2CH3
HCOOCH(CH3)CH3
CH3COOCH2CH3
CH3CH2COOCH3
⟹ Có tất cả 4 đồng phân.
Câu 2:
20/07/2024Trong các chất dưới đây, chất nào có tính bazơ mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Sắp xếp tính bazơ tăng dần của các hợp chất amin:
Amin thơm < NH3 < amin no bậc 1 < amin no bậc 2.
Giải chi tiết:
Chất có tính bazơ mạnh nhất là (CH3)2NH (amin no bậc 2).
Câu 3:
19/07/2024Dung dịch chất nào sau đây làm quỳ tím hóa đỏ?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dung dịch mang tính axit làm quỳ tím hóa đỏ.
Giải chi tiết:
Dung dịch axit glutamic (HOOC-CH(NH2)-CH2-CH2-COOH) làm quỳ tím hóa đỏ.
Câu 4:
21/07/2024Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào kiến thức về điều chế kim loại (Hóa 12).
Giải chi tiết:
Kim loại Al được điều chế bằng phương pháp điện phân nóng chảy (thường là điện phân Al2O3).
PTHH: 2Al2O3 4Al + 3O2
Câu 5:
23/07/2024Trong môi trường kiềm, protein có khả năng phản ứng màu biure với
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào kiến thức về tính chất hóa học của protein.
Giải chi tiết:
Trong môi trường kiềm, protein có khả năng phản ứng màu biure với Cu(OH)2.
Câu 6:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Chất bột chứa trong khẩu trang phải có tính hấp phụ các hợp chất độc hại trong không khí ⟹ có khả năng lọc không khí.
Giải chi tiết:
Một số loại khẩu trang y tế chứa chất bột màu đen có khả năng lọc không khí là than hoạt tính.
Câu 7:
20/07/2024Este nào sau đây khi tác dụng với dung dịch NaOH đun nóng, thu được hỗn hợp sản phẩm gồm CH3COONa và CH3CHO?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Este + NaOH → muối axetat và anđehit axetic
⟹ Este X được tạo bởi axit axetic và gốc vinyl.
Giải chi tiết:
PTHH: CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO.
Vậy este là CH3COOCH=CH2.
Câu 8:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào tính chất hóa học của chất béo.
Giải chi tiết:
Bằng phản ứng hiđro hóa có thể chuyển hóa trực tiếp chất béo lỏng (triglixerit của axit béo không no) sang chất béo rắn (triglixerit của axit béo no).
Câu 9:
19/07/2024Polime nào sau đây thuộc loại polime thiên nhiên?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về vật liệu polime.
Giải chi tiết:
Tinh bột thuộc loại polime thiên nhiên.
Câu 10:
19/07/2024Các este thường có mùi thơm đặc trưng, isoamyl axetat có mùi thơm của loại hoa (quả) nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào kiến thức về tính chất vật lý (mùi đặc trưng) của một số este thường gặp.
Giải chi tiết:
Isoamyl axetat là este có mùi thơm của chuối chín.
Câu 11:
22/07/2024Công thức của tripanmitin là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào kiến thức về chất béo (lipit).
Giải chi tiết:
Công thức của tripanmitin là (C15H31COO)3C3H5.
Câu 12:
23/07/2024Thủy phân este nào sau đây trong môi trường kiềm tạo ra 2 sản phẩm hữu cơ có cùng số nguyên tử cacbon?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Viết phương trình thủy phân các este có trong đáp án ⟹ Este thỏa mãn.
Giải chi tiết:
PTHH: CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (2 sản phẩm hữu cơ cùng có số cacbon là 2).
Vậy este thỏa mãn là CH3COOC2H5.
Câu 13:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào phương trình xà phòng hóa ⟹ neste ⟹ m.
Giải chi tiết:
Muối thu được trong dung dịch là CH3CH2COOK.
+ nmuối = 16,8/112 = 0,15 (mol).
PTHH: CH3CH2COOC2H5 + KOH → CH3CH2COOK + C2H5OH
Theo PTHH ⟹ neste = nmuối = 0,15 (mol).
Vậy m = 0,15.102 = 15,3 (g).
Câu 14:
23/07/2024Sắp xếp theo chiều nhiệt độ sôi tăng dần của các chất sau đây (1) C3H7COOH; (2) CH3COOC2H5; (3) C3H7CH2OH. Ta có thứ tự là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Sắp xếp các hợp chất theo chiều tăng dần nhiệt độ sôi: este < ancol < axit.
Giải chi tiết:
Các chất sắp xếp theo chiều nhiệt độ sôi tăng dần là CH3COOC2H5 (2) < C3H7CH2OH (3) < C3H7COOH (1).
Câu 15:
19/07/2024Thủy phân một peptit: Ala-Gly-Glu-Val-Lys thì trong sản phẩm thu được sẽ không chứa peptit nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học (phản ứng thủy phân) của peptit.
Giải chi tiết:
Thủy phân một peptit: Ala-Gly-Glu-Val-Lys thì trong sản phẩm thu được sẽ không chứa peptit Glu-Lys.
Câu 16:
19/07/2024Trong các chất dưới đây, chất nào là đipeptit?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Đipeptit là peptit được cấu tạo từ 2 α-amino axit (chỉ có 1 liên kết CO-NH trong công thức cấu tạo).
Giải chi tiết:
Hợp chất là đipeptit là H2N-CH2-CO-NH-CH(CH3)-COOH (được cấu tạo từ 2 α-amino axit là glyxin và alanin).
Câu 17:
19/07/2024Các chất vừa tác dụng được với dung dịch HCl vừa tác dụng được với dung dịch Cu(NO3)2 là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào tính chất hóa học của axit HCl và muối Cu(NO3)2.
Giải chi tiết:
Dãy chất vừa tác dụng được với dung dịch HCl vừa tác dụng được với dung dịch Cu(NO3)2 là Zn, Al và Fe.
PTHH:
Zn + 2HCl → ZnCl2 + H2
Zn + Cu(NO3)2 → Cu + Zn(NO3)2
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Fe + 2HCl → FeCl2 + H2
Fe + Cu(NO3)2 + Fe(NO3)2 + Cu
Câu 18:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào kiến thức về các hợp chất quan trọng trong chương Cacbon – Silic (Hóa 11).
Giải chi tiết:
“Nước đá khô” là CO2 rắn.
Câu 19:
19/07/2024Cho các chất sau: propan, etilen, propin, benzen, toluen, stiren, phenol, vinyl axetat, anilin. Số chất tác dụng được với nước brom ở điều kiện thường là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Các hợp chất được đưa ra đều là những hợp chất quen thuộc trong chương trình hóa học hữu cơ (11 và 12).
Dựa vào tính chất hóa học của các hợp chất ⟹ Số chất tác dụng với nước brom ở điều kiện thường.
Giải chi tiết:
Các chất tác dụng với nước brom ở điều kiện thường là etilen, propin, stiren, phenol, vinyl axetat và anilin (6 chất).
PTHH:
CH2 = CH2 + Br2 → CH2Br – CH2Br (etilen)
CH ≡ C – CH3 + Br2 → CHBr2 – CBr2 – CH3 (propin)
C6H5CH = CH2 + Br2 → C6H5CHBr – CH2Br (stiren)
C6H5OH + 3Br2 → C6H2(Br3)OH ↓ + 3HBr (phenol)
CH3COOCH = CH2 + Br2 → CH3COOCHBr– CH2Br (vinyl axetat)
C6H5NH2 + 3Br2 → C6H2(Br3)NH2 ↓ + 3HBr (anilin)
Câu 20:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào kiến thức về vật liệu polime.
Giải chi tiết:
Tơ nilon-6,6 là sản phẩm của quá trình đồng trùng ngưng axit ađipic và hexametylenđiamin.
PTHH: nHOOC[CH2]4COOH + nH2N[CH2]6NH2 (-HN[CH2]6NHCO[CH2]4CO-)n + 2nH2O
Câu 21:
19/07/2024Ion nào sau đây có tính oxi hóa mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào dãy điện hóa của kim loại.
Giải chi tiết:
Ion Ag+ có tính oxi hóa mạnh nhất trong các ion Ca2+, Ag+, Fe2+ và Zn2+.
Câu 22:
19/07/2024Chất nào sau đây không tham gia phản ứng thủy phân?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất cacbohiđrat.
Giải chi tiết:
Glucozơ là monosaccarit nên không tham gia phản ứng thủy phân.
Câu 23:
19/07/2024Sục khí axetilen vào dung dịch AgNO3 trong NH dư thu được kết tủa màu
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của axetilen.
Giải chi tiết:
PTHH: CH ≡ CH + 2AgNO3 + 2NH3 → CAg ≡ CAg ↓vàng + 2NH4NO3.
Vậy sục khí axetilen vào dung dịch AgNO3 trong NH dư thu được kết tủa màu vàng (C2Ag2).
Câu 24:
19/07/2024Cho các chất: NaOH, Cu, Ba, Fe, AgNO3, K2SO4. Số chất phản ứng được với dung dịch FeCl3 là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào tính chất hóa học của FeCl3.
Giải chi tiết:
Các chất tác dụng được với dung dịch FeCl3 là NaOH, Cu, Ba, Fe, AgNO3 (5 chất).
PTHH:
1) FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
2) Cu + 2FeCl3 → CuCl2 + 2FeCl2
3) Ba + 2H2O → Ba(OH)2 + H2 ↑
2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3 ↓ + 3BaCl2
4) 2FeCl3 + Fe → 3FeCl2
5) 3AgNO3 + FeCl3 → 3AgCl ↓ + Fe(NO3)3
Câu 25:
19/07/2024Polime dùng để chế tạo thuỷ tinh hữu cơ (plexiglas) được điều chế bằng phản ứng trùng hợp
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về vật liệu polime.
Giải chi tiết:
Polime dùng để chế tạo thuỷ tinh hữu cơ (plexiglas) được điều chế bằng phản ứng trùng hợp CH2=C(CH3)COOCH3 (metyl metacrylat).
Câu 26:
22/07/2024Kim loại Al tan được trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Tính chất hóa học của nhôm.
Giải chi tiết:
- Loại A, C vì Al bị thụ động trong HNO3 đặc nguội và H2SO4 đặc nguội.
- Loại B vì Al yếu hơn Mg nên không đẩy được Mg ra khỏi muối MgSO4.
- Al phản ứng được với HCl:
2Al + 6HCl → 2AlCl3 + 3H2
Câu 27:
22/07/2024Saccarozơ và glucozơ đều có
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết tổng hợp về saccarozơ và glucozơ.
Giải chi tiết:
A đúng, vì saccarozơ và glucozơ đều có nhiều nhóm OH gắn vào các nguyên tử C cạnh nhau.
B sai, cả 2 chất đều không phản ứng được với NaCl.
C sai, saccarozơ không có phản ứng tráng gương.
D sai, glucozơ không có phản ứng thủy phân.
Câu 28:
22/07/2024Ở nhiệt độ thường, kim loại nào sau đây không tác dụng với nước?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Các kim loại phản ứng với nước ở nhiệt độ thường:
- Tất cả các kim loại kiềm (nhóm IA).
- Một số kim loại kiềm thổ (trừ Be, Mg).
Giải chi tiết:
- Be không phản ứng được với nước ở nhiệt độ thường.
- Các kim loại Ca, Ba, Na phản ứng với nước ở nhiệt độ thường theo các PTHH:
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
2Na + 2H2O → 2NaOH + H2
Câu 29:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Từ tổng số mol khí và tỉ khối của khí so với H2 ⟹ nNO và nH2.
Chất rắn sau khi nung đến khối lượng không đổi là MgO ⟹ nMgO ⟹ nMg2+(dd Y).
Phản ứng sinh ra H2 nên dung dịch Y không còn NO3-; phản ứng có khả năng sinh ra muối NH4+.
Sơ đồ tóm tắt:
Vận dụng các định luật bảo toàn điện tích, bảo toàn nguyên tố để xác định số mol Al trong hỗn hợp X.
Giải chi tiết:
Tính số mol mỗi khí:
Chất rắn sau khi nung đến khối lượng không đổi là MgO ⟹ nMgO = 20/40 = 0,5 mol.
BTNT "Mg" ⟹ nMg2+(dd Y) = nMgO = 0,5 mol.
Phản ứng sinh ra H2 nên dung dịch Y không còn NO3-; phản ứng có khả năng sinh ra muối NH4+.
Sơ đồ tóm tắt:
+) BTĐT dd Y: 3a + 2.0,5 + b + 0,05 = 2.0,85 (1)
+) mmuối (dd Y) = 27a + 24.0,5 + 18b + 39.0,05 + 96.0,85 = 101,85 (2)
Giải hệ (1) (2) được a = 0,2 và b = 0,05.
+) BTNT "N" ⟹ nAl(NO3)3 = (nNH4+ + nNO - nKNO3)/3 = 0,05 mol.
+) BTNT "Al" ⟹ nAl = nAl3+(dd Y) - nAl(NO3)3 = 0,15 mol.
⟹ %mAl = = 14,31%.
Câu 30:
22/07/2024Hỗn hợp X gồm chất Y (C2H8N2O4) và chất Z (C5H10N2O3); trong đó, Y là muối của axit đa chức, Z là đipeptit mạch hở. Cho 34,3 gam X tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,2 mol khí. Mặt khác 34,3 gam X tác dụng với dung dịch HCl dư, thu được m gam chất hữu cơ. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Y có CTPT C2H8N2O4 và là muối của axit đa chức ⟹ Y: (COONH4)2
Z có CTPT C5H10N2O3 và là đipeptit ⟹ Z: Ala-Gly hoặc Gly-Ala
*Khi cho hỗn hợp X + dd NaOH thì (COONH4)2 tạo khí:
(COONH4)2 + 2NaOH → (COONa)2 + 2NH3 + 2H2O
+ Từ số mol khí ⟹ nY ⟹ mY.
+ Từ khối lượng hỗn hợp X và khối lượng Y vừa tính được ⟹ mZ ⟹ nZ.
*Khi cho hỗn hợp X + dd HCl dư:
(COONH4)2 + 2HCl → (COOH)2 + 2NH4Cl
Ala-Gly + H2O + 2HCl → AlaHCl + GlyHCl
Trong tất cả các chất tạo thành (trừ NH4Cl) đều là chất hữu cơ
BTKL: mchất hữu cơ = mX + mHCl pư + mH2O - mNH4Cl.
Giải chi tiết:
Y có CTPT C2H8N2O4 và là muối của axit đa chức ⟹ Y: (COONH4)2
Z có CTPT C5H10N2O3 và là đipeptit ⟹ Z: Ala-Gly hoặc Gly-Ala
*Khi cho hỗn hợp X + dd NaOH thì (COONH4)2 tạo khí:
(COONH4)2 + 2NaOH → (COONa)2 + 2NH3 + 2H2O
0,1 ← 0,2 (mol)
⟹ mZ = 34,3 - 0,1.124 = 21,9 gam ⟹ nZ = 21,9/(75 + 89 - 18) = 0,15 mol.
*Khi cho hỗn hợp X + dd HCl dư:
(COONH4)2 + 2HCl → (COOH)2 + 2NH4Cl
0,1 → 0,2 → 0,1 → 0,2 (mol)
Ala-Gly + H2O + 2HCl → AlaHCl + GlyHCl
0,15 → 0,15 → 0,3 (mol)
Trong tất cả các chất tạo thành (trừ NH4Cl) đều là chất hữu cơ
BTKL: mchất hữu cơ = mX + mHCl pư + mH2O - mNH4Cl
= 34,3 + 36,5.(0,2 + 0,3) + 18.0,15 - 0,2.53,5
= 44,55 gam.
Câu 31:
19/07/2024Nung nóng hỗn hợp X gồm metan, etilen, propin, vinyl axetilen và a mol H2 có Ni xúc tác (chỉ xảy ra phản ứng cộng H2) thu được 0,2 mol hỗn hợp Y (gồm các hiđrocacbon) có tỉ khối so với H2 là 14,5. Biết 0,2 mol Y phản ứng tối đa với 0,1 mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Đặt công thức trung bình của Y có dạng: CnH2n+2-2k.
PTHH: CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k.
Từ số mol Y và Br2 đã biết đặt vào PTHH tìm được k.
Từ MY ⟹ giá trị của n ⟹ CT trung bình Y.
Do các hiđrocacbon trong X đều có 4H và phản ứng cộng không làm thay đổi số C ⟹ CT trung bình X.
Từ đó viết phương trình X phản ứng với H2 tạo ra Y, tìm được số mol H2.
Giải chi tiết:
*Xét phản ứng của Y và Br2:
nY = 0,2 mol; nBr2 = 0,1 mol.
Đặt CT trung bình của Y là CnH2n+2-2k.
CnH2n+2-2k + kBr2 → CnH2n+2-2kBr2k
0,2 → 0,2k (mol)
Mà nBr2 = 0,2k = 0,1 → k = 0,5.
Do MY = 14,5.MH2 = 29 nên 14n + 2 - 2k = 29 → n = 2.
→ CT trung bình của Y: C2H5.
*Do các hiđrocacbon trong X đều có 4H và phản ứng cộng không làm thay đổi số C
⟹ CT trung bình của X: C2H4.
*Xét phản ứng X + H2 (a mol):
C2H4 + 0,5H2 → C2H5
0,1 ← 0,2 (mol)
Vậy a = 0,1 mol.
Câu 32:
19/07/2024Đốt cháy hoàn toàn m gam hỗn hợp X gồm hai este đồng phân cần dùng 31,36 lít khí O2 (đktc), thu được 26,88 lít khí CO2 và 21,6 gam H2O. Nếu cho m gam X tác dụng hết với 500 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thì thu được 32,6 gam chất rắn khan, trong đó có a mol muối Y và b mol muối Z (MY < MZ). Các thể tích khí đều đo ở điều kiện tiêu chuẩn. Tỉ lệ a:b là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Ta thấy nCO2 = nH2O ⟹ Este no, đơn chức, mạch hở.
BTNT O ⟹ nO(X) = 2nCO2 + nH2O - 2nO2.
Do các este đơn chức nên có 2O ⟹ nX = ½ nO(X).
⟹ Số C =
⟹ CTPT ⟹ CTCT của các este.
Giải chi tiết:
nO2 = 1,4 mol; nCO2 = 1,2 mol; nH2O = 1,2 mol.
Ta thấy nCO2 = nH2O ⟹ Este no, đơn chức, mạch hở.
BTNT O ⟹ nO(X) = 2nCO2 + nH2O - 2nO2 = 0,8 mol.
Do các este đơn chức nên có 2O ⟹ nX = ½ nO(X) = 0,4 mol.
⟹ Số C = = = 3
⟹ CTPT là C3H6O2
⟹ Este HCOOC2H5 và CH3COOCH3
Do MY < MZ ⟹ Y: HCOONa và Z: CH3COONa
⟹ Chất rắn khan chứa: HCOONa (a mol); CH3COOCH3 (b mol) và NaOH dư (0,5 - 0,4 = 0,1 mol)
Ta có hệ phương trình
⟹ a : b = 0,3 : 0,1 = 3 : 1.
Câu 33:
19/07/2024Thủy phân 250 gam dung dịch saccarozo 6,84%, sau một thời gian, lấy hỗn hợp sản phẩm cho tác dụng với dung dịch AgNO3/NH3 dư, sau phản ứng thu được 17,28 gam Ag. Tính hiệu suất phản ứng thủy phân?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Tính được mSac(bđ) = mdd.C% ⟹ nSac(bđ).
- Sơ đồ: Sac → Glu + Fruc → 4Ag
Từ nAg ⟹ nSac(pư).
- Tính hiệu suất phản ứng thủy phân theo công thức:
Giải chi tiết:
mSac(bđ) = 250.6,84% = 17,1 gam ⟹ nSac(bđ) = 17,1/342 = 0,05 mol
nAg = 17,28/108 = 0,16 mol
Sơ đồ: Sac → Glu + Fruc → 4Ag
0,04 ← 0,16 (mol)
⟹ nSac(pư) = 0,04 mol
⟹ H% = = = 80%.
Câu 34:
19/07/2024Hòa tan 42,9 gam hỗn hợp E gồm hai muối M2CO3 và MHCO3 vào nước, thu được dung dịch X. Chia X thành hai phần bằng nhau. Cho phần một tác dụng hoàn toàn với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Cho phần hai tác dụng hoàn toàn với dung dịch BaCl2 dư, thu được 19,7 gam kết tủa. Phát biểu nào dưới đây đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
- Phần 2 tác dụng BaCl2 dư thì chỉ có M2CO3 phản ứng ⟹ nM2CO3 = nBaCO3.
- Phần 1 tác dụng với Ba(OH)2 dư thì cả 2 chất đều phản ứng ⟹ nMHCO3 = nBaCO3 - nM2CO3.
- Từ khối lượng và số mol mỗi chất ⟹ M = 18 (NH4+).
- Từ đó xét tính đúng/sai của các nhận định.
Giải chi tiết:
Giả sử mỗi phần:
- Phần 2 tác dụng BaCl2 dư thì chỉ có M2CO3 phản ứng
BTNT C ⟹ nM2CO3 = nBaCO3 = 19,7/197 = 0,1 mol
- Phần 1 tác dụng với Ba(OH)2 dư thì cả 2 chất đều phản ứng
BTNT C ⟹ nM2CO3 + nMHCO3 = nBaCO3 ⟹ 0,1 + nMHCO3 = 49,25/197 ⟹ nMHCO3 = 0,15 mol.
- Mỗi phần có khối lượng là 21,45 gam
⟹ 0,1.(2M + 60) + 0,15.(M + 61) = 21,45
⟹ M = 18 (NH4+)
- Xét các nhận định:
+ 2 muối có số mol khác nhau ⟹ A sai.
+ Cả 2 muối đều bị nhiệt phân ⟹ B sai.
(NH4)2CO3 → 2NH3 + H2O + CO2
NH4HCO3 → NH3 + H2O + CO2
+ Khi cho toàn bộ X tác dụng NaOH:
Toàn bộ X chứa
(NH4)2CO3 + 2NaOH → Na2CO3 + 2NH3 + 2H2O
NH4HCO3 + 2NaOH → Na2CO3 + NH3 + 2H2O
⟹ nNaOH = 2.n(NH4)2CO3 + 2nNH4HCO3 = 1 mol ⟹ C sai, D đúng.
Câu 35:
21/07/2024Cho các thí nghiệm sau:
(1) Cho hỗn hợp gồm x mol Cu và x mol Fe3O4 vào dung dịch chứa 4x mol H2SO4 loãng.
(2) Cho hỗn hợp NaHSO4 và KHCO3 (tỉ lệ mol 1:1) vào nước dư.
(3) Cho x mol Fe vào dung dịch chứa 2,5x mol AgNO3.
(4) Cho dung dịch chứa x mol Ba(OH)2 vào dung dịch chứa x mol NaHCO3.
(5) Cho Na2CO3 dư vào dung dịch chứa BaCl2.
(6) Cho x mol Fe3O4 vào dung dịch chứa 8x mol HCl.
Sau khi các phản ứng kết thúc mà sau thí nghiệm thu được dung dịch chứa 2 muối là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Viết PTHH, suy ra các phản ứng kết thúc mà sau thí nghiệm thu được dung dịch chứa 2 muối.
Giải chi tiết:
(1) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
x 4x → x x
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
x x → x → 2x
⟹ dung dịch chứa 2 muối CuSO4 và FeSO4.
(2) 2NaHSO4 + 2KHCO3 → Na2SO4 + K2SO4 + 2H2O + 2CO2 ↑
1 1
⟹ dung dịch chứa 2 muối Na2SO4 và K2SO4.
(3) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
x → 2x còn 0,5x → x
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
0,5x ← 0,5x → 0,5x
⟹ dung dịch chứa 2 muối Fe(NO3)2 và Fe(NO3)3.
(4) Ba(OH)2 + NaHCO3 → BaCO3 + NaOH + H2O
x x
⟹ dung dịch chỉ chứa NaOH.
(5) Na2CO3 dư + BaCl2 → BaCO3 ↓ + 2NaCl
⟹ dung dịch chứa 2 muối NaCl và Na2CO3 dư.
(6) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
x 8x
⟹ dung dịch thu được chứa 2 muối FeCl2 và FeCl3.
⟹ 5 phản ứng thu được 2 muối.
Câu 36:
22/07/2024Dẫn khí CO dư qua ống sứ đựng 23,2 gam bột Fe3O4 nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Tính số mol Fe3O4 ⟹ số mol O trong oxit.
- Sơ đồ các phản ứng:
CO + O → CO2
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
⟹ nCaCO3 = nCO2 = nO(oxit).
Giải chi tiết:
nFe3O4 = 23,2/232 = 0,1 mol ⟹ nO = 4nFe3O4 = 0,4 mol (bảo toàn nguyên tố O).
CO + O → CO2
0,4 → 0,4 (mol)
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
0,4 → 0,4 (mol)
⟹ m = mCaCO3 = 0,4.100 = 40 gam.
Câu 37:
23/07/2024Hình vẽ mô tả quá trình điều chế khí metan trong phòng thí nghiệm:
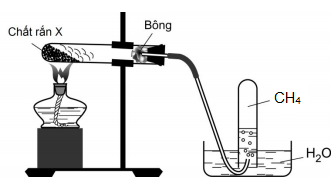
Một học sinh dựa vào thí nghiệm trên đã nêu ra các phát biểu sau:
(a) Khí metan dễ tan trong nước nên cần phải thu bằng phương pháp đẩy nước.
(b) Các chất rắn trong X có thể là CaO, NaOH, CH3COONa.
(c) Ống nghiệm đựng chất rắn khi lắp cần phải cho miệng hơi chúc xuống dưới.
(d) Khi kết thúc thí nghiệm phải tắt đèn cồn trước rồi mới tháo ống dẫn khí.
(e) CaO là chất bảo vệ ống thủy tinh, tránh bị nóng chảy.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết về phản ứng vôi tôi xút điều chế ankan.
Giải chi tiết:
(a) sai, khí metan hầu như không tan trong nước nên ta thu khí bằng phương pháp đẩy nước.
(b) đúng, PTHH: CH3COONa + NaOH CH4 ↑ + Na2CO3.
(c) đúng, để tránh trường hợp hóa chất bị ẩm khi đun nóng hơi nước bay lên và bị ngưng tụ tại miệng ống nghiệm chảy ngược lại gây vỡ ống nghiệm.
(d) sai, nếu làm vậy phần không khí trong ống nghiệm có nhiệt độ giảm đột ngột khiến áp suất trong ống giảm, nước sẽ bị hút vào ống nghiệm, mà ống nghiệm đang nóng sẽ gây vỡ ống nghiệm.
(e) sai, CaO là chất hút ẩm tránh tạo dung dịch NaOH đặc để ăn mòn thủy tinh.
Vậy có 2 phát biểu đúng.
Câu 38:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
- So sánh thấy mCu max < mchất rắn đề bài ⟹ Kim loại còn dư, muối CuSO4 hết.
- Ta xét 2 trường hợp sau:
+ Trường hợp 1: Mg dư, Al chưa phản ứng
+ Trường hợp 2: Mg hết, Al dư
Giải chi tiết:
nCuSO4 = 0,2.2 = 0,4 mol.
mCu max = 0,4.64 = 25,6 gam < mchất rắn đề bài ⟹ Kim loại còn dư, muối CuSO4 hết.
Giả sử hỗn hợp đầu chứa ⟹ 24a + 27b = 11,85 (1)
Trường hợp 1: Mg dư, Al chưa phản ứng
Áp dụng bảo toàn e: 2nMg(pư) = 2nCu ⟹ nMg(pư) = nCu = 0,4 mol.
Chất rắn chứa ⟹ mchất rắn = 24.(a - 0,4) + 27b + 64.0,4 = 29,65 (2)
Giải (1), (2) thấy vô nghiệm.
Trường hợp 2: Mg hết, Al dư
Áp dụng bảo toàn e: 2nMg + 3nAl(pư) = 2nCu
⟹ 2a + 3nAl(pư) = 2.0,4
⟹ nAl(pư) = (mol)
Chất rắn chứa ⟹ mchất rắn = 27. + 64.0,4 = 29,65 (3)
Giải (1), (3) được a = 0,1; b = 0,35.
⟹ %mAl = = 79,75%.
Câu 39:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Đặt nO(X) = a mol.
Dựa vào phần trăm khối lượng của O trong X suy ra khối lượng của X (theo a).
Mặt khác, bảo toàn nguyên tố O: nCOOH(X) = ½.nO(X).
Bản chất phản ứng: COOH + NaOH → COONa + H2O
Từ số mol của COOH suy ra số mol NaOH, H2O (theo a).
Áp dụng BTKL suy ra giá trị của a ⟹ giá trị của m.
Giải chi tiết:
Đặt nO(X) = a mol ⟹ mO(X) = 16a (g) ⟹ mX = 16a.(100/41,45) (g).
Mặt khác, bảo toàn nguyên tố O: nCOOH(X) = ½.nO(X) = 0,5a (mol).
Bản chất phản ứng:
COOH + NaOH → COONa + H2O
0,5a → 0,5a → 0,5a (mol)
BTKL: mX + mNaOH = mmuối + mH2O
⟹ 16a.(100/41,45) + 40.0,5a = 49,6 + 18.0,5a
⟹ a = 1 mol
⟹ m = 16a.(100/41,45) = 38,6 gam
Câu 40:
19/07/2024Thuỷ phân hoàn toàn m gam hexapeptit X mạch hở thu được (m + 4,5) gam hỗn hợp Y gồm alanin và valin. Oxi hoá hoàn toàn một lượng hỗn hợp Y ở trên cần vừa đủ a mol khí oxi, thu được hỗn hợp Z gồm CO2, hơi H2O và N2. Dẫn hỗn hợp Z qua bình H2SO4 đậm đặc (dư) thấy khối lượng khí thoát ra khỏi bình giảm 18b gam so với khối lượng hỗn hợp Z; tỉ lệ a:b = 57:50. Để oxi hoá hoàn toàn 18,75 gam X thành CO2, H2O và N2 cần tối thiểu V lít oxi (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
*Thủy phân hexapeptit X:
A-A-A-A-A-A + 5H2O → 6A
Từ số mol H2O suy ra số mol của peptit và các amino axit.
*Đốt hỗn hợp Y gồm các amino axit:
Do Y gồm Ala và Val nên quy đổi hỗn hợp Y thành CONH, CH2, H2O
(với nCONH = na.a; nCH2 = x mol; nH2O = na.a).
Sơ đồ:
Áp dụng BTNT O ⟹ nO2 (theo x).
Mà theo đề bài: ⟹ giá trị của x.
Từ đó xác định được thành phần của Y ⟹ thành phần của X.
*Đốt X:
CONH + 0,75 O2 → CO2 + 0,5H2O
CH2 + 1,5 O2 → CO2 + H2O
⟹ nO2 = 0,75.nCONH + 1,5.nCH2 (HS nhớ luôn công thức này để làm bài nhanh hơn)
Giải chi tiết:
*Thủy phân hexapeptit X:
A-A-A-A-A-A + 5H2O → 6A
0,05 ← 0,25 → 0,3 (mol)
*Đốt hỗn hợp Y gồm các amino axit:
mH2O(Z) = mgiảm = 18b (g) ⟹ nH2O(Z) = b (mol).
Do Y gồm Ala và Val nên quy đổi hỗn hợp Y thành CONH, CH2, H2O (với số mol Y bằng số mol amino axit).
Sơ đồ:
BTNT O ⟹ nO2 = [2nCO2 + nH2O(Z) - nCONH - nH2O(Y)]/2 = 1,5x + 0,225 (mol).
Mà theo đề bài: ⟹ x = 0,8.
*Nếu đốt 25 gam X:
CONH + 0,75 O2 → CO2 + 0,5H2O
CH2 + 1,5 O2 → CO2 + H2O
⟹ nO2 = 0,75.nCONH + 1,5.nCH2 (HS nhớ luôn công thức này để làm bài nhanh hơn)
= 1,425 mol
⟹ VO2 = 31,92 lít
Đốt 25 gam X thì cần 31,92 lít O2
⟹ 18,75 gam ……… 23,94 lít.
Bài thi liên quan
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 1)
-
40 câu hỏi
-
90 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 2)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 3)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 4)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 5)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 6)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 7)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 8)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 9)
-
40 câu hỏi
-
50 phút
-
-
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề) ( đề 10)
-
40 câu hỏi
-
50 phút
-
