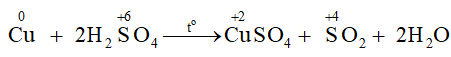Giải Hóa 11 Bài 8 (Kết nối tri thức): Sulfuric acid và muối sulfate
Với giải bài tập Hóa 11 Bài 8: Sulfuric acid và muối sulfate sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 8.
Giải Hóa 11 Bài 8: Sulfuric acid và muối sulfate
Lời giải:
- Tính chất của sulfuric acid loãng:
Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
- Tính chất của sulfuric acid đặc: Ngoài tính acid, dung dịch sulfuric acid đặc còn có tính oxi hoá và tính háo nước.
- Cách bảo quản sulfuric acid:
+ Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
+ Đặt chai, lọ đựng dung dịch sulfuric acid đặc tránh xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
- Cách sử dụng sulfuric acid để đảm bảo an toàn:
Sulfuric acid gây bỏng khi rơi vào da, do vậy cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
I. Sulfuric acid
Lời giải:
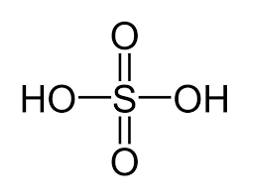
a) Công thức cấu tạo của sulfuric acid:
Như vậy, phân tử sulfuric acid có khả năng cho 2 proton khi đóng vai trò là acid.
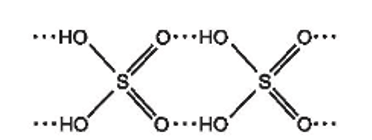
b) Với cấu tạo gồm các nguyên tử hydrogen linh động và các nguyên tử oxygen có độ âm điện lớn, giữa các phân tử sulfuric acid hình thành nhiều liên kết hydrogen:
Dự đoán sulfuric acid là chất lỏng khó bay hơi.
b) Hãy cho biết ý nghĩa cảnh báo của kí hiệu cảnh báo ở Hình 8.3.
Lời giải:
a) Các lưu ý bắt buộc để đảm bảo an toàn khi sử dụng dung dịch sulfuric acid đặc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
b) Kí hiệu cảnh báo ở Hình 8.3 có ý nghĩa đây là hoá chất ăn mòn.
Hoạt động 1 trang 50 Hóa học 11: Em hãy cho biết các tính chất hoá học cơ bản của một acid.
Lời giải:
Các tính chất hoá học cơ bản của một acid:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
Lời giải:
Các phương trình hoá học minh hoạ:
H2SO4 (loãng) + Fe → FeSO4 + H2
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
H2SO4 + BaCl2 → BaSO4 + 2HCl.
Thí nghiệm trang 51 Hóa học 11: Đồng (copper) tác dụng với dung dịch sulfuric acid đặc, nóng
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của phản ứng và xác định chất oxi hoá, chất khử.
2. Nhận xét về khả năng phản ứng của dung dịch sulfuric acid đặc, nóng với copper.
Lời giải:
1) Phương trình hoá học:
Chất khử là: Cu; chất oxi hoá là: H2SO4.
2) Dung dịch sulfuric acid đặc, nóng có tính oxi hoá mạnh, có thể oxi hoá kim loại kém hoạt động như copper…
Thí nghiệm trang 51 Hóa học 11: Dung dịch sulfuric acid đặc tác dụng với đường mía
Chuẩn bị: đường mía (C12H22O11), dung dịch sulfuric acid đặc; cốc thuỷ tinh loại 100 mL.
– Lấy khoảng 10 g đường mía cho vào cốc.
– Nhỏ đều trên bề mặt đường mía khoảng 2 mL dung dịch sulfuric acid đặc.
Lưu ý: Dung dịch sulfuric acid đặc rơi vào da sẽ gây bỏng nặng, cần cẩn thận khi sử dụng.
Quan sát, mô tả hiện tượng xảy ra và thực hiện yêu cầu sau:
1. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm.
Lời giải:
Hiện tượng: Đường mía dần dần hoá than, có hiện tượng sủi bọt đẩy C trào ra ngoài cốc.
1) Phương trình hoá học của phản ứng xảy ra:
C12H22O11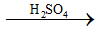
C + 2H2SO4 (đặc) → CO2 + 2SO2 + 2H2O.
2) Dự đoán: Dung dịch sulfuric acid đặc có khả năng lấy nước từ các hợp chất carbohydrate như cellulose (giấy, bông), tinh bột (gạo) và khiến chúng hoá đen (hiện tượng than hoá).
b) Chỉ ra vai trò của sulfuric acid trong mỗi phản ứng đó.
Lời giải:
a) Phương trình hoá học của phản ứng:
NaCl + H2SO4 (đặc) 
2NaBr + 3H2SO4 → 2NaHSO4 + Br2 + SO2 + 2H2O (2)
b) Phản ứng (1) không có sự thay đổi số oxi hoá của các nguyên tố, H2SO4 đặc đóng vai trò là acid.
Phản ứng (2) số oxi hoá của sulfur giảm từ +6 xuống +4, sulfuric acid đóng vai trò là chất oxi hoá.
Lời giải:
Mỗi năm cả thế giới cần đến hàng trăm triệu tấn sulfuric acid. Trong đó, gần 50% lượng acid được dùng để sản xuất phân bón như ammonium sulfate, calcium dihydrogenphosphate (Ca(H2PO4)2), … Acid này còn được sử dụng trong sản xuất chất tẩy rửa, sơn, phẩm màu, thuốc trừ sâu, giấy, chế hoá dầu mỏ,…
Sulfuric acid là một hoá chất công nghiệp rất quan trọng, sản lượng sulfuric acid của mỗi quốc gia là một chỉ số tốt về sức mạnh công nghiệp của quốc gia đó vì thế sulfuric acid là hoá chất có tầm quan trọng bậc nhất.
Lời giải:
Phương trình hoá học:
Ca3(PO4)2 + 2H2SO4 (đặc) → Ca(H2PO4)2 + 2CaSO4.
Ca3(PO4)2 + 3H2SO4 (đặc) → 2H3PO4 + 3CaSO4.
Thí nghiệm trang 53 Hóa học 11: Nhận biết ion SO42- bằng ion Ba2+
Chuẩn bị: dung dịch Na2SO4, dung dịch BaCl2; ống nghiệm, kẹp gỗ.
- Lấy khoảng 1 mL dung dịch Na2SO4 cho vào ống nghiệm.
- Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm, lắc nhẹ.
Quan sát hiện tượng xảy ra và thực hiện các yêu cầu:
1. Viết phương trình hoá học dạng phân tử và ion rút gọn.
2. Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng.
Lời giải:
Hiện tượng: Xuất hiện kết tủa trắng.
1) Phương trình hoá học dạng phân tử:
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Phương trình hoá học dạng ion thu gọn:
2) Dự đoán hiện tượng khi nhỏ dung dịch BaCl2 vào ống nghiệm đựng dung dịch H2SO4 loãng là xuất hiện kết tủa trắng barium sulfate theo phương trình hoá học:
H2SO4 + BaCl2 → BaSO4 + 2HCl.
II. Muối sulfate
Lời giải:
Các muối sulfate có nhiều ứng dụng trong đời sống:
+ Ammonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón, cung cấp đạm cho đất.
+ Magnesium sulfate (MgSO4) ở dạng tinh thể màu trắng, chủ yếu được sử dụng làm phân bón. Muối này còn được dùng làm thuốc để cung cấp magnesium cho cơ thể, giúp giảm các cơn đau cơ, giảm hiện tượng chuột rút…
+ Thạch cao nung (CaSO4. 0,5 H2O) khi nhào trộn với nước có khả năng đông cứng rất nhanh, nhờ tính chất này thạch cao nung được sử dụng làm vật liệu xây dựng, nặn đúc tượng và khuôn đúc, bó chỉnh hình trong y học. Ngoài ra, thạch cao nung còn được dùng làm chất phụ gia trong chế biến thực phẩm với hàm lượng cho phép nhất định. Chất này giúp đông tụ protein trong đậu phụ, phô mai; hạn chế hiện tượng nhão của bột làm bánh; giữ nước bên trong các loại mứt…
+ Barium sulfate (BaSO4) ở dạng tinh thể màu trắng, được sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, nhựa, lớp phủ, men, thuỷ tinh, khai thác khoáng sản, sản xuất các loại giấy trắng chất lượng cao. Trong y tế, barium sulfate là thành phần chính của thuốc cản quang trong kĩ thuật X – quang.
Câu hỏi 4 trang 54 Hóa học 11: Trình bày phương pháp hoá học để phân biệt các cặp dung dịch sau:
Lời giải:
a) Phân biệt cặp dung dịch BaCl2 và NaCl bằng dung dịch chứa ion sulfate như H2SO4; Na2SO4 …. Hiện tượng:
+ Xuất hiện kết tủa trắng → BaCl2. Phương trình ion thu gọn:
+ Không có hiện tượng xuất hiện → NaCl.
b) Phân biệt cặp dung dịch H2SO4 loãng và HCl bằng dung dịch chứa ion Ba2+ như BaCl2; Ba(NO3)2 …. Hiện tượng:
+ Xuất hiện kết tủa trắng → H2SO4. Phương trình ion thu gọn:
+ Không có hiện tượng xuất hiện → HCl.
Lời giải:
- Cách bảo quản sulfuric acid:
+ Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
+ Đặt chai, lọ đựng dung dịch sulfuric acid đặc tránh xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
- Cách sử dụng sulfuric acid để đảm bảo an toàn:
Sulfuric acid gây bỏng khi rơi vào da, do vậy cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.
- Cách sơ cứu khi bị bỏng acid:
Khi bị bỏng sulfuric acid cần thực hiện sơ cứu theo các bước sau:
(1) Nhanh chóng rửa ngay với nước lạnh nhiều lần để làm giảm lượng acid bám trên da. Nếu bị bỏng ở vùng mặt nhưng acid chưa bắn vào mắt thì nhắm chặt mắt khi ngâm rửa. Nếu acid đã bắn vào mắt thì úp mặt vào chậu nước sạch, mở mắt và chớp nhiều lần để rửa acid.
(2) Sau khi ngâm rửa bằng nước, cần tiến hành trung hoà acid bằng dung dịch NaHCO3 loãng (khoảng 2%).
(3) Băng bó tạm thời vết bỏng bằng băng sạch, cho người bị bỏng uống bù nước điện giải rồi đưa đến cơ sở y tế gần nhất.
Lý thuyết Sulfuric acid và muối sulfate
1. Hợp chất hữu cơ và hóa học hữu cơ
a. Tìm hiểu khái niệm hợp chất hữu cơ và hóa học hữu cơ
- Hợp chất của carbon là hợp chất hữu cơ
- Trừ một số hợp chất khác như: oxide của carbon (CO, CO2), muối carbonate (CO32-), các carbide (CN-)3,…
- Hóa học hữu cơ là ngành hóa học nghiên cứu các hợp chất hữu cơ: nghiên cứu cấu trúc, tính chất, phương pháp và ứng dụng của các hợp chất.
b. Tìm hiểu đặc điểm chung của các hợp chất hữu cơ
- Đặc điểm liên kết:
+ Liên kết hoá học trong các hợp chất hữu cơ thường là liên kết cộng hoá trị.
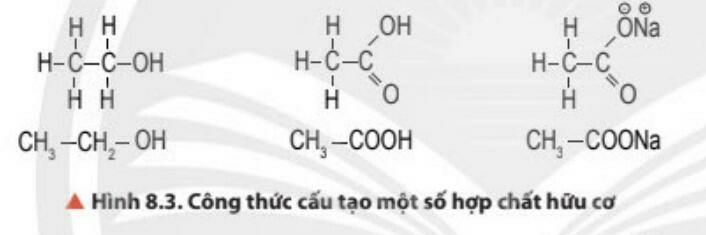
- Tính chất vật lí:
+ Các hợp chất hữu cơ thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp
+ Không tan hoặc ít tan trong nước, tan nhiều trong dung môi hữu cơ.
- Tính chất hoá học:
+ Đa số các hợp chất hữu cơ dễ cháy
+ Kém bền với nhiệt nên dễ bị phân huỷ bởi nhiệt.
+ Phản ứng của các chất hữu cơ thường xảy ra chậm, không hoàn toàn và không theo một hướng nhất định nên tạo thành hỗn hợp các sản phẩm.
c. Phân loại các hợp chất hữu cơ
- Hợp chất hữu cơ gồm: hydrocarbon và dẫn xuất của hydrocarbon.
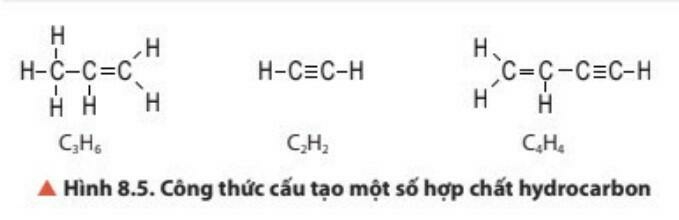
- Hydrocarbon là những hợp chất hữu cơ chỉ được tạo thành từ hai nguyên tố carbon và hydrogen.
- Dẫn xuất của hydrocarbon là những hợp chất hữu cơ mà trong phân tử ngoài nguyên tố carbon còn có các nguyên tố như oxygen, nitrogen, sulfur, halogen,...
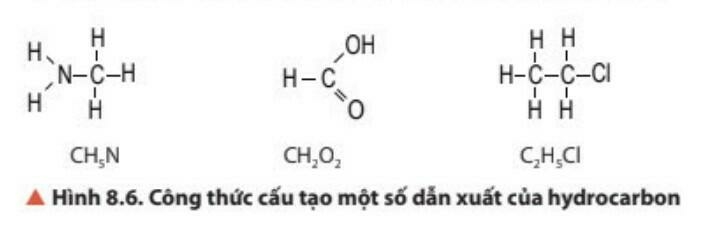
2. Nhóm chức và phổ hồng ngoại (IR)
a. Tìm hiểu khái niệm nhóm chức và một số loại nhóm chức cơ bản
- Nhóm chức là nguyên tử hoặc nhóm nguyên tử gây ra những tính chất đặc trưng của nhóm chất hữu cơ
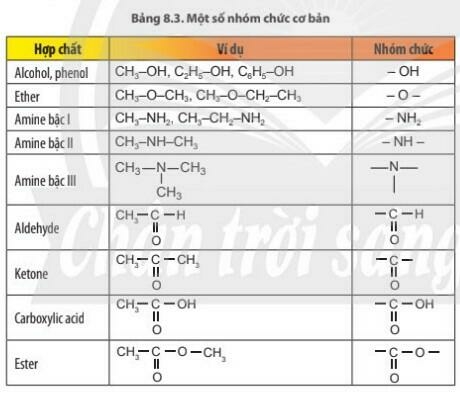
b. Dự đoán một số nhóm chức cơ bản dựa vào tín hiệu phổ hồng ngoại (IR)
- Có thể xác định sự có mặt của một số nhóm chức cơ bản trong phân tử hợp chất hữu cơ dựa vào phổ hồng ngoại.
- Phổ hồng ngoại biểu diễn sự phụ thuộc vào:
+ Cường độ hấp thụ bức xạ hồng ngoại của một chất vào số sóng
+ Bước sóng.
- Trên phổ hồng ngoại, trục nằm ngang biểu diễn số sóng (cm) của các bức xạ trong vùng hồng ngoại, trục thẳng đứng biểu diễn cường độ truyền qua hoặc độ hấp thụ (theo %).
Sơ đồ tư duy Sulfuric acid và muối sulfate
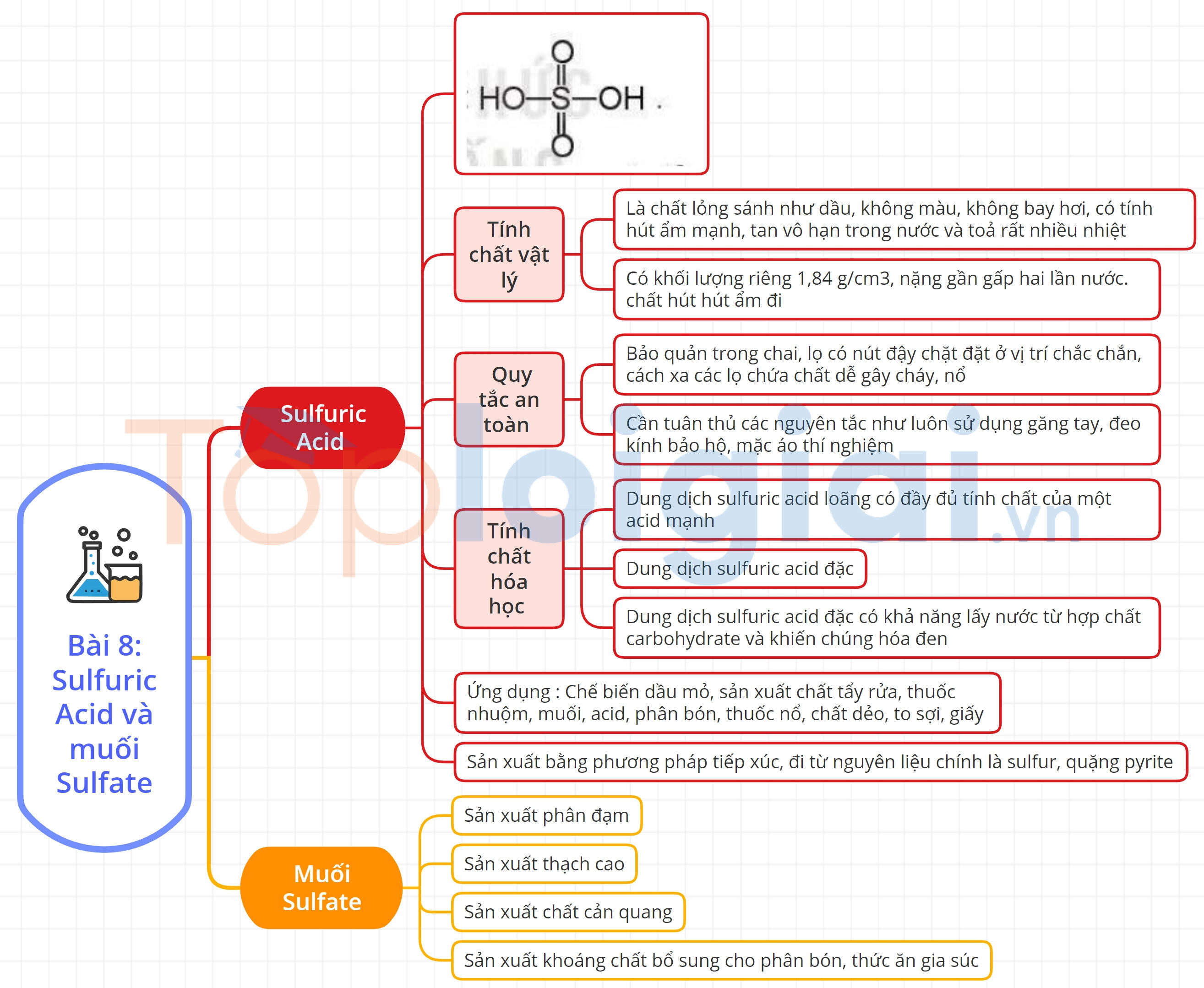
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 10: Hợp chất hữu cơ và hoá học hữu cơ
Bài 11: Phương pháp tách biệt và tinh chế hợp chất hữu cơ
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức