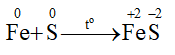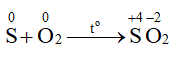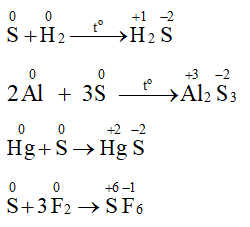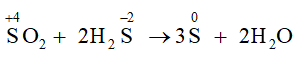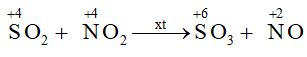Giải Hóa 11 Bài 7 (Kết nối tri thức): Sulfur và sulfur dioxide
Với giải bài tập Hóa 11 Bài 7: Sulfur và sulfur dioxide sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa học 11 Bài 7.
Giải Hóa 11 Bài 7: Sulfur và sulfur dioxide
Lời giải:
- Tính chất cơ bản của sulfur:
+ Tính chất vật lí: sulfur là chất rắn, không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide. Sulfur nóng chảy ở 113 oC và sôi ở 445 oC.
+ Tính chất hoá học: khi tham gia phản ứng hoá học, sulfur có thể thể hiện tính oxi hoá hoặc tính khử. Trong thực tế, hầu hết các phản ứng của sulfur chỉ xảy ra khi đun nóng.
- Tính chất cơ bản của sulfur dioxide:
+ Tính chất vật lí: Ở điều kiện thường, sulfur dioxide là chất khí không màu, nặng hơn không khí, mùi hắc, tan nhiều trong nước.
+ Tính chất hoá học: khi tham gia phản ứng hoá học, sulfur dioxide thể hiện tính chất của acidic oxide. Ngoài ra, sulfur dioxide còn thể thể hiện tính oxi hoá hoặc tính khử.
- Một số biện pháp giảm thiểu tác hại của sulfur dioxide với môi trường: xử lí khí thải của nhà máy trước khi thải khí ra môi trường; chuyển hoá sulfur dioxide thành các chất ít gây ô nhiễm môi trường hơn…
I. Sulfur
Lời giải:
- Ứng dụng của quặng pyrite: nguyên liệu để sản xuất sulfuric acid.
- Ứng dụng của thạch cao: thạch cao được dùng để nặn tượng, đúc khuôn và bó bột khi gãy xương.
- Ứng dụng của sulfuric acid: sản xuất thuốc nhuộm, chất tẩy rửa, phân bón, chất dẻo, tơ sợi, giấy, thuốc nổ …
Lời giải:
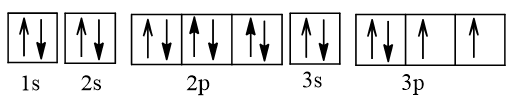
Cấu hình electron nguyên tử sulfur là 1s22s22p63s23p4.
Viết gọn: [Ne]3s23p4.
Biểu diễn sự phân bố electron vào các ô orbital:
a) Số oxi hoá thấp nhất, cao nhất của nguyên tử S trong hợp chất.
b) Tính oxi hoá, tính khử của sulfur.
Lời giải:
a) Ở trạng thái cơ bản S có 2 electron độc thân; ở trạng thái kích thích S có 4 hoặc 6 electron độc thân. Bởi vậy, trong hợp chất của S với các nguyên tố có độ âm điện nhỏ hơn S có số oxi hoá -2; trong các hợp chất cộng hoá trị của S với các nguyên tố có độ âm điện lớn hơn, nguyên tố S có số oxi hoá +4 hoặc +6.
⇒ Trong hợp chất, số oxi hoá thấp nhất của S là -2; số oxi hoá cao nhất của S là +6.
b) Khi tham gia phản ứng hoá học S thể hiện tính oxi hoá hoặc tính khử do đơn chất S (số oxi hoá = 0) có số oxi hoá trung gian giữa -2 và +6.
Lời giải:
Trong tinh thể sulfur, các phân tử S8 tương tác với nhau bằng lực van der Waals yếu do đó đơn chất sulfur có nhiệt độ nóng chảy thấp.
Thí nghiệm trang 44 Hóa học 11: Sulfur tác dụng với sắt (iron)
Chuẩn bị: bột sulfur, bột iron, ống nghiệm, kẹp gỗ, đèn cồn, bông.
- Trộn đều bột sulfur với bột iron theo tỉ lệ khối lượng khoảng 1: 1,5.
- Lấy khoảng 2 g hỗn hợp vào ống nghiệm khô chịu nhiệt, dùng bông nút miệng ống nghiệm.
- Hơ nóng đều nửa dưới ống nghiệm trên ngọn lửa đèn cồn, sau đó đun tập trung vào phần chứa hỗn hợp.
Quan sát, mô tả hiện tượng và thực hiện yêu cầu sau:
Lời giải:
Hiện tượng: Khi đốt nóng hỗn hợp, lưu huỳnh nóng chảy, tiếp theo hỗn hợp cháy sáng và chuyển thành hợp chất màu đen, phản ứng tỏa nhiều nhiệt.
Dự đoán sản phẩm tạo thành là muối iron(II) sulfide.
Phương trình hoá học:
Vậy trong phản ứng này, Fe đóng vai trò là chất khử còn S đóng vai trò là chất oxi hoá.
Thí nghiệm trang 45 Hóa học 11: Sulfur tác dụng với oxygen
Chuẩn bị: bột sulfur, bình khí oxygen; muôi sắt, đèn cồn, nút cao su.
- Lấy một ít bột sulfur vào muối sắt (đã cắm xuyên qua nút cao su).
- Hơ nóng muôi sắt trên ngọn lửa đèn cồn đến khi sulfur nóng chảy và cháy một phần trong không khí.
- Đưa nhanh muôi sắt vào bình khí oxygen.
Quan sát và thực hiện các yêu cầu:
1. Viết phương trình hoá học và xác định chất oxi hoá, chất khử.
2. Nhận xét mức độ phản ứng cháy của sulfur trong không khí và trong khí oxygen.
Lời giải:
1. Phương trình hoá học:
Chất khử: S; chất oxi hoá: O2.
2. Sulfur cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong không khí mãnh liệt hơn.
Lời giải:
Ta có:
Nhận xét:
Trong phản ứng của sulfur với hydrogen, nhôm (aluminium), thuỷ ngân (mercury) số oxi hoá của sulfur giảm xuống sau phản ứng, sulfur thể hiện tính oxi hoá.
Trong phản ứng của sulfur với fluorine, số oxi hoá của sulfur tăng lên sau phản ứng, sulfur thể hiện tính khử.
Lời giải:
Ứng dụng của sulfur dioxide (SO2):
Sulfur dioxide là chất trung gian, quan trọng trong quá trình sản xuất sulfuric acid. Oxide này còn được dùng để tẩy trắng vải sợi, đường; sản xuất thuốc trừ sâu và thuốc sát trùng. Trong công nghệ thực phẩm trước kia, sulfur dioxide cũng được sử dụng ở nồng độ nhất định để hạn chế sự phát triển của vi sinh vật. Khí sulfur dioxide cũng được tạo ra từ quá trình đốt cháy sulfur với mục đích diệt khuẩn và nấm mốc, được dùng để bảo quản hoa quả sấy khô, dược liệu từ thực vật (dân gian gọi là quá trình “xông sinh”). Tuy nhiên, ngày nay biện pháp bảo quản này đã bị cấm sử dụng do không đảm bảo an toàn thực phẩm.
II. Sulfur dioxide
Lời giải:
Phương trình minh hoạ:
SO2 + H2O ⇌ H2SO3
SO2 + BaO → BaSO3
SO2 + Ca(OH)2 → CaSO3 + H2O.
Lời giải:
Trong hợp chất sulfur dioxide (SO2), nguyên tố sulfur có số oxi hoá +4, là số oxi hoá trung gian giữa các số oxi hoá -2 và +6. Do vậy, khi tham gia phản ứng oxi hoá – khử, SO2 có thể bị khử hoặc oxi hoá.
Lời giải:
- Phản ứng của sulfur dioxide với hydrogen sulfide:
Trong phản ứng của sulfur dioxide với hydrogen sulfide, SO2 đóng vai trò là chất oxi hoá.
- Phản ứng của sulfur dioxide với nitrogen dioxide:
Trong phản ứng của sulfur dioxide với nitrogen dioxide, SO2 đóng vai trò là chất khử.
Câu hỏi 5 trang 47 Hóa học 11: a) Trình bày ứng dụng của sulfur dioxide. Giải thích.
Lời giải:
a) Sulfur dioxide là chất trung gian trong quá trình sản xuất sulfuric acid.
Do có khả năng tẩy trắng và diệt khuẩn, sulfur dioxide được sử dụng để tẩy trắng bột giấy, khử màu trong sản xuất đường, chống nấm mốc cho sản phẩm mây, tre đan,…
Trong nghiên cứu, sulfur dioxide lỏng là một dung môi phân cực, được sử dụng để thực hiện nhiều phản ứng.
b) Một số nguồn phát thải khí sulfur dioxide vào khí quyển:
- Nguồn tự nhiên: Khí thải núi lửa, trên toàn thế giới, nguồn sulfur dioxide tự nhiên chiếm ưu thế, nhưng ở các khu vực đô thị và công nghiệp, nguồn nhân tạo chiếm ưu thế.
- Nguồn nhân tạo: Chủ yếu sinh ra từ quá trình đốt cháy nhiên liệu có chứa tạp chất sulfur (than đá, dầu mỏ), đốt quặng sulfide (galen, blend) trong luyện kim, đốt sulfur và quặng pyrite trong sản xuất sulfuric acid, …
Dựa trên các nguồn phát sinh sulfur dioxide do hoạt động của con người, các biện pháp để cắt giảm sự phát thải khí này được đề xuất như sau:
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Em có thể trang 47 Hóa học 11: - Giải thích được quá trình hình thành mưa acid từ sulfur dioxide.
- Đề xuất được một số biện pháp để cắt giảm sự phát thải sulfur dioxide vào khí quyển.
Lời giải:
- Quá trình hình thành mưa acid từ sulfur dioxide: Khí SO2 phản ứng với hơi nước và các tác nhân có trong không khí tạo thành H2SO3; H2SO4. Khi trời mưa, các hạt acid này tan vào nước mưa, làm độ pH của nước mưa giảm. Các phương trình hoá học minh hoạ:
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4.
- Một số biện pháp để cắt giảm sự phát thải sulfur dioxide vào khí quyển:
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo;
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên;
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
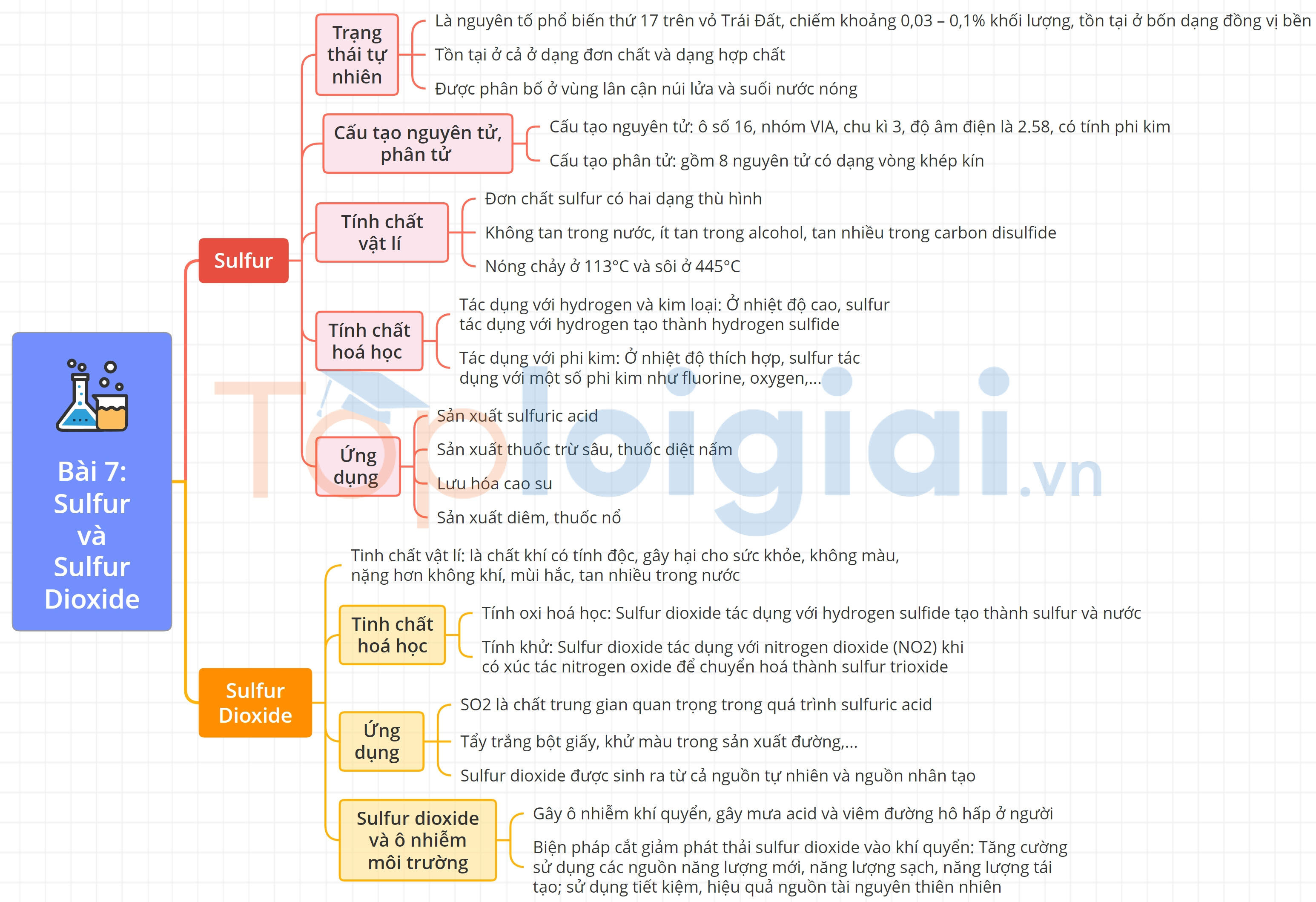
Lý thuyết Sulfur và sulfur dioxide
I. Sulfur
1. Trạng thái tự nhiên
- Là nguyên tố phổ biến thứ 17 trên vỏ TĐ.
- Trong tự nhiên, sulfur tồn tại ở cả dạng đơn chất và hợp chất.
2. Cấu tạo nguyên tử, phân tử
a, Cấu tạo nguyên tử
- Vị trí trong BTH:
+ Ô: 16.
+ Chu kì: 3.
+ Nhóm: VIA.
- Sulfur có tính phi kim.
- Số oxi hóa: -2, 0, +4, +6.
b, Cấu tạo phân tử
Phân tử sulfur gồm 8 nguyên tử (S8) có dạng vòng khép kín.
Mỗi nguyên tử sulfur liên kết với hai nguyên tử bên cạnh bằng hai liên kết CHT không phân cực.
3. Tính chất vật lí
- Có hai dạng thù hình: dạng tà phương và dạng đơn tà.
- Sulfur không tan trong nước, ít tan trong alcohol, tan nhiều trong carbon disulfide.
4. Tính chất hóa học
a, Tác dụng với hydrogen và kim loại
- Tác dụng với hydrogen
S(s) +H2(g) H2S(g)
- Tác dụng với kim loại tạo ra muối sulfide
Hg + S → HgS
2Al + 3S → Al2S3
b, Tác dụng với phi kim
S + 3F2 → SF6
S + O2 → SO2
5. Ứng dụng
- Lưu hóa cao su.
- Sản xuất sulfuric acid.
- Sản xuất thuốc trừ sâu, thuốc diệt nấm.
II. Sulfur dioxide
1. Tính chất vật lí
- SO2 là chất khí không màu, năng hơn không khí, mùi hắc, tan nhiều trong nước.
- SO2 là khí độc.
2. Tính chất hóa học
a, Tính oxi hóa
- Tác dụng với hydrogen sulfide: SO2 + 2H2S → 3S + 2H2O
b, Tính khử
- Tác dụng với nitrogen dioxide (NO2): SO2 + NO2 →SO3 + NO
3. Ứng dụng
- Là chất trung gian quan trọng trong quá trình sản xuất sulfuric acid.
- Tẩy trắng và diệt khuẩn.
- Là dung môi để thực hiện nhiều phản ứng.
4. Sulfur dioxide và ô nhiễm môi trường
a, Nguồn phát sinh
- Tự nhiên: khí thải núi lửa …
- Nhân tạo: đốt cháy nhiên liệu, quặng sulfide, luyện kim ….
b, Tác hại
- Gây ô nhiễm khí quyển, gây mưa acid và viêm đường hô hấp ở người.
c, Biện pháp cắt giảm phát thải sulfur dioxide vào khí quyển
- Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo.
- Sử dụng tiết kiệm, hiệu quả nguồn tài nguyên thiên nhiên.
- Cải tiến công nghệ sản xuất, có biện pháp xử lí khí thải và tái chế các sản phẩm phụ có chứa sulfur.
Sơ đồ tư duy Sulfur và sulfur dioxide
Xem thêm lời giải bài tập Hóa học lớp 11 Kết nối tri thức với cuộc sống hay, chi tiết khác:
Bài 8: Sulfuric acid và muối sulfate
Bài 10: Hợp chất hữu cơ và hoá học hữu cơ
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức