Chuyên đề Hóa 10 Bài 9 (Cánh diều): Thực hành thí nghiệm hóa học ảo
Với giải bài tập Chuyên đề Hóa 10 Bài 9: Thực hành thí nghiệm hóa học ảo sách Cánh diều hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Chuyên đề học tập Hóa 10 CD Bài 9.
Giải bài tập Chuyên đề Hóa 10 Bài 9: Thực hành thí nghiệm hóa học ảo
Giải bài tập trang 59 Chuyên đề Hóa 10 Bài 9
I. Giới thiệu về phần mềm thí nghiệm hóa học ảo
II. Một số thí nghiệm hóa học ảo
1. Thí nghiệm lá vàng của Rutherford (Tán xạ hạt α của Rutherford)
Trả lời:
- Theo mô hình bánh pudding tất cả các hạt α đều xuyên thẳng qua lá vàng.
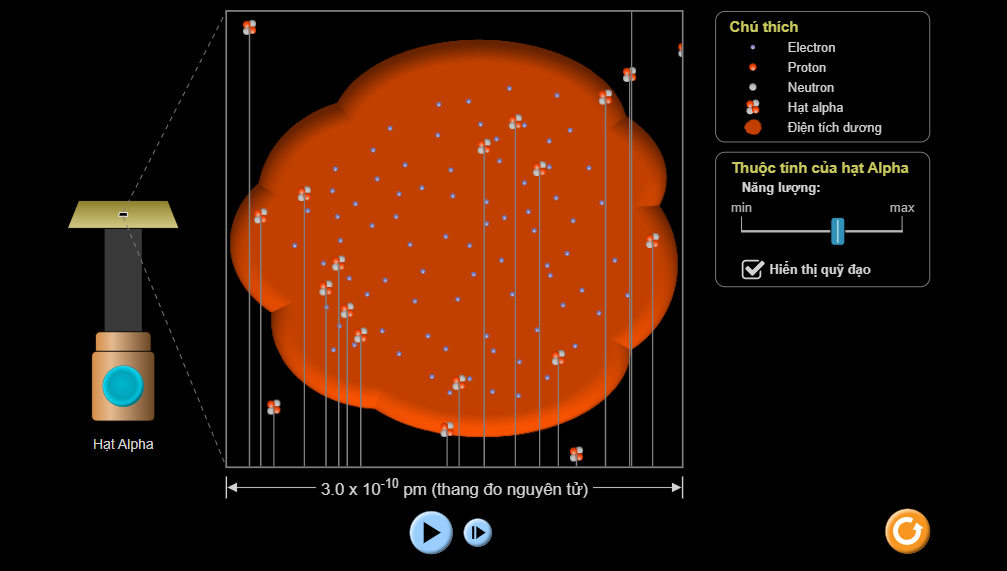
Hình ảnh thí nghiệm mô hình bánh pudding bắn phá hạt α qua lá vàng
- Theo mô hình Rutherford hầu hết các hạt α đều xuyên thẳng qua lá vàng, nhưng có một số ít hạt đi lệch hướng ban đầu và một số ít hạt bị bật lại phía sau khi gặp lá vàng:
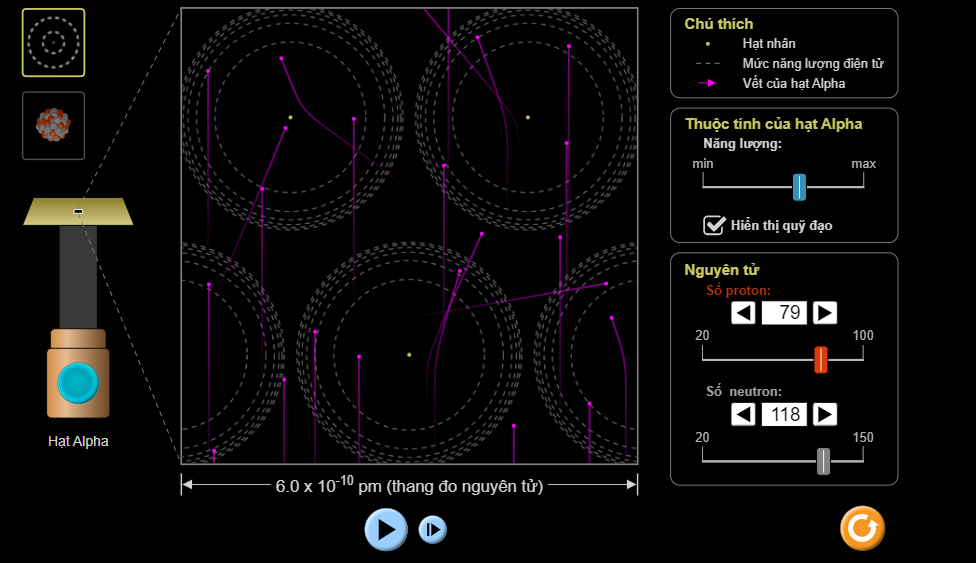
Hình ảnh thí nghiệm mô hình Rutherford bắn phá hạt α qua lá vàng ở cấp độ nguyên tử
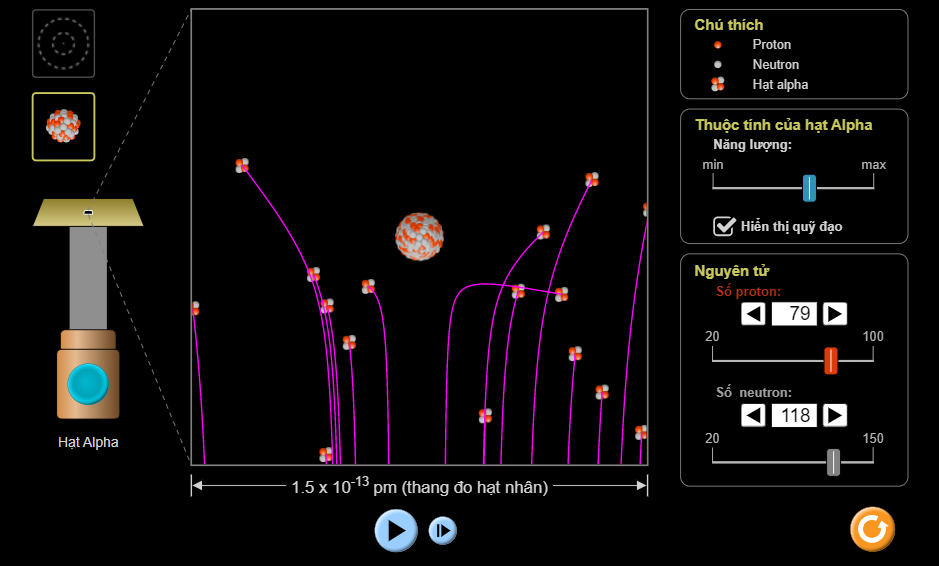
Hình ảnh thí nghiệm mô hình Rutherford bắn phá hạt α qua lá vàng ở cấp độ hạt nhân
Từ kết quả thí nghiệm ảo, ta thấy mô hình nguyên tử theo Rutherford có kết quả phù hợp với thực nghiệm hơn mô hình bánh pudding.
Trả lời:
- Khi tăng năng lượng hạt alpha ta thấy dòng hạt alpha chuyển động nhanh hơn, khả năng đâm xuyên lớn hơn.
- Năng lượng tăng lên thêm đó gồm cả động năng.
- Hạt alpha có năng lượng cao hơn không làm thay đổi bản chất thí nghiệm.
Trả lời:
Đối với vàng, nếu tăng số lượng hạt neutron ở hạt nhân thì hiện tượng qua sát được không thay đổi.
Điều này được giải thích: Do hạt neutron không mang điện tích, không ảnh hưởng đến quá trình di chuyển của nguyên tử trong điện trường.
Trả lời:
Khi quan sát ở cấp độ hạt nhân, trong khung hình quan sát thấy hầu như tất cả các hạt alpha đều bị lệch quỹ đạo ban đầu do hạt nhân mang điện tích dương nên làm hầu hết các hạt alpha bị lệch khỏi quỹ đạo ban đầu.
Còn ở cấp độ nguyên tử, trong khung hình chỉ thấy số ít hạt alpha thay đổi quỹ đạo ban đầu do nguyên tử có cấu tạo rỗng, ở tâm chứa hạt nhận và kích thước của hạt nhân rất nhỏ so với kích thước nguyên tử.
Trả lời:
Electron (hạt mang điện tích âm, -1) hầu như không làm thay đổi quỹ đạo chuyển động của hạt alpha (hạt mang điện tích dương, +2) vì khối lượng của electron rất nhỏ, không đáng kể so với khối lượng của hạt alpha.
2. Thí nghiệm về năng lượng hóa học qua phản ứng của magnesium tác dụng với dung dịch hydrochloric acid
Giải bài tập trang 61 Chuyên đề Hóa 10 Bài 9
Câu hỏi 6 trang 61 Chuyên đề Hóa 10: Vì sao phải sử dụng cốc chia độ?
Trả lời:
Sử dụng cốc chia độ để lấy được chính xác lượng dung dịch hydrochloric acid 2M (là 50 mL).
Câu hỏi 7 trang 61 Chuyên đề Hóa 10: Vì sao HCl được cho vào rất dư so với lượng cần phản ứng?
Trả lời:
HCl được cho vào rất dư so với lượng cần phản ứng để Mg phản ứng hoàn toàn.
Câu hỏi 8 trang 61 Chuyên đề Hóa 10: Vì sao nhiệt độ lại tăng lên khi phản ứng xảy ra?
Trả lời:
Nhiệt độ tăng lên khi phản ứng xảy ra do phản ứng tỏa nhiệt (có biến thiên enthalpy của phản ứng là -466,0 kJ < 0).
Câu hỏi 9 trang 61 Chuyên đề Hóa 10: Vì sao nhiệt độ hỗn hợp chỉ tăng lên tới 46oC?
Trả lời:
1 mol Mg phản ứng tỏa ra 466,0 kJ nhiệt lượng
0,24 gam = 0,01 mol Mg tỏa ra 466.0,01 = 4,66kJ nhiệt lượng.
Lượng nhiệt này tương đương với 46oC.
Câu hỏi 10 trang 61 Chuyên đề Hóa 10: Vì sao sau đó nhiệt độ dung dịch lại giảm dần?
Trả lời:
Phản ứng kết thúc, đồng thời dừng tỏa nhiệt. Sau khi phản ứng kết thúc, nhiệt độ trong cốc giảm dần để cân bằng với nhiệt độ môi trường.
- Khối lượng nước là m = V × D = 50 × 1,0 = 50 g
- Lượng nhiệt tỏa ra tính được theo công thức:
Q = C × m × (T2 – T1) = 4,184 × 50 × (46 – 25) = 4393,2 J
Trả lời:
Lượng nhiệt tỏa ra thực tế trong thí nghiệm này là 4,66 kJ.
Có sự sai khác giữa kết quả tính của bạn học sinh và kết quả thực tế là do ảnh hưởng của nhiệt độ môi trường.
Câu hỏi 12 trang 61 Chuyên đề Hóa 10: Cho biết (kJ mol-1) các chất ở trạng thái tương ứng như sau:
Hãy viết phương trình hóa học của phản ứng diễn ra trong thí nghiệm trên và tính của phản ứng.
Trả lời:
Phương trình hóa học của phản ứng:
Mg(s) + 2HCl((aq) → MgCl2(aq) + H2(g)
= (MgCl2(aq)) + (H2(g)) - (Mg(s)) – 2. (HCl((aq))
= (-800) + 0 – 0 – 2.(-167,16) = -465,68 kJ.
Giải bài tập trang 62 Chuyên đề Hóa 10 Bài 9
Thực hành để làm rõ được những vấn đề nêu ra trong mục “THÔNG TIN” như sau:
- Quan sát được sự thay đổi cực tính của phân cực khi thay đổi độ âm điện các nguyên tử.
- Hiển thị cực tính bằng mũi tên hay điện tích riêng phần.
- Sắp xếp các liên kết theo thứ tự độ phân cực.
- Tiên đoán cực tính của phân tử bằng cách thay đổi độ phân cực của liên kết và hình dạng phân tử.
Trả lời:
- Phân tử phân cực khi có sự chênh lệch độ âm điện giữa các nguyên tử liên kết. Chênh lệch độ âm điện càng lớn thì phân tử phân cực càng mạnh.
- Phân tử bị lệch trong điện trường, cụ thể phần mang điện tích âm bị lệch về phía cực dương, phần mang điện tích dương bị lệch về phía cực âm.
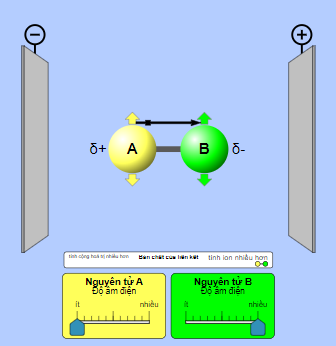
- Dự đoán: Hình dạng phân tử có làm ảnh hưởng đến sự phân cực.
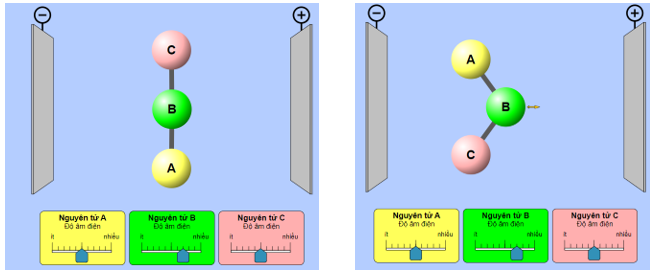
Trả lời:
Thực hiện các chỉ dẫn của phần mềm và trả lời câu hỏi phần mềm đưa ra như sau:
1. In this kit you will learn how some of the properties of the halogens (the elements in Group 7 of the Periodic Table) vary.
(Trong thí nghiệm này, em sẽ được học về một số thuộc tính khác nhau của halogens (các nguyên tố nhóm VII trong bảng tuần hoàn).
2. Chlorine gas is in the leftt – hand flask and iodine solid is in the right – hand flask
(Khí chlorine ở bình phía bên tay trái và chất rắn iodine ở bình phía tay phải).
3. Chlorine is a green – yellow gas at room temperature, while iodine is a black solid. What does this tell you about their boiling points?
A. The boiling point of chlorine is lowest.
B. The boiling point of chlorine is highest.
C. The boiling point are the same.
(Chlorine là chất khí có màu vàng xanh ở nhiệt độ phòng, trong khi iodine là một chất rắn màu đen. Điều này cho em biết điều gì về nhiệt độ sôi của chúng?
A. Nhiệt độ sôi của chlorine thấp nhất
B. Nhiệt độ sôi của chlorine cao nhất.
C. Nhiệt độ sôi như nhau.
Trả lời:
Đáp án A
Nhiệt độ sôi của chlorine thấp hơn nhiệt độ sôi của iodine.
4. Heat the iodine gently, by dragging the slider on the heater slowly upwards, until it turns into a gas. At what temperature does this happen?
(Làm nóng iodine nhẹ nhàng, bằng cách kéo chậm thanh trượt trên lò sưởi hướng lên trên cho đến khi nó chuyển thành khí. Điều này xảy ra ở nhiệt độ nào?
Trả lời:
Kéo thanh trượt (hoặc có thể thay đổi nhiệt độ bằng cách nhấn chuột vào nhiệt độ khi trên bếp và nhập số) iodine chuyển thành khí ở 187oC.
5. Turn the heat on both heaters to 200oC
(Vặn nhiệt trên cả hai bếp thành 200oC)
6. Drag on the metals and add them to both flasks. Observe which metals react. Which is the more reactive gas?
A. Chlorine
B. Iodine
(Kéo kim loại và thêm chúng vào cả hai bình. Quan sát kim loại nào phản ứng. Chất khí nào phản ứng mạnh hơn?)
Trả lời:
Đáp án A
Chlorine phản ứng mạnh hơn với các kim loại.
Trả lời:
Ví dụ: Sử dụng thể Open – local để mô phỏng thí nghiệm về ảnh hưởng của nồng độ acid HCl đến tốc độ phản ứng:
2HCl(aq) + CaCO3(s) → CaCl2(aq) + CO2(g) + H2O(l) (1)
Cách tiến hành:
Bước 1: Nháy chuột vào thẻ Open – local, chọn Reaction Rates.
Bước 2: Nháy chuột vào Concentration and rate (ảnh hưởng của nồng độ lên tốc độ phản ứng). Một mô phỏng đã được thiết kế xuất hiện ở màn hình.
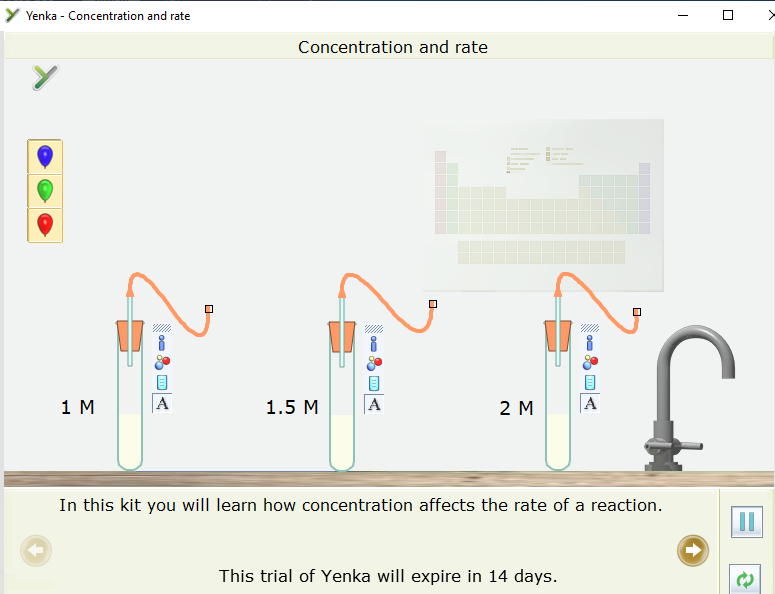
Bước 3: Nháy chuột vào các quả bóng có màu khác nhau, kéo thả vào cuối ống dẫn khí ở các ống nghiệm có nồng độ khác nhau.
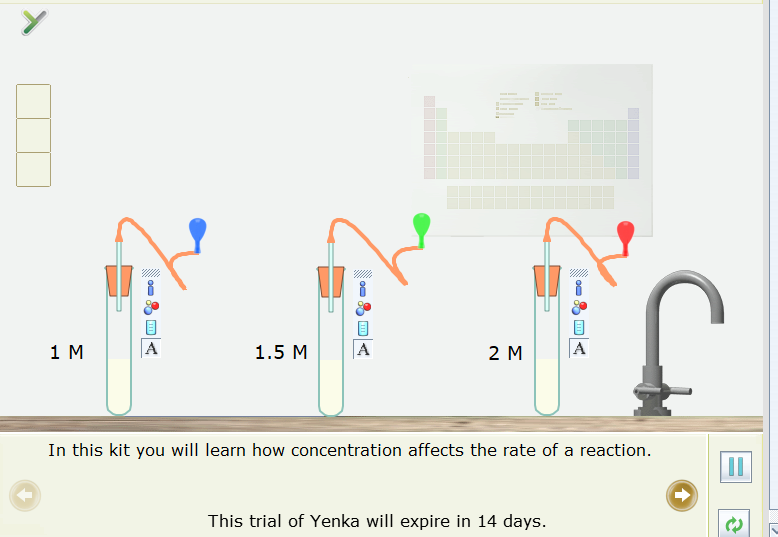
Bước 4. Nháy chuột vào nút Pause để thực hiện mô phỏng. Sau khoảng 9 giây nháy chuột lại vào nút Pause để dừng mô phỏng.

Xem thêm lời giải bài tập Chuyên đề Hóa lớp 10 Cánh diều hay, chi tiết khác:
Bài 5: Sơ lược về phản ứng cháy và nổ
Bài 6: Hóa học về phản ứng cháy và nổ
Bài 7: Phòng chống và xử lí cháy nổ
Bài 10: Tính tham số cấu trúc và năng lượng phân của phân tử
Xem thêm các chương trình khác:
- Soạn văn lớp 10 (hay nhất) – Cánh Diều
- Tác giả tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Tóm tắt tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Bố cục tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Nội dung chính tác phẩm Ngữ văn lớp 10 – Cánh Diều
- Soạn văn lớp 10 (ngắn nhất) – Cánh Diều
- Giải sbt Ngữ văn lớp 10 – Cánh Diều
- Văn mẫu lớp 10 – Cánh Diều
- Giải Chuyên đề học tập Ngữ văn 10 – Cánh diều
- Giải sgk Toán 10 – Cánh Diều
- Giải Chuyên đề Toán 10 – Cánh Diều
- Lý thuyết Toán 10 – Cánh Diều
- Giải sbt Toán 10 – Cánh Diều
- Chuyên đề dạy thêm Toán 10 Cánh diều (2024 có đáp án)
- Giải sgk Tiếng Anh 10 – Explore new worlds
- Giải sgk Tiếng Anh 10 – ilearn Smart World
- Trọn bộ Từ vựng Tiếng Anh 10 ilearn Smart World đầy đủ nhất
- Ngữ pháp Tiếng Anh 10 i-learn Smart World
- Giải sbt Tiếng Anh 10 - iLearn Smart World
- Giải sgk Vật lí 10 – Cánh Diều
- Giải sbt Vật lí 10 – Cánh Diều
- Lý thuyết Vật lí 10 – Cánh Diều
- Giải Chuyên đề Vật lí 10 – Cánh Diều
- Giải sgk Sinh học 10 – Cánh Diều
- Giải sbt Sinh học 10 – Cánh Diều
- Lý thuyết Sinh học 10 – Cánh Diều
- Giải Chuyên đề Sinh học 10 – Cánh diều
- Giải sgk Lịch sử 10 – Cánh Diều
- Giải sbt Lịch sử 10 – Cánh Diều
- Giải Chuyên đề Lịch sử 10 – Cánh Diều
- Lý thuyết Lịch sử 10 – Cánh diều
- Giải sgk Địa lí 10 – Cánh Diều
- Lý thuyết Địa Lí 10 – Cánh Diều
- Giải sbt Địa lí 10 – Cánh Diều
- Giải Chuyên đề Địa lí 10 – Cánh Diều
- Lý thuyết Công nghệ 10 – Cánh Diều
- Giải sgk Công nghệ 10 – Cánh Diều
- Giải sgk Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải sbt Giáo dục Kinh tế và Pháp luật 10 – Cánh Diều
- Giải Chuyên đề Kinh tế pháp luật 10 – Cánh diều
- Lý thuyết KTPL 10 – Cánh diều
- Lý thuyết Giáo dục quốc phòng 10 – Cánh Diều
- Giải sgk Giáo dục quốc phòng - an ninh 10 – Cánh diều
- Giải sbt Giáo dục quốc phòng - an ninh 10 – Cánh Diều
- Giải sgk Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sbt Hoạt động trải nghiệm 10 – Cánh Diều
- Giải sgk Tin học 10 – Cánh Diều
- Giải sbt Tin học 10 – Cánh Diều
- Giải Chuyên đề Tin học 10 – Cánh diều
- Lý thuyết Tin học 10 - Cánh diều
- Giải sgk Giáo dục thể chất 10 – Cánh Diều