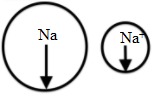
So sánh bán kính của Na và Na+
Bán kính nguyên tử natri và bán kính ion Na+ bán kính nào lớn hơn? Bài viết sau sẽ giúp các em giải quyết vấn đề này.
So sánh bán kính của Na và Na+
1. So sánh
Bán kính nguyên tử natri lớn hơn bán kính ion Na+.
2. Giải thích
Ta có, cấu hình electron của ion Na+ là 1s2 2s2 2p6.
⇒ Nguyên tử Na đã nhường 1 electron lớp ngoài cùng để hình thành ion Na+.
⇒ Bán kính của ion Na+ nhỏ hơn bán kính của nguyên tử Na.
Giải thích: Cả nguyên tử Na và ion Na+ đều có điện tích hạt nhân là 11+. Mà nguyên tử Na có 11 electron còn ion Na+ có 10 electron nên hạt nhân của ion Na+ sẽ hút các electron mạnh hơn làm cho bán kính ion nhỏ hơn.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính nguyên tử Na lớn hơn bán kính ion Na+.
B. Bán kính ion K+ lớn hơn bán kính nguyên tử K.
C. Ion Na+ có 18 electron.
D. Bán kính của nguyên tử Al và ion Al3+ là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: A
B sai, bán kính ion K+ nhỏ hơn bán kính nguyên tử K.
C sai, ion Na+ có 10 electron.
D sai, bán kính ion Al3+ nhỏ hơn bán kính nguyên tử Al
Xem thêm các bài viết về cách so sánh bán kính nguyên tử và ion hay, chi tiết khác:
So sánh bán kính của Al và Al3+
So sánh bán kính của Ca và Ca2+
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)