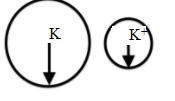
So sánh bán kính của K và K+
Bán kính nguyên tử kali và bán kính ion K+ có đặc điểm như thế nào? Bài viết sau sẽ giúp các em giải quyết vấn đề này.
So sánh bán kính của K và K+
1. So sánh
Bán kính nguyên tử kali lớn hơn bán kính ion K+.
2. Giải thích
Ta có, cấu hình electron của ion K+ là [Ne] 3s2 3p6.
⇒ Nguyên tử K đã nhường 1 electron lớp ngoài cùng để hình thành ion K+.
⇒ Bán kính của ion K+ nhỏ hơn bán kính của nguyên tử K.
Giải thích: Cả nguyên tử K và ion K+ đều có điện tích hạt nhân là 19+. Mà nguyên tử K có 19 electron còn ion K+ có 18 electron nên hạt nhân của ion K+ sẽ hút các electron mạnh hơn làm cho bán kính ion nhỏ hơn.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính nguyên tử K lớn hơn bán kính ion K+.
B. Bán kính ion Ca2+ lớn hơn bán kính nguyên tử Ca.
C. Ion K+ có 19 electron.
D. Bán kính của nguyên tử Al và ion Al3+ là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: A
B sai, bán kính ion Ca2+ nhỏ hơn bán kính nguyên tử Ca.
C sai, ion K+ có 18 electron.
D sai, bán kính ion Al3+ nhỏ hơn bán kính nguyên tử Al
Xem thêm các bài viết về cách so sánh bán kính nguyên tử và ion hay, chi tiết khác:
So sánh bán kính của Al và Al3+
So sánh bán kính của Ca và Ca2+
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)