N2O4(l) + 2N2H4(l) -> 3N2(g) + 4H2O(g) Biết enthalpy tạo thành chuẩn của các chất
Lời giải Bài 5.12* trang 24 SBT Hóa học 11 sách Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng làm bài tập Hóa học 11.
Giải SBT Hóa học 11 Bài 5: Một số hợp chất với oxygen của nitrogen
Bài 5.12* trang 24 SBT Hóa học 11: N2O4(l) + 2N2H4(l) → 3N2(g) + 4H2O(g)
Biết enthalpy tạo thành chuẩn của các chất được trình bày trong bảng sau:
|
Chất |
N2O4(l) |
N2H4(l) |
H2O(g) |
|
(kJ/mol) |
-19,56 |
50,63 |
-241,82 |
a) Tính nhiệt đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4.
b) Tại sao hỗn hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa?
Lời giải:
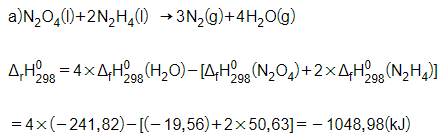
Trong 1 kg hỗn hợp (tỉ lệ 1 mol N2O4 và 2mol N2H4), ta có:
Theo phương trình hóa học, nhiệt tỏa ra khi đốt cháy 1 mol N2O4 và 2 mol N2H4 là 1048,98 kJ.
=> Nhiệt tỏa ra khi đốt cháy 1 kg hỗn hợp lỏng gồm N2O4 và N2H4:
b) Quá trình đốt cháy hỗn hợp lỏng (N2O4 và N2H4) tỏa nhiệt mạnh và giải phóng một lượng lớn khí nên hợp lỏng (N2O4 và N2H4) được dùng làm nhiên liệu tên lửa.
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 5.1 trang 22 SBT Hóa học 11: Hiện tượng mưa acid...
Bài 5.3 trang 22 SBT Hóa học 11: Cho phản ứng: Fe3O4 + HNO3→ Fe(NO3)3 + NO↑ + H2O....
Bài 5.4 trang 22 SBT Hóa học 11: Cho phản ứng: aFe + bHNO3 → cFe(NO3)3 + dNO↑ + eH2O....
Bài 5.12* trang 24 SBT Hóa học 11: N2O4(l) + 2N2H4(l) → 3N2(g) + 4H2O(g)...
Xem thêm lời giải Sách bài tập Hóa học lớp 11 bộ sách Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Ammonia và một số hợp chất ammonium
Bài 6: Sulfur và sulfur dioxide
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Chân trời sáng tạo (hay nhất)
- Văn mẫu lớp 11 - Chân trời sáng tạo
- Tóm tắt tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Tác giả tác phẩm Ngữ văn lớp 11 - Chân trời sáng tạo
- Giải SBT Ngữ văn 11 – Chân trời sáng tạo
- Bố cục tác phẩm Ngữ văn 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Ngữ văn 11 – Chân trời sáng tạo
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Chân trời sáng tạo
- Soạn văn 11 Chân trời sáng tạo (ngắn nhất)
- Giải sgk Toán 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Toán 11 – Chân trời sáng tạo
- Lý thuyết Toán 11 - Chân trời sáng tạo
- Giải sbt Toán 11 – Chân trời sáng tạo
- Giải sgk Tiếng Anh 11 – Friends Global
- Giải sbt Tiếng Anh 11 - Friends Global
- Trọn bộ Từ vựng Tiếng Anh 11 Friends Global đầy đủ nhất
- Bài tập Tiếng Anh 11 Friends Global theo Unit có đáp án
- Giải sgk Vật lí 11 – Chân trời sáng tạo
- Lý thuyết Vật lí 11 – Chân trời sáng tạo
- Giải sbt Vật lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Vật lí 11 – Chân trời sáng tạo
- Giải sgk Sinh học 11 – Chân trời sáng tạo
- Lý thuyết Sinh học 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Sinh học 11 – Chân trời sáng tạo
- Giải sbt Sinh học 11 – Chân trời sáng tạo
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Chân trời sáng tạo
- Lý thuyết Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sbt Kinh tế pháp luật 11 – Chân trời sáng tạo
- Giải sgk Lịch sử 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Lịch sử 11 – Chân trời sáng tạo
- Lý thuyết Lịch sử 11 - Chân trời sáng tạo
- Giải sbt Lịch sử 11 – Chân trời sáng tạo
- Giải sgk Địa lí 11 – Chân trời sáng tạo
- Giải Chuyên đề học tập Địa lí 11 – Chân trời sáng tạo
- Lý thuyết Địa lí 11 - Chân trời sáng tạo
- Giải sbt Địa lí 11 – Chân trời sáng tạo
- Giải sgk Hoạt động trải nghiệm 11 – Chân trời sáng tạo
