Lý thuyết Cân bằng trong dung dịch nước – Hóa 11 Kết nối tri thức
Với lý thuyết Hóa lớp 11 Bài 2: Cân bằng trong dung dịch nước chi tiết, ngắn gọn và bài tập tự luyện có lời giải chi tiết sách Kết nối tri thức sẽ giúp học sinh nắm vững kiến thức trọng tâm để học tốt môn Hóa 11.
Lý thuyết Hóa 11 Bài 2: Cân bằng trong dung dịch nước - Kết nối tri thức
Bài giảng Bài 2: Cân bằng trong dung dịch nước - Kết nối tri thức
A. Lý thuyết Cân bằng trong dung dịch nước
1. Sự điện ly
a. Hiện tượng điện ly
Quá trình phân li các chất trong nước tạo thành ion được gọi là sự điện li. Những chất khi tan trong nước phân li ra các ion được gọi là chất điện li.
b. Chất điện ly
* Chất điện ly và chất không điện ly
Thí nghiệm trên cho thấy các chất như . ... n II. 17 II, Na*(aq) + OH(aq), HCl(aq) — Ví dụ: NaOH(aq) H*(aq) + C (aq) bì Chất đến lí mạnh và chất diễn là yếu
- Chất điện li là các chất tan trong nước phân là ra các ion. Ví dụ như hydrochloric acid, sodium hydroxide...
- Chất không điện li là các chất không phân li ra các ion. Ví dụ như Saccarose, ethanol,…
Sự phân li một chất thành các ion mang điện trái dấu trong dung dịch được biểu diễn bằng phương trình điện ly.
* Chất điện ly mạnh và chất điện ly yếu
Dựa vào mức độ phân li thành các ion, chất điện li được chia thành hai loại:
- Chất điện li mạnh là chất khi tan trong nước, hầu hết các phân tử chất tan đều phân Ii ra ion. Các chất điện là mạnh thường gặp như: HCl, HNO3,..(acid mạnh); NaOH, KOH,…(base mạnh); và hầu hết các muối.
- Quá trình phân li của chất điện li mạnh xảy ra gần như hoàn toàn và được biểu diễn bằng mũi tên một chiều.
- Chất điện li yếu là chất khi tan trong nước chỉ có một phần số phân tử chất tan phân li ra ion, phần còn lại vẫn tồn tại ở dạng phân tử trong dung dịch như CH3COOH, HClO,…(acid yếu) hay Cu(OH)2, Fe(OH)2,… (base yếu)
- Quá trình phần li của chất điện là yếu là một phản ứng thuận nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều nhau.
2. Thuyết ACID-BASE của BRONSTED — LOWRY
a. Khái niệm acid và base theo thuyết Bronsted – Lowry
Thuyết Bronsted – Lowry cho rằng acid là chất cho proton (H+) và base là chất nhận proton.
a. Ưu điểm của thuyết Bronsted – Lowry
Thuyết Bronsted – Lowry có nhiều ưu điểm hơn thuyết Arrhenius:
+ Thuyết Arrhenius chỉ đúng trong trường hợp dung môi là nước.
+ Thuyết Bronsted – Lowry có cái nhìn tổng quát hơn về axit và bazo, giúp ta giải thích được 1 số muối lại hoạt động như 1 bazo.
3. Khái niệm pH và ý nghĩa của pH trong cuộc sống
a. Khái niệm pH
pH là đại lượng thay thế cho những số có số mũ âm hoặc có nhiều chữ số thập phân khi dùng nồng độ ion H+ hoặc ion OH- được dùng để đánh giá tính acid hoặc tính base của các dung dịch mà H+ hoặc OH- thấp.
b. Ý nghĩa của pH trong thực tiễn
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ của con người, sự phát triển của động vật, thực vật.
Trong cơ thể của người, máu và các dịch của dạ dày, mật, .. đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khỏe. Nếu chỉ số pH tăng hoặc giảm đột ngột, không nằm trong giới hạn cho phép thì có thể là dấu hiệu ban đầu của bệnh lí, người bệnh cần được khám để tìm ra nguyên nhân.
Một số động vật sống dưới nước cần môi trường có giá trị pH thích hợp, ví dụ: tôm và cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5.
c. Xác định pH
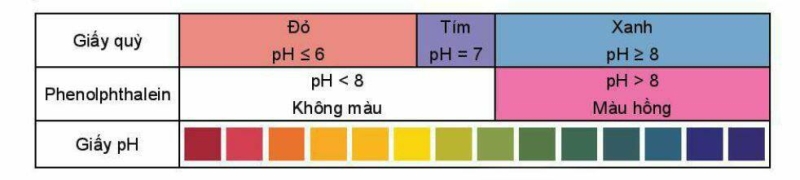
Giá trị pH của dung dịch được xác định gần đúng bằng cách sử dụng chất chỉ thị acid – base. Khi cần xác định giá trị pH chính xác hơn, người ta sử dụng máy đo pH.
Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Một số chất chỉ thị như giấy pH, giấy qùy. phenolphthalein có màu sắc thay đổi trong các khoảng pH khác nhau.
4. Sự thủy phân của các ion
Khi tan trong nước, muối phân li thành các ion. Phản ứng giữa ion với nước tạo ra các dung dịch có môi trường khác nhau được gọi là phản ứng thuỷ phân.
5. Chuẩn độ Acid-base
Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ. Dựa vào thể tích của các dung dịch khi phản ứng vừa đủ với nhau, xác định được nồng độ dung dịch chất cần chuẩn độ.
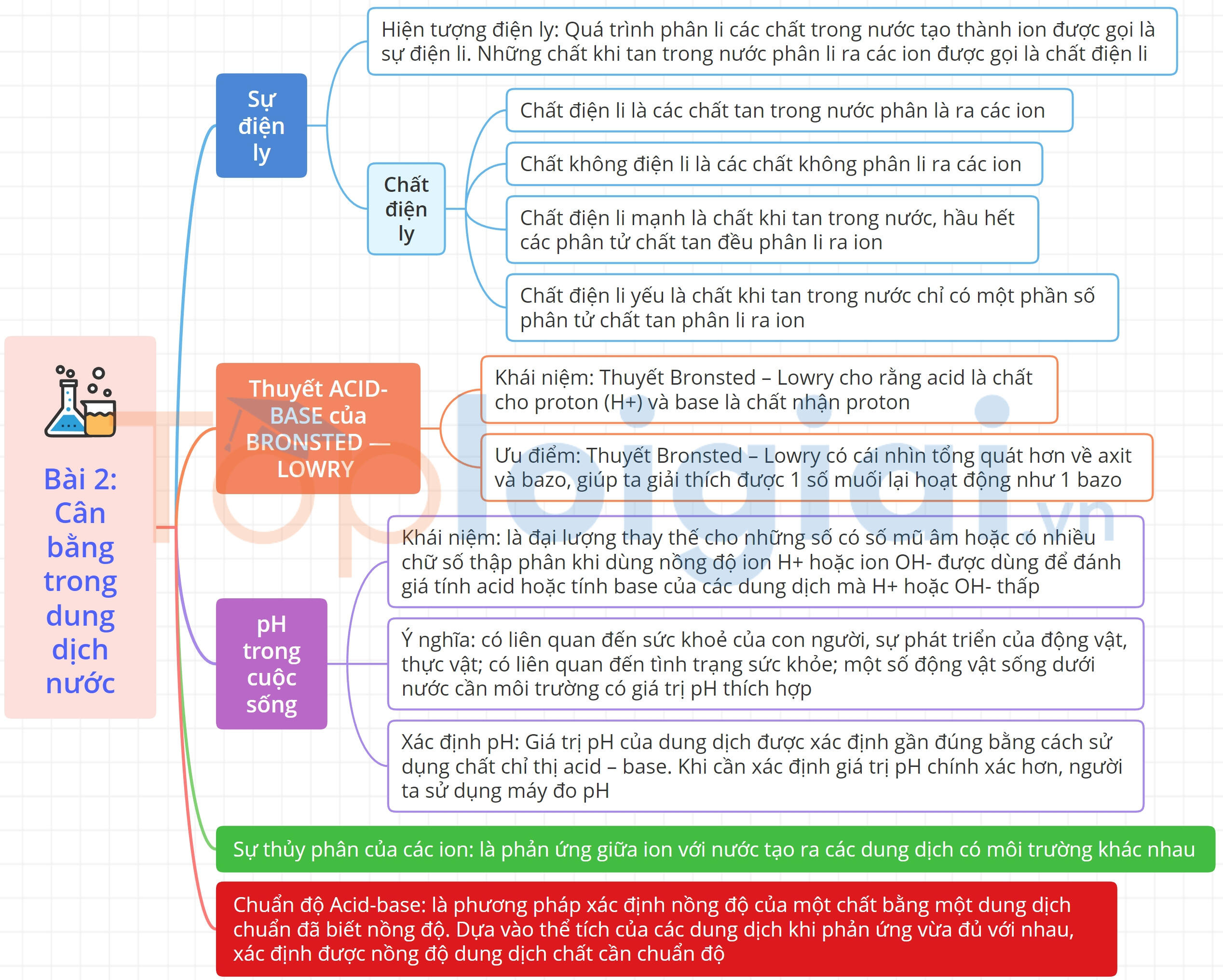
Sơ đồ tư duy Cân bằng trong dung dịch nước
B. Trắc nghiệm Cân bằng trong dung dịch nước
Đang cập nhật ...
Xem thêm các chương trình khác:
- Soạn văn lớp 11 Kết nối tri thức - hay nhất
- Văn mẫu lớp 11 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 11 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 11 - Kết nối tri thức
- Giải SBT Ngữ văn 11 – Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 11 – Kết nối tri thức
- Giải Chuyên đề học tập Ngữ văn 11 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn lớp 11 – Kết nối tri thức
- Soạn văn 11 Kết nối tri thức (ngắn nhất)
- Giải sgk Toán 11 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 11 – Kết nối tri thức
- Lý thuyết Toán 11 - Kết nối tri thức
- Giải sbt Toán 11 – Kết nối tri thức
- Bài tập Tiếng Anh 11 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 11 – Global success
- Giải sbt Tiếng Anh 11 - Global Success
- Trọn bộ Từ vựng Tiếng Anh 11 Global success đầy đủ nhất
- Ngữ pháp Tiếng Anh 11 Global success
- Giải sgk Vật lí 11 – Kết nối tri thức
- Lý thuyết Vật lí 11 – Kết nối tri thức
- Giải sbt Vật lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 11 – Kết nối tri thức
- Chuyên đề dạy thêm Vật lí 11 cả 3 sách (2024 có đáp án)
- Giải sgk Sinh học 11 – Kết nối tri thức
- Lý thuyết Sinh học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 11 – Kết nối tri thức
- Giải sbt Sinh học 11 – Kết nối tri thức
- Giải sgk Giáo dục Kinh tế và Pháp luật 11 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 11 – Kết nối tri thức
- Lý thuyết Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 11 – Kết nối tri thức
- Giải sgk Lịch sử 11 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 11 – Kết nối tri thức
- Lý thuyết Lịch sử 11 - Kết nối tri thức
- Giải sbt Lịch sử 11 – Kết nối tri thức
- Giải sgk Địa lí 11 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 11 – Kết nối tri thức
- Lý thuyết Địa lí 11 - Kết nối tri thức
- Giải sbt Địa lí 11 – Kết nối tri thức
- Giải sgk Công nghệ 11 – Kết nối tri thức
- Lý thuyết Công nghệ 11 - Kết nối tri thức
- Giải sbt Công nghệ 11 – Kết nối tri thức
- Giải sgk Tin học 11 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 11 – Kết nối tri thức
- Lý thuyết Tin học 11 - Kết nối tri thức
- Giải sbt Tin học 11 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng an ninh 11 – Kết nối tri thức
- Lý thuyết Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sbt Giáo dục quốc phòng 11 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 11 – Kết nối tri thức
