Trắc nghiệm Hóa học 12 Bài 19: Hợp kim
-
347 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Hợp kim có nhiều tính chất hóa học tương tự tính chất của các đơn chất tham gia tạo thành hợp kim, những tính chất vật lí và tính chất cơ học của hợp kim lại khác nhiều với tính chất các đơn chất.
Câu 2:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Thép là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm lượng cacbon chiếm dưới 2%
Câu 3:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Đồng thau là hợp kim của đồng (Cu) và kẽm (Zn)
Câu 4:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Liên kết hoá học chủ yếu trong hợp kim là liên kết kim loại và liên kết cộng hóa trị.
Câu 5:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Giả sử trong hợp kim Al-Mg, có 9 mol Al → có 1 mol Mg
mhợp kim = 9.27 + 1.24 = 267 (gam)
%mAl = = 91%
%mNi = 100% - 91% = 9%
Câu 6:
17/07/2024Cho các tính chất sau:
(1) Tính chất vật lí;
(2) Tính chất hoá học;
(3) Tính chất cơ học.
Hợp kim và các kim loại thành phần tạo hợp kim đó có tính chất nào tương tự?
 Xem đáp án
Xem đáp án
Đáp án C
Hợp kim có nhiều tính chất hóa học tương tự tính chất của các đơn chất tham gia tạo thành hợp kim, những tính chất vật lí và tính chất cơ học của hợp kim lại khác nhiều với tính chất các đơn chất.
Câu 7:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Những hợp kim nhẹ, bền, chịu được nhiệt độ cao, áp suất cao được dùng để chế tạo tên lửa, tàu vũ trụ, máy bay.
Câu 8:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Sử dụng dung dịch FeCl3 dư có thể loại bỏ được Fe
Fe + 2FeCl3 → 3FeCl2
Câu 9:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Thép inoc là hợp kim Fe-Cr-Mn. Hợp kim này không bị ăn mòn
Câu 10:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Khi cho mẫu thuỷ ngân lẫn các tạp chất kém, thiếc, chì phản ứng với Hg(NO3)2 dư sẽ xảy ra các phản ứng:
Zn + Hg(NO3)2 → Zn(NO3)2 + Hg
Sn + Hg(NO3)2 → Sn(NO3)2 + Hg
Pb + Hg(NO3)2 → Pb(NO3)2 + Hg
Vậy toàn bộ các tạp chất được loại bỏ khỏi Hg
Câu 11:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
= 0,02 mol
C + O2 → CO2
→ nC = = 0,02 mol
%mC = = 2,4%
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
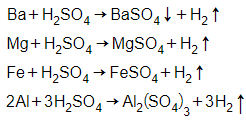
- Trường hợp tạo kết tủa là Ba. Cho Ba dư vào dung dịch, lọc bỏ kết tủa sau phản ứng rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu trong không khí là FeSO4.
→ kim loại ban đầu là Fe.
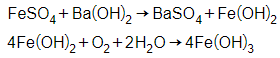
+ Dung dịch tạo kết tủa keo trắng rồi tan dần 1 phần là Al2(SO4)3
→ kim loại ban đầu là Al.
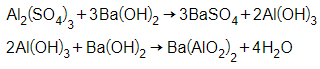
+ Dung dịch tạo kết tủa trắng là MgSO4
→ kim loại ban đầu là Mg.
![]()
Câu 13:
20/07/2024Có các phát biểu sau:
(1) Hợp kim thép (Fe-C) ít bị ăn mòn hơn sắt.
(2) Hợp kim Al-Cu-Mn-Mg nhẹ và cứng, dùng trong chế tạo tên lửa, tàu vũ trụ.
(3) Hợp kim vàng tây (Au-Ag-Cu) cứng hơn vàng nguyên chất.
(4) Hợp kim Bi-Pb-Sn có nhiệt độ nóng chảy rất cao.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(1) Sai vì hợp kim thép (Fe-C) bị ăn mòn nhanh hơn sắt.
(2) Đúng
(3) Đúng
(4) Sai vì hợp kim Bi-Pb-Sn có nhiệt độ nóng chảy thấp, ở khoảng 65oC.
→ Các phát biểu đúng: (2) và (3)
Câu 14:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Áp dụng định luật bảo toàn electron:
3.nFe + 3.nCr = 4.
→ 3.(nFe + nCu) = 4.
→ 3.0,1 = 4
→ = 0,075 mol
→ V = 0,075.22,4 = 1,680 lít
Câu 15:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= 0,15 mol
Bào toàn electron:
nNa + nK = 2. = 0, 3 (1)
Lại có: mNa + mK = 7,7
→ 23.nNa + 39.nK = 7,7 (2)
Từ (1) và (2) → nNa = 0,25 mol; nK = 0,05 mol
%mNa = = 74,68%
%mK = = 25,32%
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Hợp kim là vật liệu kim loại có chứa một kim loại cơ bản và một số kim loại hoặc phi kim khác
Câu 17:
18/07/2024Để xác định hàm lượng C trong một mẫu họp kim Fe-C, người ta đem nung m gam hợp kim này trong không khí. Sau phản ứng hoàn toàn, chất rắn thu được có khối lượng tăng 28,89% so với lượng chất rắn ban đầu
Công thức hoá học của loại hợp kim trên là
 Xem đáp án
Xem đáp án
Đáp án D
Đặt số mol Fe và C trong hợp kim lần lượt là x và y (mol).
Vậy m = 56x + 12y
Phản ứng xảy ra khi nung hợp kim này trong không khí:
Sau phản ứng có mol O2 thêm vào và y mol C tách ra khỏi chất rắn
Khối lượng tăng thêm là: .32 – 12y (gam)
Theo đề ta có:
= 28,89%
→ x : y = 3 : 1
Vậy công thức hợp kim là Fe3C.
Câu 18:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Giả sử trong hợp kim Al-Ni, có 10 mol Al → có 1 mol Ni
mhợp kim = 10.27 + 1.58 = 328 (gam)
%mAl = = 82%
%mNi = 100% - 82% = 18%
Câu 19:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Hỗn hợp X tác dụng với O2 thu được chất rắn gồm: BaO và CuO
2Ba + O2 2BaO
2Cu + O2 2CuO
Khối lượng chất rắn tăng chính là khối lượng của O2 tham gia phản ứng
→ = 0,2 mol
n hh X = 2. = 0,4 mol
Chất rắn cho tác dụng với H2 thì chỉ có CuO tham gia phản ứng
CuO + H2 Cu + H2O
Dựa vào phương trình ta thấy, khối lượng chất rắn giảm chính là lượng của oxi mất đi
nCuO = nO =
= 0,2 mol = nCu
→ nBa = 0,4 – 0,2 = 0,2 mol
Khối lượng chất rắn
X = 0,2.64 + 0,2.137 = 40,2g
Câu 20:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Ta sử dụng dung dịch H2SO4 loãng và NH3
- Hòa tan từng mẫu hợp kim vào dung dịch H2SO4 loãng
+ Hợp kim không bị hòa tan trong H2SO4 loãng là Cu-Ag
+ Hợp kim bị hòa tan môt phần, có khí thoát ra là: Cu-Al; Cu-Zn
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Zn + H2SO4 → ZnSO4 + H2
- Nhỏ tiếp NH3 dư vào sản phẩm tạo thành ở hai mẫu Cu-Al ; Cu-Zn.
+ Xuất hiện kết tủa và kết tủa không tan: Cu-Al
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
Do NH3 là bazơ yếu nên không hòa tan được Al(OH)3
+ Xuất hiện kết tủa, kết tủa tan: Cu-Zn
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 21:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Năng lượng ion hóa thứ nhất của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi trạng thái cơ bản.
Trong một chu kì ,theo chiều tăng dần điện tích hạt nhân, lực liên kết giữa hạt nhân và các electron cũng tăng, làm cho năng lượng ion hóa thứ nhất cũng tăng.
→ Năng lượng ion hóa của kim loại nhỏ hơn của phi kim
Trong một chu kì, theo chiều tăng của điện tích hạt nhân thì năng lương ion hóa, độ âm điện, bán kính nguyên tử của các nguyên tố giảm dần.
Câu 22:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2 – 5%, ngoài ra còn có một lượng nhỏ các nguyên tố khác như Si, Mn, S,...
Gang cứng và giòn hơn sắt.
Câu 23:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phương trình ion thu gọn của phản ứng
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
= 0,04 mol
Gọi x và y là số mol của Zn và Fe
Theo bài ra: mZn + mFe = 2,33
→ 65x + 56y = 2,33 (1)
Bảo toàn electron:
2.nZn + 2.nFe = 2.
→ nZn + nFe = 0,04 (2)
Từ (1) và (2) → x = 0,01; y = 0,03
Phần trăm về khối lượng về khối lượng của hợp kim này là:
%mZn = = 27,9%;
%mFe = 100% - 27,9% = 72,1%
Câu 24:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= 0,15 mol
= 2. = 0,3 mol
= 0,3 mol
→ VHCl = 0,3 : 2 = 0,15 lít
= 150 ml
Câu 25:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
m rắn Y = mCu = 2,54 gam
→ mMg + mAl = 9,14 – 2,54 = 6,6 gam (1)
Lại có mAl = 4,5.mMg (2)
Từ (1) và (2)
→ mAl = 5,4 gam; mMg = 1,2 gam
→ nAl = 0,2 mol; nMg = 0,05 mol
Bảo toàn eletron:
3.nAl + 2.nMg = 2.
→ 3.0,2 + 2.0,05 = 2.
→ = 0,35 mol
→ VX = 0,35.22,4 = 7,84 lít
Câu 26:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
mFe + mCr + mAl = 100
→ 56.nFe + 52.nCr + 27.nAl = 100 (1)
Số mol H2 tạo thành sau phản ứng với NaOH là: = 0,3 mol
Bảo toàn electron cho phản ứng kim loại với dung dịch kiềm (kim loại Fe, Cr không tan trong dung dịch kiềm)
3.nAl = 2. = 0,6 mol (2)
Số mol H2 tạo thành sau phản ứng với HCl là:
= 1,7 mol
Bảo toàn electron cho phản ứng kim loại với dung dịch HCl
2.nFe + 2nCr = 2. = 3,4 (3)
Từ (1), (2) và (3)
→ nFe = 1,55 mol;
nCr = 0,15 mol; nAl = 0,2 mol
%mCr = = 7,8%
Câu 27:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Sử dụng NaOH để phân biệt
- Hợp kim tan một phần trong NaOH dư: Fe-Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Hợp kim tan hoàn toàn trong NaOH dư: K-Na
2K + 2H2O → 2KOH + H2
2Na + 2H2O → 2NaOH + H2
- Hợp kim không tan trong NaOH dư: Cu-Mg
Câu 28:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Gọi công thức hóa học của hợp kim là CuxZny
→ x : y =
→ x : y = 3 : 2
→ Công thức hóa học của hợp kim là Cu3Zn2
Câu 29:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Kim loại nào có tính khử yếu nhất sẽ bị đẩy ra trước.
→ Chất rắn B gồm Ag, Cu, Fe với số mol lần lượt là x, y, z mol
Ta có: 108x + 64y + 56z = 8,12 (1)
Fe + 2HCl → FeCl2 + H2
nFe = = 0,03 mol
→ z = 0,03 mol (2)
Từ (1) và (2) suy ra:
108x + 64y = 6,44 (3)
nAl ban đầu = 0,03 mol;
nFe ban đầu = 0,05 mol
→ nFe phản ứng = 0,05 – 0,03
= 0,02 mol
nAl phản ứng = 0,03 mol
Áp dụng định luật bảo toàn electron:
n e nhường = n e nhận
3.nAl phản ứng + 2.nFe phản ứng = nAg + 2.nCu
→ 0,03.3 + 0,02.2 = 0,13 = x + 2y (4)
Từ (3) và (4) suy ra: x = 0,03, y = 0,05
→ = 0,5 M
Câu 30:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Hợp kim có tính chất vật lí và tính chất cơ học khác nhiều so với các kim loại thành phần
- Có tính dẫn điện, dẫn nhiệt, tính dẻo và ánh kim do trong hợp kim vẫn có các electron tự do.
- Tuy nhiên tính dẫn điện, dẫn nhiệt của hợp kim giảm so với kim loại thành phần do mật độ eletron tự do trong hợp kim giảm đi rõ rệt.
- Có độ cứng cao hơn so với các kim loại thành phần do có sự thay đổi về cấu tạo mạng tinh thể, thay đổi về thành phần của ion trong mạnh tinh thể.
Có thể bạn quan tâm
- Trắc nghiệm Hợp kim (có đáp án) (346 lượt thi)
- 7 Câu trắc nghiệm hợp kim có đáp án (230 lượt thi)
Các bài thi hot trong chương
- 80 câu trắc nghiệm Đại cương về kim loại cơ bản (1114 lượt thi)
- 100 câu trắc nghiệm Đại cương về kim loại nâng cao (809 lượt thi)
- Trắc nghiệm Điều chế kim loại (có đáp án) (732 lượt thi)
- Trắc nghiệm Ăn mòn kim loại (có đáp án) (522 lượt thi)
- Trắc nghiệm Luyện tập tính chất của kim loại (có đáp án) (393 lượt thi)
- Trắc nghiệm Tính chất của kim loại, dãy điện hóa kim loại (có đáp án) (361 lượt thi)
- Trắc nghiệm Tính chất của kim loại. Dãy điện hóa của kim loại có đáp án (Thông hiểu) (350 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại (có đáp án) (341 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Thông hiểu) (300 lượt thi)
- Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại (có đáp án) (269 lượt thi)
