Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại (có đáp án)
Trắc nghiệm Hóa học 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
-
342 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là: 1s22s22p63s1
Câu 2:
18/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Trong một chu kì, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử tăng dần.
Na, Mg, Al, Si đều thuộc chu kì 3 và ZNa < ZMg < ZAl < ZSi
→ Chiều tăng dần độ âm điện là: Na < Mg < Al < Si
Câu 3:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trong bảng tuần hoàn hiện nay nhóm IIA chứa toàn bộ là các nguyên tố kim loại.
Câu 4:
16/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Đặt công thức của oxit kim loại là M2Ox
Vì M là kim loại nên x có thể nhận các giá trị 1, 2, 3, 4
Theo đề: 16.x = 0,4.2M → M = 20x
Lập bảng
|
x |
1 |
2 |
3 |
4 |
|
M |
20 |
40 |
60 |
80 |
|
|
Loại |
Thỏa mãn |
Loại |
Loại |
Vậy kim loại M là Ca, oxit tạo thành là CaO
Câu 5:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Na và K thuộc cùng nhóm IA và ZNa < ZK → Tính kim loại: Na < K.
Na, Mg và Al thuộc cùng chu kỳ 3 và ZNa < ZMg < ZAl
→ Tính kim loại Al < Mg < Na
Chiều tăng dần tính kim loại: Al < Mg < Na < K.
Câu 6:
11/11/2024 Xem đáp án
Xem đáp án
Đáp án đúng là : A
- Trong một chu kì, khi điện tích hạt nhân tăng thì tính kim loại tăng dần là sai
- Trong một chu kỳ, khi điện tích hạt nhân tăng thì tính kim loại không tăng dần mà ngược lại, tính kim loại giảm dần. Điều này là do các yếu tố sau:
+ Sự tăng của điện tích hạt nhân: Khi đi từ trái sang phải trong cùng một chu kỳ, điện tích hạt nhân tăng lên, kéo các electron về gần hạt nhân hơn. Điều này làm cho nguyên tử khó mất electron hơn, dẫn đến tính kim loại giảm.
+ Độ âm điện và năng lượng ion hóa tăng: Độ âm điện (khả năng hút electron) và năng lượng ion hóa (năng lượng cần để tách electron ra khỏi nguyên tử) đều tăng dần khi đi từ trái sang phải. Các nguyên tố càng về bên phải của chu kỳ càng dễ thu nhận electron để đạt cấu hình bền vững, vì vậy tính phi kim tăng lên.
+ Sự thay đổi cấu hình electron: Các nguyên tố ở bên trái chu kỳ thường có cấu hình electron dễ mất electron để trở thành ion dương (tính kim loại cao), trong khi các nguyên tố bên phải lại dễ thu electron để đạt cấu hình bền hơn (tính phi kim cao hơn).
- Vì vậy, khi điện tích hạt nhân tăng trong cùng một chu kỳ, tính kim loại không tăng mà ngược lại, nó giảm dần.
→ A đúng.B,C,D sai.
* Cấu tạo của kim loại
1. Cấu tạo nguyên tử
- Nguyên tử của hầu hết các nguyên tố kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
Ví dụ:
+ Na: [Ne]3s1 có 1electron ở lớp ngoài cùng.
+ Mg: [Ne]3s2 có 2 electron ở lớp ngoài cùng.
+ Al: [Ne]3s23p1 có 3 electron ở lớp ngoài cùng.
- Trong chu kì, nguyên tử của nguyên tố kim loại có bán kính nguyên tử lớn hơn và điện tích hạt nhân nhỏ hơn so với các nguyên tử của nguyên tố phi kim.
Ví dụ xét với chu kì 3:
|
Nguyên tử |
11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
|
rnt |
0,157 |
0,136 |
0,125 |
0,117 |
0,110 |
0,104 |
0,099 |
2. Cấu tạo tinh thể
- Ở nhiệt độ thường, trừ thủy ngân ở thể lỏng, còn các kim loại khác ở thể rắn, có cấu tạo tinh thể.
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút mạng của tinh thể. Các electron hóa trị liên kết yếu với hạt nhân nên dễ tách ra khỏi nguyên tử và chuyển động tự do trong mạng tinh thể.
- Có ba kiểu mạng tinh thể kim loại đặc trưng là: lập phương tâm khối, lập phương tâm diện và lục phương.
a) Mạng tinh thể lục phương
- Đặc điểm: Các nguyên tử, ion kim loại nằm trên các đỉnh và tâm các mặt của hình lục giác đứng và ba nguyên tử, ion nằm phía trong của hình lục giác.
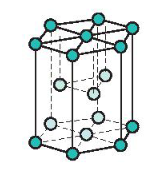
Mạng tinh thể lục phương
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Be, Mg, Zn …
b) Mạng tinh thể lập phương tâm diện
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm các mặt của hình lập phương.
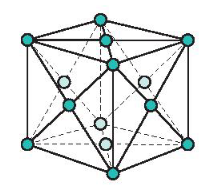
Mạng tinh thể lập phương tâm diện
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chiểm 74%, còn lại 26% là không gian trống.
- Thuộc loại này có các kim loại: Cu, Ag, Au, Al …
c) Mạng tinh thể lập phương tâm khối
- Đặc điểm: Các nguyên tử và ion kim loại nằm trên các đỉnh và tâm của hình lập phương.
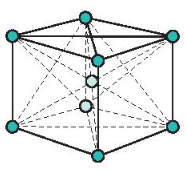
Mạng tinh thể lập phương tâm khối
- Trong tinh thể, thể tích của các nguyên tử và ion kim loại chỉ chiếm 68%, còn lại 32% là các không gian trống.
- Thuộc loại này có các kim loại: Li, Na, K, V, Mo …
3. Liên kết kim loại
Liên kết kim loại là liên kết được hình thành giữa nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hoá 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Mục lục Giải SBT Hóa 12 Bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
Câu 7:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Bào toàn nguyên tố H:
nHCl = 2.
→ nCl- = nHCl = 0,06 mol
Áp dụng định luật bảo toàn khối lượng:
mmuối = mKL + mCl-
= 3 + 0,06.35,5 = 5,13g
Câu 8:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Số mol H+ là 0,1 mol
Fe + 2H+ Fe2+ + H2
Mol 0,05 0,1
Khối lượng sắt bị tan là: 2,8 gam
Vậy thể tích sắt bị mất đi:
V = = = 0,36 cm3
Thể tích ban đầu của viên bi:
V1 = =
= 4,19 cm3
Vậy thể tích của viên bi sắt còn lại sau phản ứng là:
V2 = V1 – V = 4,19 – 0,36
= 3,83 cm3
Bán kính viên bi còn lại:
=
= 0,97 cm
Câu 9:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
X và Z cùng chu kì, ZX > ZZ nên tính kim loại của X < Z
Y và Z cùng nhóm IA và ZY > ZZ nên tính kim loại của Y > Z
Suy ra tính kim loại: X < Z < Y
Câu 10:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
A. Sai. Vì He có cấu hình e lớp ngoài cùng là 1s2 và là khí hiếm
Câu 11:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Gọi công thức chung của 2 kim loại là: R
RCO3 + 2H+ R2+ + CO2 + H2O
→ = 0,3
→ R = 34,6
→ 2 Kim loại là: Mg (M = 24); Ca (M = 40)
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Li và Na thuộc cùng nhóm IA và ZLi < ZNa
→ Bán kính Na > Li
Li, Be và B thuộc cùng chu kỳ 2 và ZLi < ZBe < ZB
→ Bán kính: Li > Be > B
Chiều tăng dần bán kính: B < Be < Li < Na
Câu 13:
17/07/2024Nguyên tố X ở ô số 24 của bảng tuần hoàn. Một học sinh đã đưa ra các nhận xét về nguyên tố X như sau :
(1) X có 6 e hoá trị và là nguyên tố kim loại.
(2) X là một nguyên tố nhóm d.
(3) X nằm ở chu kì 4 của bảng tuần hoàn.
(4) Ở trạng thái cơ bản, X có 6 e ở phân lớp s;
Trong các nhận xét trên, số nhận xét đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron nguyên tử nguyên tố X:
1s22s22p63s23p63d54s1
→ X có 6 electron hóa trị, nguyên tố d, là nguyên tố kim loại.
Trạng thái cơ bản có 7e ở phân lớp s
X ở chu kỳ 4 của bảng tuần hoàn
→ Các phát biểu (1), (2), (3) đúng
Câu 14:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Nhóm A bao gồm các nguyên tố s và nguyên tố p
Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA và IIA
Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ He)
Câu 15:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Ta có nHCl = 0,2 mol
Xét các phản ứng:
2R + 2HCl → 2RCl + H2
2R + 2H2O → 2ROH + H2
nCl- = nHCl = 0,2 mol;
mR = 17,55 gam
Trong 28,9 gam chất rắn bao gồm ROH và RCl
→ m rắn =
→ 28,9 = 17,55 + 0,2.35,5 + 17. nOH-
→ nOH- = 0,25 mol
nR = nCl- + nOH-
= 0,2 + 0,25 = 0,45 mol
→ MR = 39 (g/mol) → R là kim loại K
Câu 16:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
X (Z = 12): [Ne]3s2
Vậy X ở chu kỳ 3 (do có 3 lớp electron); nhóm IIA (do có 2electron hóa trị, nguyên tố s)
Câu 17:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.
Câu 18:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Bào toàn nguyên tố H:
= 0,6 mol
→ mKL + mHCl = m muối +
→ 15,4 + 36,5.0,6 = m muối + 2.0,3
→ m muối = 36,7 gam
Câu 19:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Gọi số mol Fe ở mỗi phần là x mol
Fe + O2 Fe2O3
mol
→
Fe + Cl2 FeCl3
→ 162,5x – 80x = 8,25 gam
→ x = 0,1 mol
→ m = 2.0,1.56 = 11,2 gam
Câu 20:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Ta có: M2+ + 2e → M
→ Cấu hình electron của M là:
1s22s22p63s23p63d64s2
- Biện luận:
+ Z = 26 → Ô 26
+ Có 4 lớp electron → Chu kỳ 4
+ Electron cuối cùng điền vào phân lớp d nên thuộc nhóm B. Tổng số e hóa trị là 8 → Nhóm VIIIB
Vậy vị trí của M trong bảng tuần hoàn là ô 26, chu kỳ 4, nhóm VIIIB
Câu 21:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
A. Sai. Vì một số kim loại có khối lượng riêng nhẹ hơn nước (Li, Na, K,...)
C. Sai. Vì một số kim loại có nhiều số oxi hóa trong hợp chất (Fe, Cr, Cu,...)
D. Sai. Vì ở điều kiện thường, Hg tồn tại ở thể lỏng
Câu 22:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Bảo toàn electron:
2.nM = 2.
→ 2.= 2.0,1
→ MM = 24 (g/mol) → Kim loại Mg.
Câu 23:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Na có cấu hình electron là 1s22s22p63s1
→ Na+ có cấu hình electron là 1s22s22p6
F có cấu hình electron là 1s22s22p5
→ F- có cấu hình electron là 1s22s22p6
Ne có cấu hình electron là 1s22s22p6
Vậy Na+, F- và Ne đều có cấu hình electron là 1s22s22p6
Câu 24:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Số electron lớp ngoài cùng của nguyên tử kim loại thường có ít (từ 1 → 3),
Nguyên tử có 4 lectron lớp ngoài cùng có thể là kim loại hoặc phi kim.
Câu 25:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án A
nFe = 0,16 mol
Bảo toàn nguyên tố: = nFe = 0,16 mol
→ = 0,16.152 = 24,32 gam
Câu 26:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án B
![]()
Tổng hệ số cân bằng của phản ứng là:
4 + 10 + 4 + 1 + 3 = 22
Câu 27:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Kim loại không tan trong dung dịch NaOH là Mg.
Zn và Al tan được trong dung dịch kiềm.
Na tác dụng với nước trong dung dịch
Câu 28:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Trong hợp kim ngoài liên kết kim loại còn có liên kết công hóa trị vì vậy mật độ electron tự do trong hợp kim giảm đi rõ rệt. Do đó tính dẫn điện, dẫn nhiệt kém hơn kim loại thành phần.
Mở rộng: Độ cứng của hợp kim thường lớn hơn độ cứng của kim loại thành phần.
Câu 29:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
M2+ có cấu hình e ở lớp ngoài cùng là 2s22p6
→ Cấu hình electron của M là 1s22s22p63s2
Câu 30:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Vì trong 1 chu kì, kim loại có độ âm điện nhỏ hơn phi kim
→ nguyên tử kim loại thường dễ nhường electron trong các phản ứng hóa học.
Có thể bạn quan tâm
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại (có đáp án) (341 lượt thi)
- 15 Câu trắc nghiệm vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại có đáp án (213 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại có đáp án (Nhận biết) (209 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại có đáp án (Thông hiểu) (198 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại có đáp án (Vận dụng) (215 lượt thi)
Các bài thi hot trong chương
- 80 câu trắc nghiệm Đại cương về kim loại cơ bản (1115 lượt thi)
- 100 câu trắc nghiệm Đại cương về kim loại nâng cao (810 lượt thi)
- Trắc nghiệm Điều chế kim loại (có đáp án) (733 lượt thi)
- Trắc nghiệm Ăn mòn kim loại (có đáp án) (523 lượt thi)
- Trắc nghiệm Luyện tập tính chất của kim loại (có đáp án) (393 lượt thi)
- Trắc nghiệm Tính chất của kim loại, dãy điện hóa kim loại (có đáp án) (361 lượt thi)
- Trắc nghiệm Tính chất của kim loại. Dãy điện hóa của kim loại có đáp án (Thông hiểu) (350 lượt thi)
- Trắc nghiệm Hợp kim (có đáp án) (347 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Thông hiểu) (300 lượt thi)
- Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại (có đáp án) (270 lượt thi)
