Trắc nghiệm Điều chế kim loại (có đáp án)
Trắc nghiệm Bài 21: Điều chế kim loại
-
740 lượt thi
-
30 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp điện phân nóng chảy dùng để điều chế kim loại có tính khử mạnh (kim loại nhóm IA, IIA và Al)
Câu 2:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Điều chế kim loại là quá trình khử ion kim loại thành kim loại
Rn+ + ne → R
Ion kim loại Rn+ đóng vai trò là chất oxi hóa (chất bị khử)
Câu 3:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Kim loại nhôm được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
2Al2O3 4Al + 3O2
Câu 4:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp nhiệt luyện là phương pháp điều chế kim loại bằng cách dùng chất khử mạnh như H2, CO, C, NH3, Al khử các oxit kim loại ở nhiệt độ cao.
Phương pháp nhiệt luyện dùng để điều chế kim loại đứng sau Al trong dãy hoạt động hóa học.
Câu 5:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Điện phân nóng chảy NaOH và NaCl
4NaOH 4Na + O2 + 2H2O
2NaCl 2Na + Cl2
Câu 6:
21/07/2024Tiến hành các thí nghiệm sau:
(a) Điện phân MgCl2 nóng chảy
(b) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư
(c) Nhiệt phân hoàn toàn CaCO3
(d) Cho kim loại Na vào dung dịch CuSO4 dư.
(e) Dẫn khí H2 dư đi qua bột CuO nung nóng.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Đáp án A
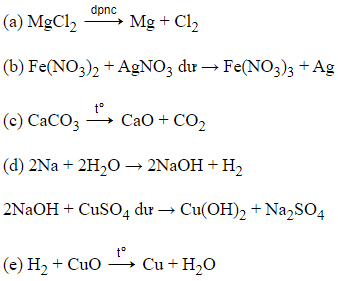
→ Phản ứng (a), (b), (e) thu được kim loại
Câu 7:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Phản ứng (1):
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Phản ứng (2): CaCl2 Ca + Cl2
Câu 8:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án A
MgCl2 Mg + Cl2
Câu 9:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp nhiệt luyện dùng để điều chế kim loại đứng sau Al trong dãy hoạt động hóa học
Câu 10:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Ở catot (cực âm) xảy ra quá trình khử ion kim loại hoặc nước.
Cu2+ +2e → Cu
Câu 11:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
A. Đúng.
Catot (-): Zn2+ + 2e → Zn
B. Đúng.
2AgNO3 2Ag + 2NO2 + O2
C. Không đúng. Vì H2 chỉ khử được kim loại hoạt động trung bình, yếu (kim loại đứng sau Al trong dãy hoạt động hóa học).
D. Đúng.
Zn + Cu2+ → Zn2+ + Cu
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
Ion kim loại nào có tính oxi hóa mạnh nhất sẽ bị khử trước
Ag+ > Pb2+ > Fe2+ > Zn2+
Mg2+ không bị khử
Câu 13:
23/07/2024Một nhóm học sinh đã đề xuất các cách điều chế Ag từ AgNO3 như sau:
(1) Cho kẽm tác dụng với dung dịch AgNO3.
(2) Điện phân dung dịch AgNO3.
(3) Cho dung dịch AgNO3 tác dụng với dung dịch NaOH sau đó thu lấy kết tủa đem nhiệt phân.
(4) Nhiệt phân AgNO3.
Trong các cách điều chế trên, có bao nhiêu cách có thể áp dụng để điều chế Ag từ AgNO3 ?
 Xem đáp án
Xem đáp án
Đáp án D
(1) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
(2) 4AgNO3 + 2 H2O → 4Ag + 4HNO3 + O2
(3) 2AgNO3 + 2NaOH → Ag2O + H2O + 2NaNO3
2Ag2O O2 + 4Ag
(4) 2AgNO3 2Ag + 2NO2 + O2
Câu 14:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
CO khử được oxit kim loại đứng sau Al trong dãy hoạt động hóa học
→ Sau khi phản ứng hoàn toàn thu được Y gồm: MgO, Cu, Al2O3, Fe
Câu 15:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Hai ion K+ và SO42- đều không điện phân
Nên nước điệp phân ngay ở cả hai điện cực, sinh ra khí H2 ở catot và khí O2 ở anot
Catot (-): H2O + 2e → H2 + 2OH-
Anot (+): 2H2O → O2 + 4e + 4H+
Câu 16:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Catot: Pb2+ + 2e → Pb
Pb2+ là chất oxi hóa (bị khử)
Câu 17:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Gọi = a mol; nNO = b mol
→ a + b = 0,04 (1)
Xét toàn bộ quá trình chỉ có Al cho e và HNO3 nhận e
Bảo toàn e: 3nAl = + 3nNO
→ a + 3b = 3.0,02 (2)
Từ (1) và (2) → a = 0,03; b = 0,01
→ nNO = b = 0,01
→ VNO = 0,01.22,4 = 0,224 lít
Câu 18:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án B
- Kim loại nhôm chỉ được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
- Mg và Na chỉ được điều chế bằng phương pháp điện phân nóng chảy hiđiroxit hoặc muối halogenua của chúng.
Câu 19:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án B
mol
= 0,25 mol
Áp dụng định luật bảo toàn khối lượng ta có:
moxit + mCO = m rắn +
→ 30 + 28.0,25 = m rắn + 0,25.44
→ m = 26 gam
Câu 20:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
nCu = 0,05.0,2 = 0,01 mol
Bảo toàn e: ne nhường = ne nhận
→ 2.nFe = 2.nCu
→ nFe = 0,01 mol
→ mFe = 0,56 gam
Câu 21:
21/07/2024 Xem đáp án
Xem đáp án
Đáp án B
nFe = 0,01 mol;
= 0,03 mol;
= 0,05 mol
Kim loại Ag+ có tính oxi hóa mạnh hơn nên sẽ phản ứng trước
Ta thấy: cho tối đa = 0,01.3 = 0,03 mol = nhận tối đa
→ Fe phản ứng hết với Ag, tạo thành Fe3+ và Ag
→ nAg = = 0,03 mol
→ m = 0,03.108 = 3,24 gam
Câu 22:
22/07/2024Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). Tính khối lượng Fe thu được?
 Xem đáp án
Xem đáp án
Đáp án B
= 0,2 mol
phản ứng = nO trong oxit bị mất = 0,2 mol
m oxit = mFe + mO
→ 17,6 = mFe + 0,2.16
→ mFe = 14,4 gam
Câu 23:
17/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Kim loại đứng trước, không phản ứng với nước đẩy được kim loại đứng sau trong dãy hoạt động hóa học ra khỏi muối.
Câu 24:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Cho khí CO dư đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thì CO chỉ khử các oxit kim loại sau nhôm:
4CO + Fe3O4 3Fe + 4CO2
CO + CuO Cu + CO2
Chất rắn Y có chứa Al2O3, MgO, Fe, Cu
Cho chất rắn Y vào dung dịch NaOH dư thì:
Al2O3 + 2NaOH → 2 NaAlO2 + H2O
Phần không tan Z là MgO, Fe và Cu.
Câu 25:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp điện phân dung dịch dùng để điều chế kim loại có tính khử trung bình và yếu (đứng sau Al trong dãy hoạt động hóa học)
Câu 26:
19/07/2024 Xem đáp án
Xem đáp án
Đáp án C
Tại catot sẽ lần lượt xảy ra các quá trình:
(1) Fe3+ + 1e → Fe2+
(2) Cu2+ + 2e → Cu
(3) Fe2+ + 2e → Fe
(4) 2H2O + 2e → H2 + 2OH-
Tại anot sẽ lần lượt xảy ra các quá trình:
a) 2Cl- → Cl2 + 2e
b) 2H2O → 4H+ + O2 + 4e
Trong dung dịch ban đầu có 0,4 mol Fe3+, 0,2 mol Cu2+, 0,4 mol Cl- và các ion khác không tham gia phản ứng điện phân
A. Sai. Khi catot tăng 12,8 gam, tức là Cu2+ vừa hết, phản ứng (2) vừa kết thúc. Khi đó dung dịch chỉ có màu trắng xanh của Fe2+.
B. Sai. Khi khối lượng catot tăng lên 6,4 gam, tức là đã có 0,1 mol Cu2+ bị điện phân. Vậy phản ứng (1) đã xảy ra hết, phản ứng (2) xảy ra một phần
Áp dụng công thức : q = ∑ni ziF
Trong đó ni là số mol chất i (phân tử hoặc ion) bị điện phân, zi là số e của chất i trao đổi ở điện cực
Ta có: q = (0,4.1 + 0,1.2).96500 = 57900 (C)
C. Đúng. Khi có 4,48 lít khí thoát ra ở anot, tức là có 0,2 mol khí thoát ra suy ra phản ứng (a) xảy ra hoàn toàn và vừa đủ. Tại anot có 0,4 mol e trao đổi.
Đông thời tại catot phản ứng (1) xảy ra hoàn toàn và vừa đủ. Chưa có kim loại kết tử trên điện cực.
D. Sai. Khi có khí bắt đầu thoát ra ở catot tức là các phản ứng (1) (2) (3) (4) đã xảy ra hoàn toàn. Số e trao đổi ở catot là 1,4 mol.
Tại anot, phản ứng (a) đã xảy ra hoàn toàn và có 0,4 mol electron đã tiêu thụ trong phản ứng (a), sinh ra 0,2 mol Clo
Số e tiêu thụ cho phản ứng (b) sẽ là 1 mol. Vậy có 0,25 mol khí oxi sinh ra.
Tổng số mol khí sinh ra tại anot trong trường hợp này là 10,08 lít.
Câu 27:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp điện phân dung dịch dùng để điều chế kim loại có tính khử trung bình và yếu (đứng sau Al trong dãy hoạt động hóa học)
Ion kim loại nào có tính oxi hóa mạnh nhất sẽ bị khử trước
Ag+ > Fe3+ > Cu2+ > H+ > Fe2+ > Zn2+ > H2O
Trước khi có khí thoát ra tức là trước khi H2O ở catot điện phân
Kim loại cuối cùng thoát ra là Zn
Câu 28:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án A
Ngâm hỗn hợp kim loại Ag và Cu vào dung dịch AgNO3 thì
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Lọc bỏ dung dịch thu được chất rắn chứa Ag.
Câu 29:
20/07/2024 Xem đáp án
Xem đáp án
Đáp án A
= 0,15 mol
→ mFe tối đa sinh ra = 0,15.56
= 8,4 gam > 3,92 gam
→ chất rắn chỉ có Fe, Zn đã phản ứng hết
nFe sinh ra = = 0,07 mol
Phương trình phản ứng:
Zn + 2FeCl3 → ZnCl2 + 2FeCl2
Zn + FeCl2 → ZnCl2 + Fe
FeCl3 phản ứng với Zn tạo thành Fe (0,07 mol) và FeCl2 (0,15 – 0,07 = 0,08 mol)
Bảo toàn e: 2nZn = 3nFe +
→ nZn = 0,145 mol
→ m = 9,425 gam
Câu 30:
23/07/2024 Xem đáp án
Xem đáp án
Đáp án B
→ ne = = mol
Catot (-): Cu2+ + 2e → Cu
→ nCu =
→ mCu = .64 0,4 gam
Có thể bạn quan tâm
- Trắc nghiệm Điều chế kim loại (có đáp án) (739 lượt thi)
- 15 Câu trắc nghiệm Điều chế kim loại có đáp án (212 lượt thi)
- Trắc nghiệm Điều chế kim loại có đáp án (Nhận biết) (269 lượt thi)
- Trắc nghiệm Điều chế kim loại có đáp án (Thông hiểu) (227 lượt thi)
- Trắc nghiệm Điều chế kim loại có đáp án (Vận dụng) (247 lượt thi)
Các bài thi hot trong chương
- 80 câu trắc nghiệm Đại cương về kim loại cơ bản (1132 lượt thi)
- 100 câu trắc nghiệm Đại cương về kim loại nâng cao (846 lượt thi)
- Trắc nghiệm Ăn mòn kim loại (có đáp án) (530 lượt thi)
- Trắc nghiệm Luyện tập tính chất của kim loại (có đáp án) (395 lượt thi)
- Trắc nghiệm Tính chất của kim loại, dãy điện hóa kim loại (có đáp án) (364 lượt thi)
- Trắc nghiệm Tính chất của kim loại. Dãy điện hóa của kim loại có đáp án (Thông hiểu) (352 lượt thi)
- Trắc nghiệm Hợp kim (có đáp án) (351 lượt thi)
- Trắc nghiệm Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại (có đáp án) (345 lượt thi)
- Trắc nghiệm Luyện tập: Tính chất của kim loại có đáp án (Thông hiểu) (300 lượt thi)
- Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại (có đáp án) (277 lượt thi)
